
- •Розділ 1. Механіка
- •§ 1.1. Кінематика механічного руху
- •§ 1.2. Швидкість і прискорення
- •§ 1.3. Кінематика обертового руху матеріальної точки
- •§ 1.4 Закони динаміки. Поняття маси, сили, імпульсу, імпульсу сили. Інерціальні системи відліку
- •§ 1.5. Імпульс системи. Закон збереження імпульсу
- •§ 1.6. Центр мас (інерції) системи. Закон руху центра мас
- •§ 1.7. Межі застосування класичного опису частинок
- •§ 1.8. Основний закон динаміки поступального руху твердого тіла
- •§ 1.9. Динаміка обертового руху твердого тіла відносно осі. Поняття моменту інерції, моменту сили та моменту імпульсу твердого тіла.
- •§ 1.10. Закон збереження моменту імпульсу твердого тіла відносно осі
- •§ 1.11. Поняття енергії і роботи. Робота сили. Потужність.
- •§ 1.12. Кінетична енергія. Теорема про зміну кінетичної енергії.
- •§ 1.13. Потенціальні і непотенціальні сили
- •§ 1.14. Потенціальна енергія та її зв’язок з потенціальними силами
- •§ 1.15. Потенціальна енергія гравітаційної взаємодії
- •§ 1.16. Потенціальна енергія пружної взаємодії
- •§ 1.17. Повна механічна енергія. Закон збереження повної механічної енергії.
- •§ 1.18. Графічне представлення енергії
- •§ 1.19. Перетворення координат Галілея
- •§ 1.20. Інерціальні системи відліку. Механічний принцип відносності
- •§ 1.21. Неінерціальні системи відліку. Сили інерції
- •§ 1.22. Властивості простору і часу у класичній механіці
- •§ 1.23. Постулати спеціальної теорії відносності (ств). Перетворення Лоренца
- •§ 1.24. Властивості простору і часу в релятивістській механіці (наслідки із перетворень Лоренца)
- •§ 1.25. Правила додавання швидкостей в релятивістській механіці
- •§1.26 Релятивістський імпульс
- •§1.27 Основний закон динаміки теорії відносності. Релятивістська енергія
- •§1.28 Зв’язок енергії з імпульсом і маси з енергією спокою
- •§ 1.29. Гідростатика нестисливої рідини. Закон Паскаля. Гідростатичний тиск. Закон Архімеда
- •§ 1.30. Рух ідеальної рідини. Рівняння нерозривності. Рівняння Бернуллі
- •§ 1.31. Гідродинаміка в’язкої рідини. Сила Стокcа
- •Розділ 2. Основи молекулярної фізики і термодинаміки
- •§ 2.1. Статистичний і термодинамічний методи дослідження. Тепловий рух. Основні поняття
- •§ 2.2. Рівняння стану ідеального газу
- •§ 2.3. Основне рівняння молекулярно-кінетичної теорії газів
- •§ 2.4. Середня квадратична швидкість молекул. Молекулярно-кінетичне тлумачення температури
- •§ 2.5. Розподіл Максвела молекул за швидкостями та енергіями
- •§ 2.6. Барометрична формула. Розподіл Больцмана частинок у потенціальному полі
- •§ 2.7. Внутрішня енергія системи. Теплота і робота
- •§ 2.8. Робота розширення (стискання) газу
- •§ 2.9. Перше начало термодинаміки та його застосування до ізопроцесів
- •§ 2.10. Середня кінетична енергія молекул. Внутрішня енергія ідеального газу
- •§ 2.11. Теплоємність газів. Недоліки класичної теорії теплоємностей
- •§ 2.12. Адіабатичний процес. Рівняння Пуасона
- •§ 2.13. Оборотні та необоротні процеси. Цикли
- •§ 2.14. Цикл Карно. Максимальний ккд теплової машини
- •§ 2.15. Друге начало термодинаміки. Нерівність Клаузіуса
- •§ 2.16. Ентропія. Закон зростання ентропії
- •§ 2.17. Статистичний зміст другого начала термодинаміки
- •§ 2.18. Ефективний діаметр молекули. Середнє число зіткнень і середня довжина вільного пробігу
- •§ 2.19. Явища перенесення
- •§ 2.20. Молекулярно-кінетична теорія явищ перенесення
- •§ 2.21. Реальні гази. Рівняння Ван-дер-Ваальса
- •§ 2.22. Ізотерми Ван-дер-Ваальса. Метастабільні стани. Критична точка
- •§ 2.23. Характер теплового руху в рідинах. Поверхневий натяг. Явище змочування. Капілярні явища
- •§ 2.24. Характер теплового руху у твердих тілах. Теплоємність і теплове розширення твердих тіл
- •§ 2.25. Фази і фазові перетворення. Умови рівноваги фаз. Потрійна точка
- •§ 2.26. Рівняння Клапейрона-Клаузіуса
- •§ 2.27. Фазові діаграми
- •§ 3.1.Електричний заряд. Електричне поле. Закон Кулона. Напруженість та індукція електричного поля. Принцип суперпозиції електричних полів
- •§ 3.2. Потік вектора напруженості та індукції електричного поля. Теорема Остроградського-Гауса
- •§ 3.3. Розрахунок електричних полів за допомогою теореми Остроградського-Гауса
- •§ 3.4. Робота сил електричного поля. Теорема про циркуляцію вектора напруженості електричного поля. Потенціал
- •§ 3.5. Розрахунок потенціалу електричного поля деяких заряджених тіл
- •§ 3.6. Провідники в електричному полі. Електроємність відокремленого провідника
- •§ 3.7. Конденсатори. Електроємність конденсатора. З’єднання конденсаторів
- •§ 3.8. Енергія зарядженого тіла і конденсатора. Енергія і густина енергії електричного поля
- •§ 3.9. Діелектрики в електричному полі. Поляризація діелектриків
- •§ 3.10. Електричний струм. Закон Ома для ділянки кола. Закон Ома в диференціальній формі
- •§ 3.11. Електрорушійна сила джерела струму. Закон Ома для неоднорідної ділянки кола і для повного кола
- •§ 3.12. Розгалужені електричні кола. Закони Кірхгофа. З’єднання провідників
- •§ 3.13. Робота і потужність струму. Закон Джоуля-Ленца
- •§ 3.14. Електричний струм в металах. Термоелектронна емісія. Контактні явища
- •§ 3.15. Електричний струм в електролітах
- •§ 3.16. Електричний стум в газах. Плазма
- •§ 3.17. Електричний струм у вакуумі
§ 2.20. Молекулярно-кінетична теорія явищ перенесення
Спробуємо одержати рівняння дифузії (закон Фіка), виходячи з молекулярно-кінетичних уявлень. Відразу зазначимо, що запропонований нижче розрахунок досить грубий, приблизний і стосується лише газів, в той час як установлений Фіком закон справедливий і для рідин, і для твердих тіл.
Н
Рис.2.17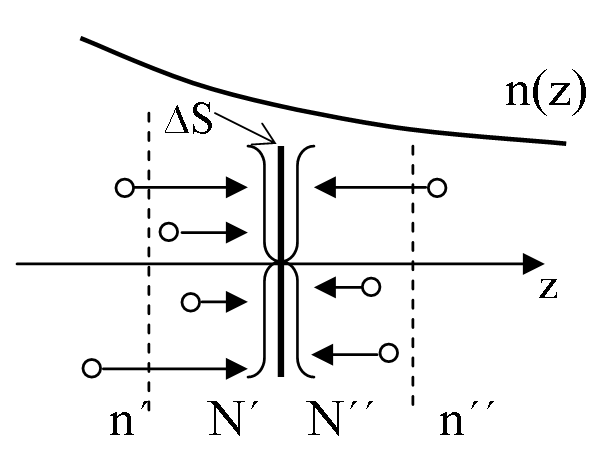
![]() через площадку
через площадку
![]() в напрямку осі z, через
в напрямку осі z, через
![]() ;
те ж число для протилежного напрямку –
через
;
те ж число для протилежного напрямку –
через
![]() (див. рис.2.17). За рахунок різниці цих
чисел
(див. рис.2.17). За рахунок різниці цих
чисел
![]() створюється потік молекул через поверхню
площею
створюється потік молекул через поверхню
площею
![]() .
.
Будемо
виходити зі спрощеної моделі, згідно з
якою молекули газу рухаються у трьох
взаємно перпендикулярних напрямках
так, що в напрямку осі z через нашу
площадку за проміжок часу
![]() пролітають молекули, число яких
пролітають молекули, число яких
![]() ,
а у протилежному напрямку –
,
а у протилежному напрямку –
![]() (див. подібну ситуацію в § 2.3). Тут
(див. подібну ситуацію в § 2.3). Тут
![]() – деяка “ефективна” концентрація
молекул зліва від площадки,
– деяка “ефективна” концентрація
молекул зліва від площадки,
![]() – справа від неї;
– справа від неї;
![]() – середня швидкість хаотичного теплового
руху молекул газу (газ вважаємо однорідним
і всім молекулам приписуємо швидкість
– середня швидкість хаотичного теплового
руху молекул газу (газ вважаємо однорідним
і всім молекулам приписуємо швидкість
![]() ).
В якості
).
В якості
![]() візьмемо
значення функції n(z)
у площині, що на відстані середньої
довжини вільного пробігу
візьмемо
значення функції n(z)
у площині, що на відстані середньої
довжини вільного пробігу
![]() від нашої площадки зліва (
від нашої площадки зліва (![]() ,
а в якості
,
а в якості
![]() –
у площині, що на відстані
–
у площині, що на відстані
![]() справа (
справа (![]() .
Тоді маємо
.
Тоді маємо
![]() .
.
Параметр
![]() є дуже малою величиною (див. оцінку її
в § 2.18), тому скористаємося означенням
похідної
є дуже малою величиною (див. оцінку її
в § 2.18), тому скористаємося означенням
похідної
![]()
і подамо вираз для числа молекул N у вигляді
![]() .
(2.62)
.
(2.62)
Остання
рівність правильна, якщо зміна функції
n(z) на довжині вільного пробігу набагато
менша від самої n(z),
тобто
![]() .
Виконання такої умови ”вимагає”
використане нами означення похідної.
.
Виконання такої умови ”вимагає”
використане нами означення похідної.
Порівняємо тепер співвідношення (2.62) і (2.61). Бачимо, що: 1) ми одержали закон Фіка; 2) попутно маємо явний вигляд коефіцієнта дифузії
![]() .
.
В межах молекулярно-кінетичних уявлень про газ можна також одержати оцінки в’язкості і теплопровідності:
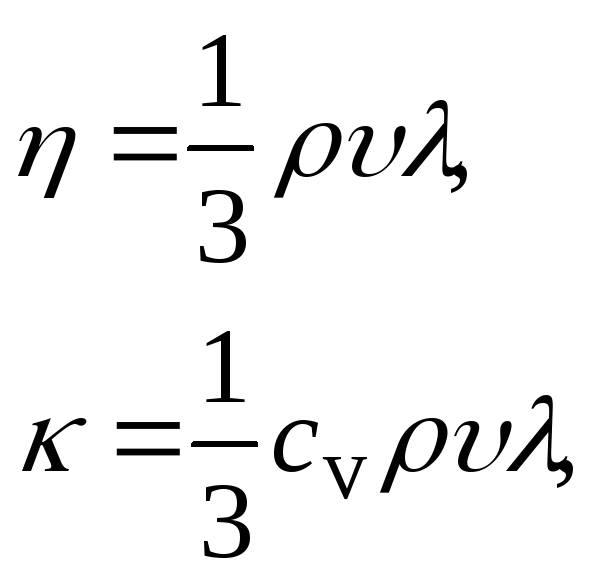
![]() – питома
теплоємність газу при постійному об’ємі,
– питома
теплоємність газу при постійному об’ємі,
![]() – густина.
– густина.
Коефіцієнти
D,
![]() і
і
![]() є характеристиками речовини. Одночасно
вони залежать від температури і тиску.
Результати аналізу цієї залежності для
газів подані графічно (рис.2.18).
є характеристиками речовини. Одночасно
вони залежать від температури і тиску.
Результати аналізу цієї залежності для
газів подані графічно (рис.2.18).
Т
Рис.2.18
![]() (ясно, що в кожного коефіцієнта своя
крива). Залежність від тиску різна в
області вакууму і поза нею.
(ясно, що в кожного коефіцієнта своя
крива). Залежність від тиску різна в
області вакууму і поза нею.
§ 2.21. Реальні гази. Рівняння Ван-дер-Ваальса
При розгляді механізмів теплообміну, явищ перенесення ми зустрічалися з необхідністю відмовитися від моделі молекул-точок, які не можуть при зіткненнях обмінюватися імпульсами і енергіями. Згадувалися кращі моделі молекул – твердих, а потім пружних кульок. Остання модель ідеального газу найкраща. При цьому треба пам’ятати, що такі кульки не взаємодіють на відстані; вони відштовхуються за законами пружного удару лише при безпосередніх зіткненнях.
Р еальні
молекули складаються з атомів, останні,
у свою чергу, – з ядер та електронних
оболонок. Лінійні розміри ядер порядку
еальні
молекули складаються з атомів, останні,
у свою чергу, – з ядер та електронних
оболонок. Лінійні розміри ядер порядку
![]() .
Атоми і молекули в цілому електронейтральні,
бо негативний заряд електронної оболонки
в атомі компенсується позитивним зарядом
ядра. Однак заряди (їх носії) в атомі
можуть бути розташовані несиметрично
або асиметрія може виникати при взаємному
зближенні молекул; вони при цьому
поляризуються (
.
Атоми і молекули в цілому електронейтральні,
бо негативний заряд електронної оболонки
в атомі компенсується позитивним зарядом
ядра. Однак заряди (їх носії) в атомі
можуть бути розташовані несиметрично
або асиметрія може виникати при взаємному
зближенні молекул; вони при цьому
поляризуються (![]() ),
внаслідок чого притягаються. Сили
притягання зростають із зменшенням
відстані. На дуже близьких відстанях,
коли електронні оболонки атомів
стикаються (перекриваються), значно
сильніше проявляються сили взаємного
відштовхування цих оболонок. В цілому,
залежність рівнодійної F сил міжмолекулярної
взаємодії, що мають електричну природу,
від відстані між молекулами можна
зобразити графічно так, як на рис.2.19а.
F>0
відповідає відштовхуванню, F<0
– притяганню молекул,
),
внаслідок чого притягаються. Сили
притягання зростають із зменшенням
відстані. На дуже близьких відстанях,
коли електронні оболонки атомів
стикаються (перекриваються), значно
сильніше проявляються сили взаємного
відштовхування цих оболонок. В цілому,
залежність рівнодійної F сил міжмолекулярної
взаємодії, що мають електричну природу,
від відстані між молекулами можна
зобразити графічно так, як на рис.2.19а.
F>0
відповідає відштовхуванню, F<0
– притяганню молекул,
![]() – положенню рівноваги системи (рівності
сил відштовхування і притягання).
– положенню рівноваги системи (рівності
сил відштовхування і притягання).
Теорія
і дослід показують, що сили міжмолекулярного
притягання (![]() )
та відштовхування (
)
та відштовхування (![]() )
дуже швидко зменшуються із зростанням
відстані, але
)
дуже швидко зменшуються із зростанням
відстані, але
![]() значно швидше:
значно швидше:
![]() ,
,
![]() .
На відстанях, більших від
.
На відстанях, більших від
![]() ,
дія сил міжмолекулярної взаємодії
практично не проявляється. Тому цю
відстань називають радіусом сфери
міжмолекулярної взаємодії.
,
дія сил міжмолекулярної взаємодії
практично не проявляється. Тому цю
відстань називають радіусом сфери
міжмолекулярної взаємодії.
Внутрішня
енергія реального газу крім енергії
хаотичного теплового руху містить ще
й потенціальну енергію взаємодії молекул
(![]() ).
Залежність останньої від відстані між
молекулами схематично зображена на
рис.2.19б. Положенню рівноваги сил
відштовхування і притягання (
).
Залежність останньої від відстані між
молекулами схематично зображена на
рис.2.19б. Положенню рівноваги сил
відштовхування і притягання (![]() )
відповідає мінімум потенціальної
енергії взаємодії.
)
відповідає мінімум потенціальної
енергії взаємодії.
В
реальних газах при звичайних умовах
середні відстані між молекулами мають
порядок
![]() ,
тому рівняння стану ідеального газу
добре описує і реальний газ. Однак із
збільшенням тиску відстані між молекулами
зменшуються і починає проявлятися
взаємодія. Результати розрахунків на
основі рівняння Менделєєва-Клапейрона
уже не відповідають експериментальним
даним.
,
тому рівняння стану ідеального газу
добре описує і реальний газ. Однак із
збільшенням тиску відстані між молекулами
зменшуються і починає проявлятися
взаємодія. Результати розрахунків на
основі рівняння Менделєєва-Клапейрона
уже не відповідають експериментальним
даним.
Ван-дер-Ваальс вніс до рівняння стану ідеальних газів поправки, які враховують сили притягання та розміри молекул. Одержане ним рівняння для одного моля газу має вигляд
![]() (2.63)
(2.63)
або
![]() .
(2.64)
.
(2.64)
Величини
а
та b
– сталі Ван-дер-Ваальса. Ці величини
різні для різних газів і, взагалі кажучи,
залежать від температури (але слабо,
так що в цьому відношенні їх можна
вважати сталими). Поправка
![]() до тиску зумовлена силами міжмолекулярного
притягання, які створюють додатковий
внутрішній тиск. Поправка b
враховує те, що молекули скінченного
розміру не можуть наблизитися одна до
другої на відстань, рівну нулю, навіть
при безмежно великому тиску. Фактично
вона враховує наявність сил відштовхування.
Обидві сталі визначають експериментальним
шляхом. Теорія не дає строгого виводу
формул для них. Якщо вважати молекули
твердими кульками з діаметром d,
то оцінка величини b
дає почетверений об’єм молекул у молі
газу:
до тиску зумовлена силами міжмолекулярного
притягання, які створюють додатковий
внутрішній тиск. Поправка b
враховує те, що молекули скінченного
розміру не можуть наблизитися одна до
другої на відстань, рівну нулю, навіть
при безмежно великому тиску. Фактично
вона враховує наявність сил відштовхування.
Обидві сталі визначають експериментальним
шляхом. Теорія не дає строгого виводу
формул для них. Якщо вважати молекули
твердими кульками з діаметром d,
то оцінка величини b
дає почетверений об’єм молекул у молі
газу:
![]() ,
де
,
де
![]() – об’єм однієї молекули, так що добуток
– об’єм однієї молекули, так що добуток
![]() рівний власному об’єму одного моля
молекул.
рівний власному об’єму одного моля
молекул.
З
рівняння (2.63) видно, що
![]() та
та
![]() .
Значення сталих а
та b
або безпосередньо пов’язаних з ними
величин подаються в довідниках.
.
Значення сталих а
та b
або безпосередньо пов’язаних з ними
величин подаються в довідниках.
Рівняння
Ван-дер-Ваальса для довільної маси газу
одержують із (2.63), помноживши праву і
ліву частини цього співвідношення на
кількість речовини і врахувавши, що
![]()
![]() .
(2.65)
.
(2.65)
Зазначимо, що рівняння Ван-дер-Ваальса краще описує реальні гази, ніж рівняння Менделєєва-Клапейрона, але воно все одно наближене, і при надвисоких тисках теж не годиться. Система, що добре описується рівнянням (2.65), називається вандерваальсівським газом.
