
- •З біологічної хімії
- •Рецензент проф. В.Д. Бовт
- •Питання до іспиту……………………………………………………………… 79
- •Тематичне розподілення навчального матеріалу а. Тематичне розподілення лекційного матеріалу
- •В. Тематичний план лабораторних і семінарських занять
- •Техніка безпеки при роботі у біохімічній лабораторії
- •Забороняється з метою уникнення травм, опіків, нещасних випадків:
- •Перша домедична допомога
- •Вимоги до оформлення лабораторного журналу і робочого місця
- •Теоретична частина:
- •Практична частина:
- •Теоретична частина:
- •Практична частина:
- •Контрольні питання
- •Теоретична частина:
- •Практична частина:
- •Питання до семінарського заняття:
- •Теоретична частина:
- •Практична частина:
- •Контрольні питання
- •Теоретична частина:
- •Практична частина:
- •Контрольні питання
- •Теоретична частина:
- •Цитозін
- •Практична частина:
- •Контрольні питання
- •Теоретична частина:
- •Властивості ферментів:
- •Реакція
- •Практична частина:
- •Теоретична частина:
- •Практична частина:
- •Контрольні питання
- •Питання до семінарського заняття:
- •Теоретична частина:
- •Тканьовий подих
- •Практична частина:
- •Контрольні питання
- •Питання до семінарського заняття:
- •Теоретична частина:
- •Катаболізм амінокислот:
- •Біосинтез сечовини (орнітиновий цикл)
- •Практична частина:
- •Теоретична частина:
- •Практична частина:
- •Питання до семінарського заняття:
- •Теоретична частина:
- •Взаємний зв'язок різних форм обміну речовин в організмі
- •Практична частина
- •Контрольні питання
- •Питання до семінарського заняття:
- •Питання до іспиту
- •Список рекомендованої літератури
- •Практикум з біологічної хімії до лабораторних і семінарських занять для студентів біологічного факультету денної та заочної форм навчання
Теоретична частина:
Величезна розмаїтість білків у природі визначається не тільки кількістю та якістю амінокислот, які входять до їх складу, але й послідовністю розташування амінокислотних залишків у поліпептидному ланцюзі. Одна з важливих властивостей амінокислот — це їх здатність вступати у реакцію поліконденсації з виділенням молекули води та утворенням ковалентного пептидного зв’язку, в якому беруть участь тільки функціональні групи сусідніх амінокислот. Наприклад:
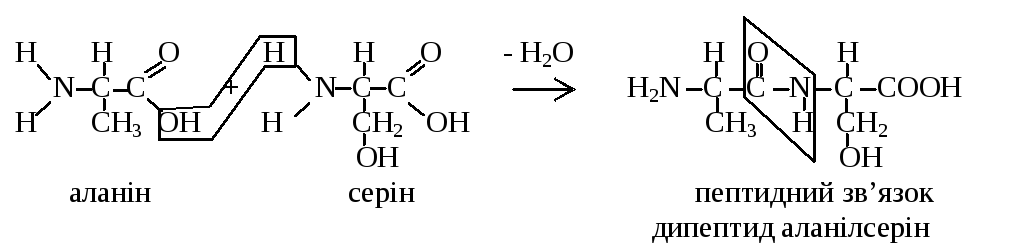 До
дипептиду аналогічним чином можуть
приєднуватися інші амінокислоти з
утворенням три-, тетра-, пента- і т.д. аж
до поліпептиду—білка. Найменування
пептидів складається з першої -N-кінцевої
амінокислоти з закінченням «-іл»,
наступних амінокислот з таким же
закінченням і повної назви С-кінцевої
амінокислоти із вільною -СООН-групою.
До
дипептиду аналогічним чином можуть
приєднуватися інші амінокислоти з
утворенням три-, тетра-, пента- і т.д. аж
до поліпептиду—білка. Найменування
пептидів складається з першої -N-кінцевої
амінокислоти з закінченням «-іл»,
наступних амінокислот з таким же
закінченням і повної назви С-кінцевої
амінокислоти із вільною -СООН-групою.
Амінокислотна послідовність визначає первинну структуру молекули білка. Завдяки успіхам у розробці й удосконаленні методичних прийомів вивчення структури білків, повністю розшифрована первинна структура багатьох білків (інсуліну, рибонуклеази, білка вірусу тютюнової мозаїки, гемоглобіну, міоглобіну, трипсину, хімотрипсину, пепсину, лізоциму і багатьох інших).
Вторинна структура білків визначається впорядкованим розташуванням гнучких поліпептидних ланцюгів, які виникають у результаті утворення водневих зв'язків між атомами кисню карбонільних груп і атомами водню амідних груп поліпептидних зв'язків (>С=О•••НN<). Конформації полі пептидів, які при цьому виникають, ділять на два класи: -спіральні структури (обумовлені утворенням внутрішньомолекулярних водневих зв'язків між киснем карбонільної групи кожного пептидного зв'язку й атомом водню амідної групи четвертого за рахунком амінокислотного залишку) і -структури типу складчастого шару (обумовлені утворенням міжмолекулярних водневих зв'язків). Останні бувають двох типів: пептидні ланцюги розташовані паралельно один одному (паралельні -структури) і ланцюги спрямовані в протилежні сторони (антипаралельні -структури). Тип вторинної структури білка залежить від його амінокислотного складу й послідовності розташування амінокислот. Установлено, що деякі амінокислоти, наприклад глютамінова кислота, аланін, лейцин, сприяють утворенню α-спіралей. Інші амінокислоти, зокрема метіонін, валін і ізолейцин, частіше зустрічаються в складі -структури, тоді як гліцин, пролін і аспарагін звичайно розташовані в місцях вигину поліпептидного ланцюга. Для багатьох білків характерне чергування α-спіралей і -структур по ходу поліпептидного ланцюга.
Конфігурація поліпептидного ланцюга в просторі визначає третинну структуру білка. Формування третинної структури відбувається в результаті взаємодії R-груп амінокислот, що далеко розташовані один від другого уздовж поліпептидного ланцюга.
Які зв'язки беруть участь в утворенні третинної структури?
Найбільш важливими з них є водневі, дисульфідні, електростатичні, які виникають між позитивно і негативно зарядженими R-групами, і гідрофобні, що утворюються в тих ділянках молекули білка, де взаємодіють неполярні R-групи деяких амінокислот. Іони металів можуть стабілізувати третинну структуру білка, утворюючи зв'язки між різними ділянками поліпептидного ланцюга.
Р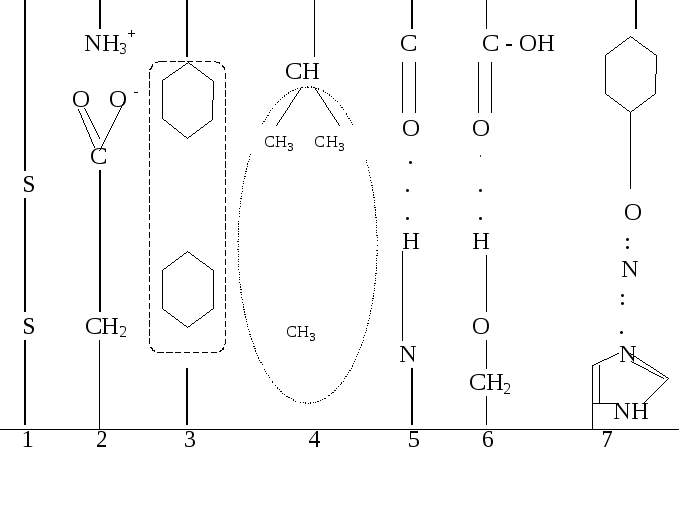 ис.1.
Внутрішньомолекулярні зв'язки,
відповідальні за підтримку вторинної
і третинної структур білків:
ис.1.
Внутрішньомолекулярні зв'язки,
відповідальні за підтримку вторинної
і третинної структур білків:
1 - дисульфідні зв'язки (ковалентні) між двома залишками цистеїну;
2 - електростатичні зв'язки між основними амінокислотами (аргініном, лізином, гістидином) і кислими амінокислотами (глютамінової і аспарагінової);
3 - гідрофобні взаємодії за участю фенілаланіну;
4 - гідрофобні взаємодії за участю лейцину, ізолейцину, валіну і аланіну;
5 - водневі зв'язки між групами (атомами) пептидних зв'язків;
6 - водневі зв'язки між кислими амінокислотами (глютамінової,
аспарагінової) й оксиамінокислотами (серином, треоніном);
7 - водневі зв'язки між тирозином і гістидином
Глобулярні білки зберігають свою унікальну третинну структуру переважно завдяки взаємодії між гідрофобними амінокислотними залишками. За допомогою рентгеноструктурного аналізу вдалося встановити, що для глобулярних білків характерні сильно звиті, компактно впаковані структури, усередині яких перебувають гідрофобні амінокислотні залишки, які формують гідрофобне ядро, у той час як на поверхні білкової глобули розташовані майже всі групи амінокислот і дуже незначне число гідрофобних ділянок. Студентові варто знати уяву, яка розвивається в даний час, про доменні принципи будови білка.
Домен - відособлена область молекули білка, яка володіє деякою мірою структурною і функціональною автономією. У ряді ферментів, наприклад, відособлені коферментпов’язуючі домени. Із вченням про доменний принцип будови білків пов'язаний розвиток уяви про елементи однотипності, блочності, стандартності третинної структури білків, про обмеженість набору просторових упакувань поліпептидних ланцюгів, які реально існують у природних білках.
Домени вважають фундаментальними елементами структури білкових молекул, і, як думають, співвідношення і характер компонування а-спіралей і -шарів дає для розуміння еволюції білкових молекул і філогенетичних зв'язків більше, ніж зіставлення первинних структур.
Четвертинну структуру мають білки, які складаються з декількох поліпептидних ланцюгів, кожний з яких має свою певну тривимірну структуру (конформацію). Таким чином, це спосіб упакування поліпептидних ланцюгів відносно один одного. Кожний поліпептидний ланцюг у таких білках має назву субодиниця. Так, наприклад, гемоглобін складається з 4-х субодиниць двох видів поліпептидних ланцюгів: α-ланцюгів і β-ланцюгів. Формула гемоглобіну 22. Кожний тип поліпептидного ланцюга кодується окремим геном (синтез - і -ланцюгів гемоглобіну кодується двома різними генами).
Біологічна активність білка, наприклад ферментативна або гормональна, визначається його конформацією.
Молекула простого білка може з'єднуватися з іншими речовинами іноді дуже великої молекулярної ваги, утворюючи ще більш складні сполуки, так звані складні білки.
Оскільки детальна будова молекул білків дотепер ще остаточно не з'ясована, сучасна класифікація білків заснована не на їх хімічній будові, а на фізико-хімічних властивостях білків. Відповідно до прийнятої класифікації, усі білки діляться на прості (протеїни) і складні (протеїди). Існує класифікація білків, яка заснована на їх біологічній функції.
Прості білки складаються тільки з α-амінокислот, а складні мають ще неамінокислотні компоненти: гем, похідні вітамінів, ліпідні, вуглеводні чи фосфатні компоненти.
До простих відносяться альбуміни, глобуліни, проламіни, гістони
У складних білків два компоненти – простий білок та небілкова речовина – сполучені між собою ковалентними або слабкими (іонними, водневими, вандерваальсовими та ін.) зв’язками. Небілкова частина складних білків називається простетичною групою. До складних білків відносяться нуклеопротеїди, хромопротеїди, фосфопротеїди, глікопротеїди, металопротеїди та ін.
Дякуючи наявності в білках амінних і карбоксильних груп, вони в кислому середовищі дисоціюють як основи, а в лужному — як кислоти, отже є амфотерними електролітами, що обумовлює їх значення як буферних систем, які підтримують постійність реакції середовища в тканинах організму. Якщо реакція середовища пригнічує дисоціацію білка, електричний заряд становиться найменшим (теоретично дорівнює нулю), білок знаходиться в ізоелектричному стані. Значення рН середовища, при якому білок знаходиться в ізоелектричному стані, називається ізоелектричною крапкою.
Білки кислого характеру (альбуміни, глобуліни) у водному розчині несуть негативний заряд; білки основного характеру (протаміни, гістони) — позитивний заряд. Наявність заряду на макромолекулі білка стабілізує його в розчині, тому як заважає злипанню білкових часток та випаданню їх в осад.
У водному розчині більшість білків та їх часток (міцел) заряджені та гідратовані. При додаванні у великих концентраціях солей лужних та лужноземельних металів (сульфату натрію, сульфату магнію, хлориду натрію та ін.), а також нейтральних солей, наприклад, сульфату амонію, молекули яких у водних розчинах гідратовані, виникає руйнування оболонок (дегідратація білка). В результаті цього знижується електричний заряд білкової молекули в наслідок адсорбування на ній іонів солей. Частки білку злипаються одна з одною, збільшуються в розмірі і випадають в осад. Таке осадження білку в розчинах отримало назву «висалювання» або зворотне осадження. При висалюванні білок за звичаєм не втрачає притаманні йому фізико-хімічні та біологічні властивості. Він знову розчиняється у воді і проявляє майже з тою же активністю ферментативні, антигенні, імунні та інші біологічні властивості, тобто залишається нативним (натуральним).
Білки під впливом фізичних (температура, ультразвук, іонізуюча радіація та інше), хімічних (мінеральні та органічні кислоти, луги, органічні розчинники, важкі метали, алкалоїдні реактиви та інше) і біологічних (наприклад, при дії протеолітичних ферментів) факторів отримують глибокі зміни, які пов’язані з порушенням четвертинної, третинної та навіть вторинної структури, що призводить до змін фізико-хімічних і біологічних властивостей білка, а саме до денатурації. При денатурації білка відзначається розрив вторинних зв’язків (водневих, дисульфідних, електростатичних, ефірних, вандерваальсових та ін.). Це призводить до зміни просторової структури та зменшенню її гідрофільних властивостей. Білок стає більш гідрофобним, втрачає здатність розчинятися в звичайних для нього розчинниках і свої біологічні функції (ферментів, гормонів і ін.). Такий вид денатурації вважається незворотнім.
