
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Які фізичні властивості характерні для заліза?
-
Які хімічні властивості заліза?
-
Які хімічні властивості характерні для сполук Феруму +2 і +3?
-
Назвіть природні сполуки феруму.
-
Якісні реакції на Fe2+ і Fe3+.
-
До 140 г розчину з масовою часткою купрум(ІІ) сульфату 16% додали 5,6 г порошкоподібного заліза. Обчисліть маси солей у розчині після закінчення реакції.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 172-173.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 14, §§ 119-121, с. 125-127.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль: «Богдан», 1998. – с. 21.
Тема 2.8. Сульфур. Сірка.
План
-
Загальна характеристика елементів VI-А групи.
-
Сульфур.
-
Алотропні модифікації Cульфуру.*
-
Фізичні властивості сірки.
-
Хімічні властивості.**
-
Застосування.
1. Усі елементи VI-A групи мають однакову будову зовнішнього енергетичного рівня, яка наближається до будови наступних у періоді інертних елементів ns2np4. Тому всі вони, за винятком Ро, виявляють виражені неметалічні властивості. Це р-елементи з двома неспареними електронами на зовнішньому р-підрівні. Усі вони (крім Оксигену) мають на зовнішньому шарі вільні d-орбіталі, які під час збудження атома можуть займати неспарені електрони зовнішніх s- і p-орбіталей. Їх найнижчий ступінь окиснення -2, а найвищий (крім Оксигену і Полонію) +6.
Оксиди та гідрати оксидів цих елементів (за винятком Оксигену та Полонію) мають кислотні властивості. Сполуки цих елементів (крім Оксигену) з типовими металами (лужними та лужноземельними) є солями. У межах групи неметалічні властивості послаблюються, а металічні посилюються (Ро – метал) відповідно до зменшення електронегативності (зверху вниз).
2. Електронна будова атома: 1s22s22p63s23p4
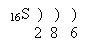
|
Ізотопи: 32S (95%), 33S, 34S, 36S
У природі Сульфур зустрічається у вигляді самородної сірки, піриту, сульфідів, сульфатів.
 3.
Сульфур утворює дві алотропні
модифікації – ромбічну
і
моноклінну
сірку.
Обидві складаються
з молекул S8.
Кристалічні форми сірки: а – ромбічна;
б – моноклінна.
3.
Сульфур утворює дві алотропні
модифікації – ромбічну
і
моноклінну
сірку.
Обидві складаються
з молекул S8.
Кристалічні форми сірки: а – ромбічна;
б – моноклінна.
|
||||||||||||||
С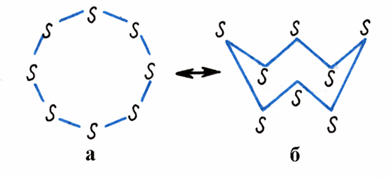 ульфур
дає не тільки кристалічні модифікації
– ромбічну й моноклінну сірку, а й
аморфну – пластичну
сірку. Кожна має
свою будову кристалічних граток.
ульфур
дає не тільки кристалічні модифікації
– ромбічну й моноклінну сірку, а й
аморфну – пластичну
сірку. Кожна має
свою будову кристалічних граток.
Будова сірки:
а – ромбічна;
б – моноклінна.
4. Сірка – тверда речовина жовтого кольору, не має металічного блиску, не проводить електричний струм, нерозчинна у воді, але розчиняється у сірковуглеці СS2 та інших органічних розчинниках. За стандартних умов стійкішою є ромбічна модифікація.
5. За високих температур сірка взаємодіє з усіма речовинами, за винятком азоту, золота і платини, виявляючи, залежно від умов властивості окисника чи відновника:
А) взаємодіє з металами з утворенням сульфідів:

Б) взаємодіє з неметалами (за винятком азоту, йоду та інертних газів):
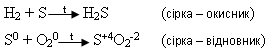
В) взаємодіє з окисниками і відновниками:

6. Застосування:
1) виробництво сульфатної кислоти та сульфатів;
2) добування барвників, гуми, чорного пороху, сірників, ліків;
3) сільському господарстві для боротьби зі шкідниками.
