
- •Основные понятия и законы химии Материя и движение
- •Закон сохранения массы и энергии
- •Атомно-молекулярное учение
- •Масса атомов и молекул
- •Количество вещества. Моль.
- •Стехиометрические законы химии
- •Закон Авогадро
- •Химические системы
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Строение вещества Строение атома
- •Состояние электрона в атоме
- •Строение многоэлектронных атомов
- •Периодическая система элементов и электронная структура атомов
- •Периодичность свойств атомов
- •Физические состояния веществ
- •Газовое состояние вещества
- •Плазменное состояние вещества
- •Жидкое состояние вещества
- •Твердые вещества
- •Типы кристаллов и свойства веществ
- •Понятие о зонной теории кристаллов
Типы кристаллов и свойства веществ
Молекулярные кристаллы. В узлах решеток - молекулы, между которыми действуют слабые ван-дер-ваальсовы силы, невысокая энергия решетки. Вещества с молекулярной решеткой (их много) имеют небольшую твердость, низкие Т плавления, диэлектрики. Например, в обычных условиях: йод I2, белый фосфор P4, сера S8, многие органические соединения; при низких температурах или высоких давлениях: вода, углекислый газ CO2, кислород O2, азот N2, водород H2, галогены, инертные газы.
Атомные кристаллы. В узлах - атомы, связанные прочными ковалентными связями, высокая энергия решетки, координационные числа невысокие (обычно 4). Вещества (их мало) - очень твердые, с высокими Т плавления, практически не растворимы, от диэлектриков до полупроводников, например: углерод (алмаз, графит) С, германий Ge, бор B, кремний Si, оксид кремния (кварц) SiO2, карбид кремния SiC.
Ионные кристаллы. В узлах - положительно и отрицательно заряженные ионы, связанные электростатическим взаимодействием, достаточно высокая энергия решетки, высокие координационные числа (6, 8). Вещества твердые и хрупкие с высокими Т плавления, диэлектрики, например, многие соли: хлорид натрия NaCl, хлорид калия KCl, фторид кальция CaF2, карбонат натрия Na2CO3.
Металлические кристаллы. В узлах - положительно заряженные ионы металлов, связанные свободно перемещающимися по всему кристаллу электронами ("электронным газом"). Энергия решетки имеет промежуточное значение между энергиями атомных и молекулярных кристаллов, координационные числа большие (8-12). Металлы имеют различную твердость, различные Т плавления. Наличием нелокализованных электронов объясняются их характерные свойства: высокие электро- и теплопроводность, ковкость, пластичность, металлический блеск.
Понятие о зонной теории кристаллов
Химическую связь и свойства кристаллов можно объяснить, пользуясь методом молекулярных орбиталей.

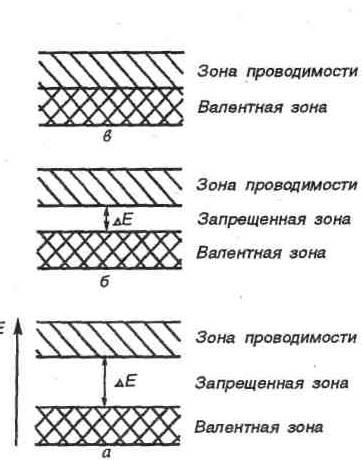
 При
образовании кристаллов (которые можно
рассматривать как гигантские молекулы)
в химические связи вступает огромное
число частиц, при этом образуется
огромное число молекулярных орбиталей
(МО), охватывающих весь кристалл. Так
как разность между энергетическими
уровнями МО мала, образуются энергетические
зоны, состоящие из большого числа
подуровней. Зона, полностью заполненная
электронами, называется валентной зоной
(ВЗ). Зона, свободная от электронов, -
зоной проводимости (ЗП). ВЗ и ЗП могут
либо перекрываться, либо не перекрываться,
и тогда между ними возникает запрещенная
зона шириной ΔЕ. Эта ширина определяет
тип кристалла: проводника (металла),
полупроводника или диэлектрика (рис.
4)
При
образовании кристаллов (которые можно
рассматривать как гигантские молекулы)
в химические связи вступает огромное
число частиц, при этом образуется
огромное число молекулярных орбиталей
(МО), охватывающих весь кристалл. Так
как разность между энергетическими
уровнями МО мала, образуются энергетические
зоны, состоящие из большого числа
подуровней. Зона, полностью заполненная
электронами, называется валентной зоной
(ВЗ). Зона, свободная от электронов, -
зоной проводимости (ЗП). ВЗ и ЗП могут
либо перекрываться, либо не перекрываться,
и тогда между ними возникает запрещенная
зона шириной ΔЕ. Эта ширина определяет
тип кристалла: проводника (металла),
полупроводника или диэлектрика (рис.
4)
ΔЕ < 4 эВ ΔЕ > 4 эВ
1) проводники (металлы) 2) полупроводники 3) диэлектрики
Рис.4. Энергетические зоны кристаллов
1) У металлов ВЗ и ЗП перекрываются. В ЗП имеется большое число незанятых МО (т.к. электронов меньше, чем МО), энергии МО мало отличаются, электроны легко переходят с одной МО на другую, что и обеспечивает электро- и теплопроводность. Т.о., металлы обладают электронной проводимостью, обусловленной движением электронов.
С повышением температуры проводимость металлов уменьшается (сопротивление растет). При низких температурах, близких к абсолютному нулю (ниже 25 К), многие металлы и сплавы полностью теряют сопротивление - становятся сверхпроводниками. Традиционные сверхпроводники - сплавы Nb3Ge, Nb3AlGe, их критическая температура ТК ≈ 23 К (выше которой они теряют сверхпроводимость). В 1986 г. была открыта высокотемпературная сверхпроводимость: сложные оксидные соединения некоторых металлов имеют ТК около 100 К (Tl2Ba2Ca2Cu3O10 - 125 K, Ba2Ca2Cu3O10 - 135 K).
2) При ширине запрещенной зоны кристалла меньше 4 эВ вещества проявляют свойства полупроводников, например: кремний Si, германий Ge, селен Se, сульфид свинца PbS, сульфид кадмия CdS. При поглощении энергии электроны ВЗ возбуждаются и переходят в ЗП, появляется проводимость. У полупроводников, в отличие от металлов, с увеличением температуры проводимость увеличивается (сопротивление уменьшается).
Например, в кристалле кремния каждый атом связан с четырьмя соседними атомами ковалентными связями, образованными парами электронов. Валентные электроны, хотя и принадлежат всему кристаллу, большую часть времени находятся в пространстве между соседними атомами. При низких температурах связи достаточно прочны, не разрываются, проводимости нет. При нагревании часть связей разрывается, электроны свободно перемещаются, появляется электронная проводимость. При разрыве связи образуется вакантное (свободное) место с недостающим электроном (т.е. с избыточным положительным зарядом) - дырка. В эту дырку может перейти другой электрон, а на его прежнем месте образуется другая дырка, т.е. дырка может как бы перемещаться по кристаллу. При наложении электрического поля возникает упорядоченное перемещение дырок - дырочная проводимость. Т.о., полупроводники могут обладать собственной электронной и дырочной проводимостью. Она обычно невелика.
При наличии примесей у них возникает дополнительная примесная проводимость. Примеси, легко отдающие электроны, т.е. увеличивающие число свободных электронов в кристалле, - донорные (например, примеси мышьяка As или сурьмы Sb к кремнию, в их атомах пять валентных электронов). Полупроводники с донорными примесями обладают в основном электронной проводимостью и называются полупроводниками n-типа (от negativ- отрицательный).
Акцепторные примеси, захватывающие электроны, способствуют образованию дырок (например, примесь индия In, в атоме которого три электрона, к кремнию). Полупроводники с акцепторными примесями обладают в основном дырочной проводимостью и называются полупроводниками p-типа (от positiv- положительный).
3) У диэлектриков ВЗ и ЗП разделены запрещенной зоной шириной более 4 эВ, при обычных условиях проводимости нет. Для перехода электронов из ВЗ в ЗП требуется значительная энергия, при подведении которой кристалл расплавится или разрушится.
Расплавы некоторых диэлектриков (например, ионных кристаллов хлорида натрия) проводят ток. В их расплавах при разрушении связей появляется возможность для движения заряженных частиц - ионов (ионная проводимость).
В реальных кристаллах обычно наблюдаются дефекты структуры (нарушения расположения частиц). Они могут быть тепловыми (возникать при увеличении температуры), примесными. Из-за наличия дефектов некоторые ионные кристаллы при обычных температурах имеют ионную проводимость (появляется возможность для движения ионов), они называются твердыми электролитами и применяются в топливных элементах (например, оксид циркония ZrO2 с примесями оксида иттрия Y2O3).
При сверхвысоком давлении полупроводники и диэлектрики могут превращаться в проводники (атомы сближаются, ВЗ и ЗП перекрываются).
