
- •Молекулярная физика и термодинамика: методы решения задач
- •Молекулярная физика и термодинамика: методы решения задач
- •Аннотация
- •Алгоритмический подход к решению задач по физике
- •V. Создание математической модели решения задачи.
- •VI. Вычисление искомой величины.
- •VII. Проверка и анализ полученного результата.
- •Алгоритмические предписания к решению задач Основы термодинамики
- •Основы молекулярно-кинетической теории
- •Задача. Пробковый кубик со стороной 2 см плавает на поверхности воды. Определить глубину его погружения в воду, считая смачивание полным.
- •Задачи для самостоятельного решения Основы термодинамики
- •Основные молекулярно-кинетической теории
- •Справочные материалы
- •Литература
Основы молекулярно-кинетической теории
Задачи рассматриваемой темы можно условно разделить на следующие основные группы:
-
задачи, в которых определяются и сравниваются размеры молекул и расстояния между ними;
-
задачи, в которых определяются массы молекул, молярные массы вещества, количество вещества;
-
задачи, в которых рассматриваются силы взаимодействия между молекулами.
Вычисление (точнее, оценку) линейных размеров обычно производят для молекул жидкостей. При этом, исходя из малой сжимаемости жидкостей, делают допущение, что молекулы, имеющие шарообразную форму, плотно упакованы и каждая молекула в жидкости занимает объем в виде куба, ребро которого равно линейному размеру молекулы. Пользуясь такой моделью, можно также определить соотношение объемов, занятых самими молекулами, и объемов, приходящихся на промежутки между ними. В эту группу включаются задачи по определению расстояния между частицами (постоянной решетки) в простейшей кубической структуре твердых тел. Здесь также решаются задачи, позволяющие по линейным размерам молекул определять некоторые физические постоянные (постоянная Лошмидта, объем моля газа при нормальных условиях, постоянная Авогадро).
Оценить линейные размеры молекул можно также в экспериментальных задачах, основанных на опытах с тонкими пленками, образующимися при растекании масла по поверхности воды.
При решении задач на нахождение масс молекул используют значение атомной единицы массы и относительную молярную массу вещества. Массу молекулы вычисляют по формуле т0 = 1,66·10–27Mr. Вычислить массу молекулы можно также по формуле т0 =M/NA.
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ЗАКОНЫ И ФОРМУЛЫ
Тепловое расширение тел (линейное расширение)
![]()
где α – температурный коэффициент линейного расширения, ΔT – изменение температуры.
Закон Дальтона
![]()
где p – давление смеси паров или газов.
Закон Бойля-Мариотта
![]() ,
,
при условии, что m = const и T = const;
где p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа.
Закон Гей-Люссака
![]() ,
,
при условии, что m = const и V = const;
где p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа.
Закон Шарля
![]() ,
,
при условии, что m = const и V = const;
где p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа.
Уравнение Клапейрона
![]()
при условии, что m = const и V = const;
где p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа.
Уравнение состояния идеального газа
(уравнение Клапейрона - Менделеева)
![]()
где p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа, M – молярная масса, R – универсальная газовая постоянная.
Удельная теплоемкость вещества
![]()
где c – удельная теплоемкость вещества, Q – количество теплоты, m – масса вещества, ΔT – изменение температуры.
Удельная теплота парообразования
![]()
где L – удельная теплота парообразования, Q – количество теплоты, необходимое для превращения в пар жидкости массой m, находящейся при температуре кипения.
Удельная теплота плавления
![]()
где λ – удельная теплота плавления, Q – количество теплоты, необходимое для плавления твердого тела массой m, находящейся при температуре плавления.
Уравнение теплового баланса
![]()
где ΣQотд – количество теплоты, отдаваемое более нагретыми телами при теплообмене, ΣQполуч – количество теплоты, получаемому более холодными.
Работа газа при изобарном процессе
![]()
где A – работа газа при изобарном процессе, p – давление идеального газа, V – объем идеального газа, T – абсолютная температура идеального газа, m – масса идеального газа, M – молярная масса, R – универсальная газовая постоянная.
Первое начало термодинамики
![]()
где Q – количество теплоты, полученной системой, ΔU – изменение внутренней энергии системы, A – работа, совершенная системой.
КПД тепловой машины
![]()
где η – КПД тепловой машины, A – полезная работа, совершенная рабочим телом, Q1 – количество теплоты, полученное рабочим телом от нагревателя, Q2 – количество теплоты, отданное рабочим телом холодильнику.
КПД идеальной тепловой машины
![]()
где ηmax – КПД идеальной тепловой машины, T1 – температура нагревателя, T2 – температура холодильника.
Удельная теплота сгорания топлива
![]()
где q – удельная теплота сгорания топлива, Q – количество теплоты, выделившейся при сгорании топлива, m – масса топлива.
Количество вещества
![]()
где ν – количество вещества, N – число молекул в веществе, NA – постоянная Авогадро.
Масса молекулы вещества
![]()
где m0 – масса молекулы вещества, m – масса вещества, N – число молекул в веществе, ν – количество вещества, NA – постоянная Авогадро, M – молярная масса вещества.
Средняя квадратичная скорость молекул
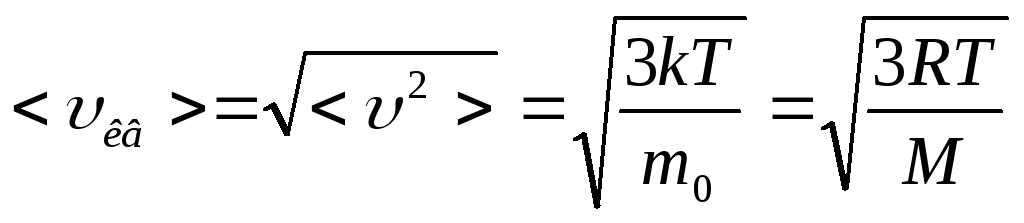 ,
,
![]()
где <υкв> – средняя квадратичная скорость, υ1, υ2, υ3, … υN – скорость молекул, N – число молекул, k – постоянная Больцмана, T – температура тела, m0 – масса молекулы, R – универсальная газовая постоянная, M – молярная масса.
Основное уравнение молекулярно-кинетической теории
![]()
где p – давление идеального газа, n – концентрация газа, m0 – масса молекулы, <υ2> – средняя квадратичная скорость, <Eк> – средняя кинетическая энергия поступательного движения молекул.
Связь между средней кинетической энергией поступательного движения молекул и температурой
![]()
где <Eк> – средняя кинетическая энергия поступательного движения молекул, k – постоянная Больцмана, T – температура тела.
Связь давления идеального газа и температуры
![]()
где p – давление идеального газа, n – концентрация, k – постоянная Больцмана, T – температура газа.
Относительная влажность воздуха
![]() ;
;
где φ – относительная влажность воздуха, p – давление водяного пара, p0 – давлению насыщенного водяного пара при данной температуре, ρ – плотность водяного пара, ρ0 – плотность насыщенного водяного пара при данной температуре.
Коэффициент поверхностного натяжения жидкости
![]() ;
;
где σ – коэффициент поверхностного натяжения, A – работа, необходимая для увеличения площади свободной поверхности жидкости на величину S, Fпов – сила поверхностного натяжения жидкости, действующей на границу раздела жидкости длиной l.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача. В баллоне вместимостью V = 3000 см3 находится воздух под давлением p0 = 100 кПа. Сколько ходов поршневого насоса с камерой вместимостью Vк = 200 см2, потребуется, чтобы откачать воздух из баллона до давления p = 4,53 кПа. Изменением температуры можно пренебречь.
Запишем краткое условие задачи
V = 3000 см3
= 3000 см3
p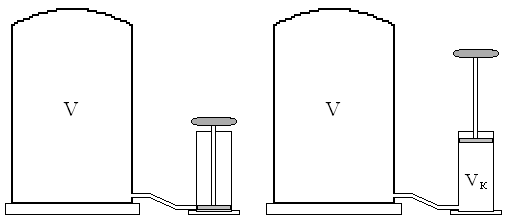 0 = 100 кПа
0 = 100 кПа
Vк = 200 см2
p = 4,53 кПа
n - ?
В начальном состоянии, объем воздуха равен объему баллона V, а его давление p0. При первом ходе поршня воздух заполняет камеру насоса и его объем становится равным V + VК . Поскольку температура воздуха и его масса в ходе данного процесса не изменяются, то, согласно закона Бойля-Мариотта, p0V = p1(V + VК ). Отсюда давление воздуха после первого хода поршня
![]()
Затем воздух из камеры насоса удаляется, и начинается второй цикл работы насоса. В этом цикле p1 - начальное давление воздуха, конечное давление воздуха в этом цикле работы насоса обозначим p2 . Снова применив закон Бойля-Мариотта получим: p1V = p2(V + VК ).
![]() .
.
Соответственно давление воздуха после третьего цикла работы поршня
![]() .
.
После n-го хода поршня давление воздуха
![]() .
.
Прологарифмировав это уравнение относительно n, получим, что
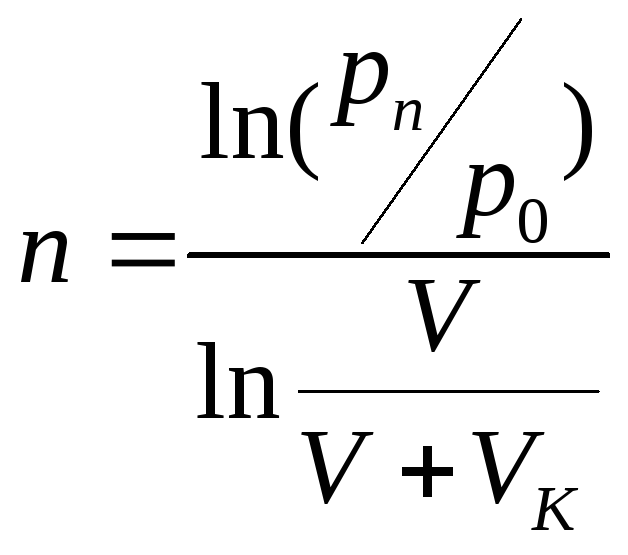
Ответ: n = 48.
Задача. Некоторая масса воздуха, занимавшая при температуре 270С и давлении 2 атм объём 120 л, подверглась нагреванию. Найти температуру газа, если нагревание было: 1) Изохорическим, причём давление возросло на 0,56 атм: 2) изобарическим, причём объём газа увеличился до 150 л. Определить массу газа.
Дано: Т1=300 К- начальная температура, р1=2·1.013·105 Па и р2=2.56·1.013·105 Па- начальное и конечное давления, V1=120·10-3 м3 и V2=150·10-3- начальный и конечный объём газа, μ=29·10-3 кг/моль- молярная масса воздуха, R=8.314 Дж/(моль·К)- молярная газовая постоянная.
Найти: T2- конечную температуру газа для обоих случае; m- массу газа.
Решение. Конечная температура Т2 находится из уравнений для изохорического и изобарического процессов, в каждое из которых входят лишь два термодинамических параметра:
-
p1/p2=T1/T2 и
-
V1/V2=T1/T2.
Масса газа m определяется из уравнения Менделеева- Клапейрона:
pV=![]() RT.
RT.
Представляя в уравнения числовые значения и вычисляя, находим:
-
1)T2=
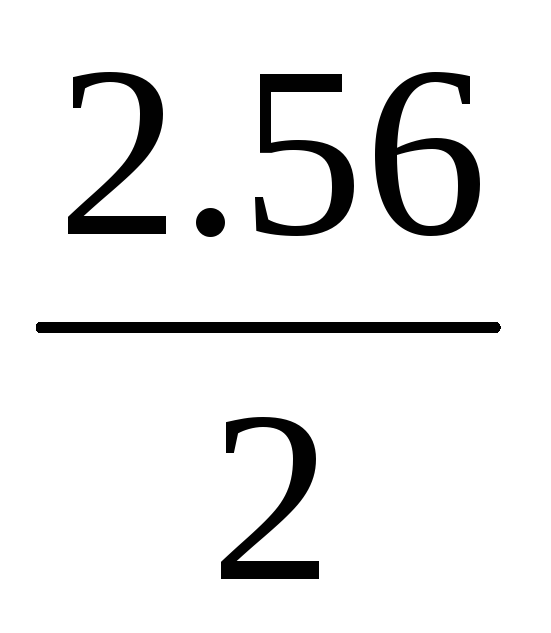 ·300
K= 384 K;
·300
K= 384 K;
2)T2=![]() ·300
K= 375 K.
·300
K= 375 K.
m=![]()
Ответ. Конечная температура газа при изохорическом процессе равна 1110С, при изобарическом процессе- 1020С. Масса газа равна0,283 кг.
Задача. Объем цилиндра поршневого насоса 0,50 л. Насос соединен с баллонам емкостью 3,0 л., содержащем воздух при нормальном атмосферном давлении. Найти давление воздуха в баллоне 5 рабочих ходов поршня случаях режимов работы: 1) нагнетательного; 2) разрежающего.
Дано: V1=0,50 л. = 0,50·10-3м3 – объем цилиндра насоса, V2=3,0 л. =3,0·10-3м3 – объем баллона, n=5 – число рабочих ходов поршня, p0=1,013·105 Па – первоначальное давление воздуха в баллоне.
Найти: pн и pp – давление воздуха в баллоне после n ходов поршня при нагнетательном и разрежающем режимах работы.
1) Решение. После n рабочих ходов поршня в нагнетательном режиме насос заберет из атмосферы объем воздуха Vn= nV1 при давлении р0; эта масса воздуха будет введена в объем баллона V2, создав там парциальное давление pn; т.к. изменение температуры не учитывается, то по закону Бойля-Мариотта.
рnV2=р0
nV1,
откуда pn=p0·![]() ·n
·n
Искомое давление воздуха в баллоне будет равно
pн=pn+p0=p0·
(![]() ·n+1)
·n+1)
Подставляя числовые значения, получим
pн=1,013·105
Па
![]() =1,86·105
Па
=1,86·105
Па
Ответ. В нагнетательном режиме давление воздуха в баллоне после 5 ходов поршня равно 1,86·105Па.
-
Решение. Если в начале первого рабочего хода поршня воздух в баллоне занимал объем V2 при давлении p0, то в разрежающем режиме к концу первого хода поршня та же масса воздуха займет объем V2+V1 при давлении p1. Т.к. изменение температуры не учитывается, то по закону Бойля-Мариотта
p1(V2+V1)=p0V2, откуда p1=V2/(V2+V1)p0
В начале второго хода поршня объем и давление газа в баллоне равны соответственно V2 и p1, в конце хода они равны V2+V1 и p2, откуда
p2=V2/(V2+V1)p1 или p2=(V2/(V2+V1))2p0
Продолжая те же рассуждения, находим, что к концу n-го рабочего хода
pn=(V2/(V2+V1))np0
Подставляя числовые значения получим
pp=(3·10-3/(3·10-3+0,5·10-3))5p0=0,48·105 Па
Ответ. В разряжающем режиме давление воздуха в сосуде после 5 ходов поршня равно 0,48·105Па.
Задача. Используя условие примера 6 и ответы к нему, найти количество тепла, поглощенного газом (воздухом), и изменение его внутренней энергии; вычислить работу газа при изобарическом процессе.
Дано: Т1=300К-начальная температура, р1=2·1,013·105Па-начальное давление, V1=120·10-3м3 ,V2=150·10-3м3-начальный и конечный объемы газа, ср=1,0·103Дж/(кг·К)-удельная теплоемкость воздуха при постоянном давлении, μ=29·10-3кг/моль- молярная масса воздуха, R=8,314Дж/(моль·К)-молярная газовая постоянная, Т2=384К и Т2’=375К-конечные температуры воздуха при изохорическом и изобарическом процессах соответственно, m=0,283кг- масса воздуха.
Найти: QV и Qp – количество тепла, поглощенные газом при изохорическом и изобарическом процессах, А – совершенную газом работу; ΔUV и ΔUр – изменение внутренней энергии в обоих случаях.
Решение. При изохорном процессе
QV=СVmΔT1
При изобарическом
Qp=срm ΔT2
Здесь сV и сp – удельные теплоемкости воздуха при постоянных объеме и давлении; cp/cV=1,4; ΔT1=Т2-Т1, а ΔT2= Т2’-Т1
Работа совершенная газом при изобарическом процессе, находится по формуле
Ар=p1ΔV=![]() RΔT
RΔT
Работа газа при изохарическом процессе
АV=0
Согласно первому началу термодинамики
ΔUр=Qp-Ap (изобарический процесс)
ΔUV=QV (изохорический процесс)
Подставляя числовые значения и получим для изохорического процесса.
QV=ΔUV=![]() Дж/(кг·К)
·0,283кг·84К=17кДж
Дж/(кг·К)
·0,283кг·84К=17кДж
Для изобарического процесса
Qp=103Дж/(кг·К) ·0,283кг·75К=21,2кДж;
Ар=2·1,013·105Па·30·10-3м3=6,08кДж;
и
![]()
Ответ:
Газ поглощает 17 кДж тепла при изохорическом
процессе и 21,2 кДж при изобарическом;
при изохорическом процессе газ не
совершает никакой работы,
![]() ,
при изобарическом
,
при изобарическом
![]() кДж;
изменение внутренней энергии в первом
случае равно 17 кДж, во втором-15,1 кДж.
кДж;
изменение внутренней энергии в первом
случае равно 17 кДж, во втором-15,1 кДж.
Задача. В латунный калориметр массой 0,15 кг, содержащий 0,20 кг воды при 15 0С, опустили железную гирю массой 0,26 кг при температуре 100 0С. Найти общую установившую температур. Потери тепла не учитывать.
Дано: mг=0,26 кг – масса гири, Т=373 К – начальная температура гири, mв=0,20 кг – масса воды, Т1=288 К – начальная температура воды и калориметра, mк=0,15 кг – масса калориметра, сг=460 Дж/(кг·К), св=4187 Дж/(кг·К), ск=380 Дж/(кг·К) – соответственно удельные теплоемкости железа, воды, латуни.
Найти: θ – окончательная температура (всех трех тел).
Решение. Составим уравнение теплового баланса. Количество тепла, отданное железной гирей:
Qг=сгmг(Т-θ).
Количество тепла, полученное водой:
Qв=свmг(θ-Т1).
Количество тепла, полученное калориметром:
Qк=скmк(θ-Т1).
На основании закона сохранения энергии
Qг=Qв+Qк ,
или
сгmг(Т-θ)=(свmв+скmк)(θ-Т1).
Находим из уравнения теплового баланса окончательную температуру:
![]() .
.
Подставляя числовые значения величин, получаем
![]()
Ответ: Окончательная температура 298 К (25ºС).
Задача. Стальной снаряд, летевший со скоростью 200 м/с, ударяется в земляную насыпь и застревает в ней. На сколько градусов повыситься температура снаряда, если на его нагревание пошло 60 % кинетической энергии?
Дано: υ0=200 м/с – начальная скорость снаряда, υк=0 – конечная скорость снаряда, к=60%=0,6 – доля кинетической энергии снаряда, ушедшая на его нагревание, с=460Дж/(кг·К) – удельная теплоемкость стали.
Найти: ΔТ – изменение температуры снаряда.
Решение.
Из всей кинетической энергии снаряда
на его нагревание ушла часть энергии ½
![]() .
.
Увеличение внутренней энергии снаряда равно
сmΔТ.
Составим уравнение теплового баланса:
cmΔТ=
![]()
![]() .
.
Из составленного уравнения теплового баланса:
ΔТ=![]() .
.
Подставляя числовые значения, получаем
ΔТ=![]()
Ответ. Температура снаряда повысилась примерно на 26 К.
Задача. Вычислить шаг резьбы сверла, если при сверлении в медном цилиндре осевого отверстия диаметром 25 мм цилиндр нагрелся на 43 К. Вращающий момент, приложенный к воротку, равен 16,2 Н·м; 70 % затрачиваемой энергии превращается во внутреннюю энергию цилиндра.
Дано: d=25·10-3 м – диаметр отверстия, ΔТ=43 К – повышение температуры цилиндра, М=16,2 Н·м – вращающий момент, развиваемый при сверлении, к=70%=0,70 – часть энергии, израсходованная на нагревание цилиндра, ρ=8900 кг/м3 – плотность меди, с=380Дж/(кг·К) – удельная теплоемкость меди.
Найти: p - шаг резьбы сверла.
Решение. Искомый шаг резьбы p можно найти, разделив высоту цилиндра h на число оборотов сверла n, которое необходимо сделать, чтобы просверлить цилиндр насквозь:
p=h/n.
При сверлении выделяется количество тепла
Q=cmΔТ=cShρΔТ,
где S=πd2/4
Отсюда
h=Q/cSρ ΔТ.
Величина n определяется из выражения для работы А, совершенной при сверлении цилиндра:
А=М2πn, откуда n=А/2πМ.
Подставив
значения h
и n
в выражение для р и приняв во внимание,
что по условию Q/A=![]() ,
получим
,
получим
р=![]()
В окончательном виде
р=![]()
Подставляя числовые значения, получаем
р=![]()
Ответ. Шаг резьбы сверла около 1,0мм.
Задача. На сколько километров пути хватит автомобилю 40 л бензина, если сила тяжести автомашины 35,3 кН, общее сопротивление движению составляет 0,050 этой силы, к.п.д. двигателя 18 %. Движение считать равномерным.
Дано: V=0.040 м3 – объема бензина, Р=35300 Н – сила тяжести автомашины, F=0,050 Р – сила сопротивления движению, η=0,18 – к.п.д. двигателя, q=4,6·107 Дж/кг – удельная теплота сгорания бензина, ρ=700 кг/м3 – плотность бензина.
Найти: s- пройденный путь.
Решение. Пройденный путь можно найти из формулы для работы, совершенной двигателем:
s=A/F.
Работу А двигатель совершает, используя часть (Q1) всей энергии Q, полученной при сжигании топлива:
η=Q1/Q, откуда Q1=Qη.
Энергия, выделяющаяся при сгорании топлива,
Q=qm, где m=ρV.
Отсюда
А=Q1= Qη= qmη=qρVη.
Сила тяги при равномерном движении равна силе сопротивления движению F, которая по условию составляет 0,050 силы тяжести машины, т.е.
F=0,050 Р.
Полученные нами выражения для А и F подставляем в формулу для s:
s=![]()
Подставляя числовые значения и вычисляя, получаем
s=![]()
Ответ. Бензина хватит примерно на 130 км.
Задача. На электроплитке мощностью 600 Вт за 35 мин нагрели 2,0 л воды от 293 до 373 К, причем 200 г воды обратилось в пар. Определить к.п.д. электроплитки.
Дано:![]() масса воды, нагреваемой на плитке до
кипения,
масса воды, нагреваемой на плитке до
кипения,![]() --
начальная и конечная температуры воды,
m=0,20
кг –
масса испарившейся воды, P
= 600 Вт –
мощность
тока в
электроплитке, t
= 2100 c
– время действия электроплитки,
--
начальная и конечная температуры воды,
m=0,20
кг –
масса испарившейся воды, P
= 600 Вт –
мощность
тока в
электроплитке, t
= 2100 c
– время действия электроплитки,
![]() - удельная теплоёмкость воды, r
= 2,26
- удельная теплоёмкость воды, r
= 2,26![]() - удельная теплота парообразования
воды.
- удельная теплота парообразования
воды.
Найти:![]() к.п.д.
электроплитки.
к.п.д.
электроплитки.
Решение: По определению к.п.д. нагревателя равен
![]() ,
,
где
![]() - количество тепла, израсходованное на
нагревание воды и на превращение части
её в пар, Q
= Pt
– тепловая энергия, израсходованная
электроплиткой.
- количество тепла, израсходованное на
нагревание воды и на превращение части
её в пар, Q
= Pt
– тепловая энергия, израсходованная
электроплиткой.
Подставим
выражения для
![]() и Q
в формулу
для к.п.д.:
и Q
в формулу
для к.п.д.:
![]() .
.
Подставляя числовые значения, получаем
![]()
![]()
Ответ: Коэффициент полезного действия электроплитки приблизительно равен 89%.
Задача.
У какого количества воды можно понизить
температуру от 20 до ![]() ,охлаждая
её 200 г серного эфира с начальной
температурой
,охлаждая
её 200 г серного эфира с начальной
температурой
![]() ,
испаряющегося под уменьшенным давлением?
Удельную теплоту испарения эфира считать
не зависящей от температуры. К.п.д.
установки 80%.
,
испаряющегося под уменьшенным давлением?
Удельную теплоту испарения эфира считать
не зависящей от температуры. К.п.д.
установки 80%.
Дано:
![]() = 0,8 – к.п.д. установки, m
= 0,2 кг –
масса серного эфира,
= 0,8 – к.п.д. установки, m
= 0,2 кг –
масса серного эфира,
![]() начальная
температура эфира и воды, с
= 2330
Дж/(кг
К), сВ=4187Дж/(кгК)
соответственно
удельные теплоемкости эфира и воды,
Т2=273К-конечная
температура эфира и воды.
начальная
температура эфира и воды, с
= 2330
Дж/(кг
К), сВ=4187Дж/(кгК)
соответственно
удельные теплоемкости эфира и воды,
Т2=273К-конечная
температура эфира и воды.
Найти: тв массу воды.
Решение. Задача решается с помощью уравнения теплового баланса. Испаряющийся при пониженном давлении эфир должен поглотить количество тепла rm. Так как при этом он охлаждается от Т1 до Т2, количество тепла, поглощенное им извне, будет равно rm - mc(T1-T2).Из-за несовершенства теплоизоляции тепло будет поступать и от окружающего атмосферного воздуха; по условию от охлаждаемой воды будет взята лишь часть Q1 = r m –cm(T1- T2) необходимо для испарения эфира тепла. На основании закона сохранения энергии имеем
m=r- c (T1-T2= cвmв(T1-T2).
Подставляя числовые значения, получим
![]()
Ответ. Масса воды, у которой можно понизить температуру, равна примерно 0,58 кг.
Задача.
При понижении температуры от 16 до 10 ![]() из каждого кубического метра воздуха
выделилось по 1,5 г воды. Какова была
относительная влажность воздуха при
16
из каждого кубического метра воздуха
выделилось по 1,5 г воды. Какова была
относительная влажность воздуха при
16![]() ?
?![]()
Дано:
![]() - первоначальная температура воздуха,
- первоначальная температура воздуха,
![]() конечная температура воздуха,
конечная температура воздуха,
![]() количество воды, выделившейся из каждого
кубического метра воздуха.
количество воды, выделившейся из каждого
кубического метра воздуха.
Найти:
![]() относительную
влажность воздуха при 16
относительную
влажность воздуха при 16 ![]() .
.
Решение.
По условию при температуре 238К воздух
насыщен водяными парами. Находим по
таблице плотность
![]() пара, насыщающего воздух при
пара, насыщающего воздух при
![]() ;
прибавив к этому числу количество влаги,
выделившейся из каждого кубического
метра воздуха
;
прибавив к этому числу количество влаги,
выделившейся из каждого кубического
метра воздуха
![]() ,
получим плотность пара, находившегося
в воздухе при
,
получим плотность пара, находившегося
в воздухе при
![]() ,
т. е. абсолютную влажность воздуха
,
т. е. абсолютную влажность воздуха
![]() .
Найдя в таблице плотность пара, насыщающего
воздух при
.
Найдя в таблице плотность пара, насыщающего
воздух при
![]() ,
вычислим относительную влажность
воздуха
,
вычислим относительную влажность
воздуха
![]() .
.
Подставляя
в формулу для
![]() числовые значения и производя вычисления,
получаем
числовые значения и производя вычисления,
получаем
![]() %=
80%.
%=
80%.
Ответ.
Относительная влажность воздуха при
![]() равна 80%.
равна 80%.
![]()
