- •Методичні вказівки щодо проведення лабораторних робіт
- •1 Загальні положення
- •2 Тематичний план лабораторних робіт
- •3 Методичні вказівки щодо виконання лабораторних робіт
- •Правила техніки безпеки при проведені лабораторних робіт
- •3.2. Підготовка до лабораторної роботи та її захист
- •Лабораторна робота № 1
- •Короткі теоретичні положення
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Оформлення роботи
- •Захист роботи:
- •На скільки процентів змінився б період коливань, коли б його довжина змінилась на 0,1%? Лабораторна робота № 4
- •Короткі теоретичні положення
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Оформлення роботи
- •Захист роботи:
- •4 Перелік навчально–методичної літератури
Порядок проведення лабораторної роботи:
-
Визначити висоту пробірки, прийняти її, як h1.
-
Набрати гарячу воду в хімічний стакан.
-
Замірити температуру води – T1.
-
За V1 прийняти величину в h1 умовних одиниць (у.о.). Тиск P1 приймемо за атмосферний.
-
Занурити пробірку відкритим кінцем до верху.
-
Витягти пробірку, закривши пальцем її верх, і не відпускати палець до кінця другого експерименту.
-
Налити холодну воду в хімічний стакан.
-
Перевернути пробірку пальцем вниз і занурити у воду.
-
Виміряти температуру води – T2.
-
Виміряти висоту повітряного стовпчика в пробірці – h2.
-
За V2 прийняти величину в h2 умовних одиниць (у.о.). Тиск P1 буде дорівнювати сумі атмосферного тиску і тиску водяного стовпчика всередині пробірки.
-
Тиск водяного стовпчика розраховується за формулою:
![]() ,
,
де
![]() – висота води всередині пробірки, 13,6 –
коефіцієнт конвертації розмірностей:
міліметри водного стовпчика в міліметри
ртутного стовпчика.
– висота води всередині пробірки, 13,6 –
коефіцієнт конвертації розмірностей:
міліметри водного стовпчика в міліметри
ртутного стовпчика.
-
Повторити пункти 1-12 ще два рази.
-
Перевірити формулу:
![]() :
:
14.1 Визначити C1 для трьох вимірів:
![]() .
.
14.2 Визначити C2 для трьох вимірів:
![]() .
.
-
Визначити похибки:
15.1 Розрахувати середнє арифметичне для коефіцієнту C1 виходячи з трьох експериментів за формулою:
![]() .
.
15.2 Визначити абсолютну похибку Δ для кожного обчисленого значення C1:
![]() .
.
15.3 Визначити середню абсолютну похибку
![]() :
:
![]() .
.
15.4 Визначити відносну похибку
![]() вимірювання C1:
вимірювання C1:
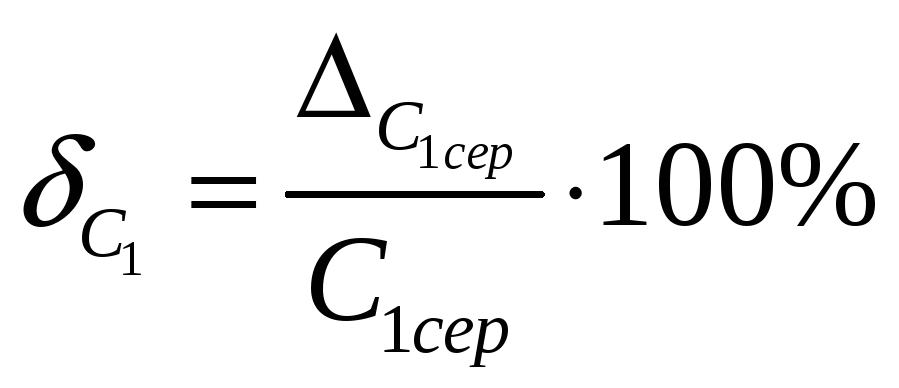 .
.
15.5 Розрахувати середнє арифметичне для коефіцієнту C2 виходячи з трьох експериментів за формулою:
![]() .
.
15.6 Визначити абсолютну похибку Δ для кожного обчисленого значення C2:
![]() .
.
15.7 Визначити середню абсолютну похибку
![]() :
:
![]() .
.
15.8 Визначити відносну похибку
![]() вимірювання C2:
вимірювання C2:
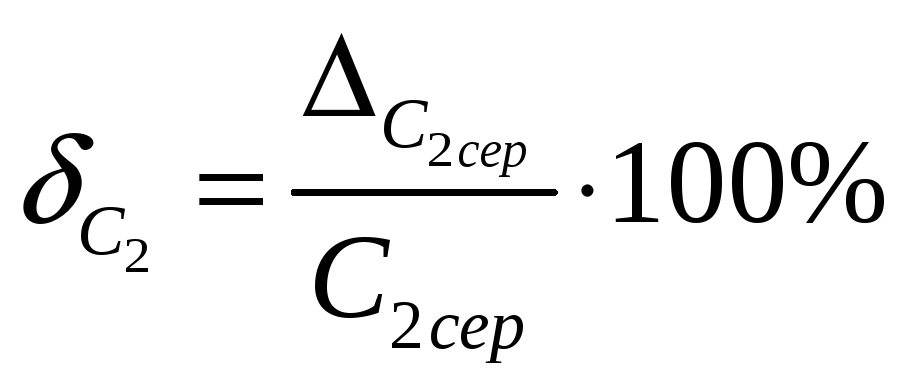 .
.
-
Записати результати обчислень до таблиці:
|
№ досл. |
P1, мм. рт. ст |
V1, м3 |
T1, К |
P2, мм. рт. ст |
V2, м3 |
T2, К |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
№ досл. |
|
|
% |
C2,
|
|
% |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
-
Написати висновки.
Оформлення роботи
Звіт з виконання лабораторної робити роботи повинен мати в собі: титульний лист, короткі тезиси з теорії, дані вимірювань, обчислення, таблицю з результатами обчислень, висновки. Якщо звіт оформлюється рукописно, то необхідно звернути увагу на каліграфію при письмі.
Захист роботи:
-
Що таке ідеальний газ?
-
Про що говорить рівняння об’єднаного газового закону?
-
Чому в лабораторній роботі об’єм прийнятий умовними одиницями висоти пробірки?
-
Які процеси називаються ізохорними, ізотермічними та ізобарними?
-
Як ви розумієте поняття термодинамічна температура?
Лабораторна робота № 7
Тема роботи: „ Визначення універсальної газової постійної повітря “
Мета роботи: Експериментальне визначення універсальної газової сталої
Обладнання:
-
Металевий балон.
-
Електрична плитка.
-
Вимірювальний прилад температури.
-
Гліцериновий U-подібний манометр.
Короткі теоретичні положення
При проведенні розрахунків кінетичної теорії застосовується таке поняття, як термодинамічна система, що представляє собою сукупність матеріальних тіл, які знаходяться в механічній і теплової взаємодії один з одним і з навколишнім середовищем. Такою системою може бути газ, що знаходиться, наприклад, в робочому об’ємі циліндра теплової машини або в камері згорання газотурбінного двигуна.
Термодинамічна система характеризується фізичними величинами, що дозволяють визначити її стан при взаємодії з навколишнім середовищем. Основні з них – тиск, температура й об’єм. Методи розрахунків у термодинаміці прийнятні для рівноважних систем.
Для рівноваги термодинамічної системи в усіх її точках повинні бути однаковими тиск і температура. Всяка ізольована система з часом приходить у рівновагу. Система залишається в рівновазі доти, поки вона не буде виведена з цього стану зовнішнім впливом.
Розрахунок термодинамічної системи розробляється виходячи з умови наявності ідеального газу, який задовольняє такі умови:
-
власний об’єм молекул газу дуже малий порівняно із загальним об’ємом газу;
-
сили взаємодії між молекулами газу відносно малі;
-
зіткнення молекул газу між собою та зі стінками посудини є пружними, тобто при зіткненні виконуються закони збереження механічної енергії та імпульсу.
Стан ідеального газу визначається за трьома термодинамічними параметрами: тиском, об’ємом та термодинамічною температурою.
Термодинамічна (абсолютна) температура T вимірюється за шкалою температур Кельвіна і пов’язана з температурою за шкалою Цельсія t відношенням:
T = 273 К + t C.
Однією з одиниць системи СІ є одиниця кількості речовини, яка називається молем. Моль – це така кількість речовини, у якій міститься одне і те саме число елементарних частинок (атомів, молекул, іонів тощо), без залежності від типу речовини. Таке число називається числом Авогадро (NA). Наприклад, 1 моль гелію, рівно як і 1 моль криптону буде мати одне и те саме число молекул – NA = 6 · 1023. При нормальний умовах об’єм одного молю речовини буде дорівнювати 22,4 · 10-3 м3. Це число називається молярним об’ємом (V) і є фізичною сталою, як і число Авогадро.
Для визначення параметрів стану будь-якого газу користуються рівнянням:
![]() ,
,
де P – тиск, R – універсальна
газова стала (8,31
![]() ),
T – термодинамічна температура.
),
T – термодинамічна температура.
Цей вираз називають рівнянням стану ідеального газу або рівнянням Клапейрона чи рівнянням Клапейрона – Менделєєва.
Є рівняння Менделєєва – Клапейрона, яке варто застосовувати для визначення стану газу при відомому значенні кількості речовини газу.
![]() ,
,
де
![]() – кількість речовини ν:
– кількість речовини ν:
![]() ,
,
де M – молярна маса.
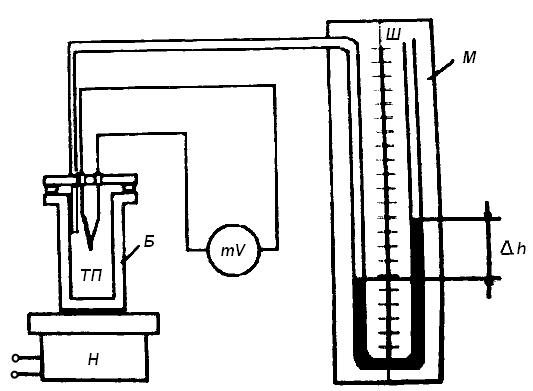
Рис.1 Схема лабораторної установки
У металічному балоні (Б) (рис. 1) знаходиться постійна маса повітря m (балон герметичний). Балон з’єднаний трубкою з манометром (М), що має вигляд U-образної скляної трубки, наповненої рідиною. Манометр має шкалу по якій можна виміряти різницю рівнів рідини у колінах манометра.
Балон встановлюють на нагрівач. В балон встановлена термопара за допомогою якої вимірюється температура газу. При підвищенні температури повітря в балоні його тиск збільшується, що приводить до зміни рівнів води в колінах манометра. Зміна обсягу повітря може бути виражена по різниці рівнів рідини
![]() ,
,
де S – площа поперечного перерізу трубки:
![]() ,
,
де d – внутрішній діаметр трубки.
Обсяг нагрітого повітря в балоні знаходиться по формулі:
![]() ,
,
де V0 – обсяг балона, V – зміна об’єму повітря, яка викликана підвищенням температури.
Тиск до нагрівання буде аналогічний атмосферному тиску після нагрівання
![]() ,
,
де P0 – атмосферний тиск, P – зміна тиску.
До уваги: 1 мм водяного стовпчика дорівнює 9,81 Па (1 мм гліцеринового стовпчика – 12,37 Па), отже:
![]() .
.