- •Глава 2. Сердечная недостаточность
- •Глава 3. Нарушения сердечного ритма и проводимости
- •Глава 4. Атеросклероз
- •Глава 5. Хроническая ишемическая болезнь сердца
- •Глава 6. Ишемическая болезнь сердца: нестабильная стенокардия, инфаркт миокарда, внезапная смерть
- •Глава 7. Эссенциальная артериальная гипертензия (гипертоническая болезнь)
- •Глава 8. Приобретенные пороки сердца
- •Глава 9. Инфекционный эндокардит
- •Глава 10. Кардиомиопатии
- •Глава 11. Миокардиты
- •Глава 12. Перикардиты
- •Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце
- •Глава 3. Нарушения сердечного ритма и проводимости
- •3.2. Электрофизиологические механизмы аритмий
- •1. Нарушения образования импульса:
- •2. Нарушения проведения импульса:
- •3. Комбинированные нарушения образования и проведения импульса:
- •3.2.1. Нарушения образования импульса
- •3.2.2. Нарушения проведения импульса
- •3.3. Методы диагностики нарушений сердечного ритма
- •3.3.1. Клиническое исследование
- •3.3.2. Электрокардиография
- •3.3.3. Длительное мониторирование экг по Холтеру
- •3.3.4. Внутрисердечное электрофизиологическое исследование (эфи)
- •3.3.5. Чреспищеводная электрическая стимуляция сердца (чпэс)
- •3.4. Диагностика аритмий
- •I. Нарушение образования импульса.
- •II. Нарушения проводимости.
- •III. Комбинированные нарушения ритма.
- •3.4.1. Наджелудочковые нарушения ритма
- •3.4.2. Желудочковые аритмии
- •3.4.3. Нарушения проводимости
- •3.5. Лечение нарушений сердечного ритма и проводимости
- •3.5.1. Медикаментозное лечение аритмий
- •3.5.2. Электрокардиостимуляция
- •3.5.3. Электрическая кардиоверсия
- •3.5.4. Хирургическое лечение тахиаритмий
- •Глава 4. Атеросклероз
- •Клиническая классификация ибс (вкнц амн ссср, 1984)
- •Рабочая классификация ибс
- •Глава 6. Ишемическая болезнь сердца: нестабильная стенокардия, инфаркт миокарда, внезапная смерть
- •2. Аритмии, усугубляющие сердечную недостаточность и гипоперфузию жизненно важных органов:
- •3. Аритмии — предвестники жизнеопасных нарушений сердечного ритма:
- •4. Аритмии — “спутники” острого им:
- •Классификация аг по степени повышения ад (jnc — VI, сша, 1997)
- •3. Оценить наличие факторов риска аг:
- •4. Оценить эффективность предыдущего антигипертензивного лечения.
- •Глава 10. Кардиомиопатии
- •Глава 11. Миокардиты
- •I. Острые перикардиты (менее 6 недель от начала заболевания):
- •II. Подострые перикардиты (от 6 недель до 6 месяцев от начала заболевания):
- •III. Хронические перикардиты (более 6 месяцев от начала заболевания):
- •I. Нарушение образования импульса
- •II. Нарушения проводимости:
- •III. Комбинированные нарушения ритма:
I. Острые перикардиты (менее 6 недель от начала заболевания):
1. Катаральный
2. Сухой, или фибринозный.
3. Выпотной, или экссудативный (серозный, серозно-фибринозный, гнойный, геморрагический):
-
без тампонады сердца;
-
с тампонадой сердца.
II. Подострые перикардиты (от 6 недель до 6 месяцев от начала заболевания):
1. Выпотной, или экссудативный.
2. Слипчивый, или адгезивный.
3. Сдавливающий, или констриктивный:
-
без тампонады сердца;
-
с тампонадой сердца.
III. Хронические перикардиты (более 6 месяцев от начала заболевания):
1. Выпотной, или экссудативный.
2. Слипчивый, или адгезивный.
3. Сдавливающий, или констриктивный.
4. Сдавливающий с обызвествлением (“панцирное сердце”):
-
без тампонады сердца;
-
с тампонадой сердца.
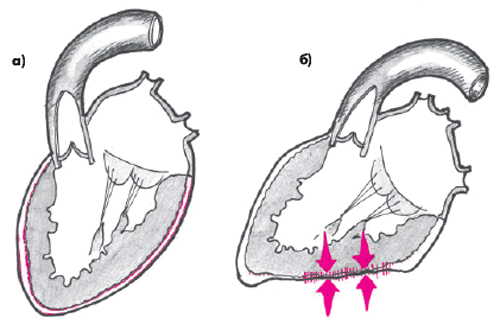
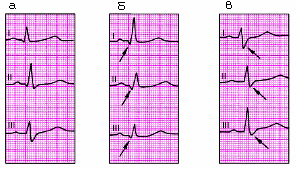
В большинстве случаев острый перикардит начинается с ограниченного катарального, а затем фибринозного воспаления, чаще всего локализующегося в устье крупных сосудов. Образующийся при этом в небольшом количестве воспалительный выпот, содержащий большое количество фибриногена, подвергается обратному всасыванию. Жидкие фракции выпота эффективно “отсасываются” через лимфатические сосуды, а нити фибрина откладываются на висцеральном и париетальном листках перикарда, несколько ограничивая их движение друг относительно друга и придавая им шероховатый складчатый вид (рис. 12.1, а). Ограниченный фибринозный перикардит, не сопровождающийся накоплением в полости перикарда сколько-нибудь заметных количеств экссудата, получил название сухого перикардита. Это наиболее частая форма острого перикардита.
В дальнейшем, если происходит тотальное вовлечение в воспалительный процесс сердечной сорочки, нарушается обратное всасывание экссудата и он начинает накапливаться в большом количестве в полости перикарда. В этих случаях говорят о выпотном, или экссудативном перикардите (рис. 12.1, б, в). Воспалительный выпот может быть серозным, серозно-фибринозным, гнойным или геморрагическим. Чаще всего выпотной перикардит следует за стадией сухого фибринозного перикардита и лишь в некоторых случаях минует эту стадию (например, при развитии тотальных аллергических, туберкулезных или опухолевых перикардитов). Воспалительная жидкость вначале располагается в нижнедиафрагмальной и заднебазальной частях полости перикарда (рис. 12.1, б), а затем распространяется на всю полость (рис. 12.1, в). В отдельных случаях объем жидкости может достигать 1–2 л.
В дальнейшем (подострая стадия), по мере стихания воспалительного процесса, экссудат рассасывается, а в листках перикарда разрастается грануляционная ткань, которая затем замещается соединительнотканными волокнами. Если этот продуктивный процесс сопровождается образованием выраженных соединительнотканных спаек между листками перикарда, говорят о так называемом адгезивном (слипчивом) перикардите (рис. 12.1, г).
Иногда рубцовая ткань облитерирует всю полость перикарда, стягивает висцеральный и париетальный листки, что, в конечном счете, приводит к выраженному сдавлению сердца (рис. 12.1, д). Такой исход выпотного перикардита получил название констриктивного, или сдавливающего перикардита.
Наконец, в некоторых случаях в рубцово измененном перикарде откладывается кальций и происходит обызвествление перикарда, который превращается в ригидный, плотный, малоподвижный мешок (панцирь), окружающий сердце (“панцирное сердце”).
|
|
|
Рис. 12.1. Схематическое изображение морфологических изменений, характерных для различных клинических форм перикардитов: а — сухой (фибринозный) перикардит; б, в — экссудативный перикардит; г — адгезивный (слипчивый) перикардит; д — констриктивный перикардит |
|
1. Сухой (фибринозный) перикардит отличается ограниченным характером воспаления листков перикарда и отсутствием в полости перикарда воспалительного выпота. В большинстве случаев сухой перикардит заканчивается выздоровлением (сохраняется лишь небольшое утолщение листков перикарда), реже происходит его трансформация в выпотной перикардит.
2. Выпотной (экссудативный) перикардит характеризуется распространенным воспалительным процессом и наличием в полости перикарда экссудата (серозного, серозно-фибринозного, гнойного или геморрагического). Исходами выпотного перикардита могут быть полное рассасывание экссудата и сохранение утолщения листков перикарда (при благоприятном течении заболевания), а также формирование адгезивного (слипчивого), констриктивного (сдавливающего) перикардита или образование “панцирного сердца”.
3. Адгезивный (слипчивый) перикардит характеризуется наличием выраженных соединительнотканных спаек между листками перикарда, образующихся иногда при рассасывании экссудата, разрастании грануляционной ткани, которая затем замещается соединительнотканными волокнами.
4. Констриктивный (сдавливающий) перикардит отличается не только наличием спаек между листками перикарда, но и полной или частичной облитерацией полости перикарда, что приводит к выраженному сдавлению сердца.
5. “Панцирное сердце” — это вариант сдавливающего перикардита, при котором происходит обызвествление перикарда, который превращается в ригидный, плотный, малоподвижный мешок (панцирь), окружающий сердце.
|
12.3. Клиническая картина и диагностика
|
12.3.1. Сухой перикардит |
|
|
Клиническая картина острого перикардита во многом определяется характером и тяжестью основного заболевания, которое осложняется воспалением сердечной сорочки (вирусная или кокковая инфекция, туберкулез, диффузные заболевания соединительной ткани, аллергические реакции, инфаркт миокарда и т.д.). Тем не менее у больных с острым перикардитом различного генеза можно обнаружить некоторые общие проявления заболевания, которые позволяют заподозрить воспалительное поражение листков перикарда.
Жалобы
Нередко кардиальным симптомам острого инфекционного (вирусного или бактериального) перикардита предшествуют неспецифические проявления воспалительного синдрома: небольшое повышение температуры тела, познабливание, недомогание, боли и тяжесть в скелетных мышцах.
Боль в области сердца является основным симптомом сухого перикардита, хотя обнаруживается не во всех случаях заболевания. Обычно больные жалуются на тупые, однообразные, не слишком интенсивные боли, которые локализуются за грудиной или слева от нее и иррадиируют в обе руки, трапециевидные мышцы, в эпигастральную область. В большинстве случаев боли появляются и нарастают постепенно, могут несколько ослабевать после приема анальгетиков, но затем возобновляются снова и длятся часами и сутками.
В других случаях боли могут быть достаточно интенсивными, напоминая приступ стенокардии или даже ангинозный статус при инфаркте миокарда.
Характерной особенностью перикардиальных болей является их усиление в положении больного лежа на спине, при глубоком вдохе, кашле и глотании. Часто боли уменьшаются в положении сидя и при поверхностном дыхании. Нитроглицерин не купирует боль.
Иногда больные жалуются на сухой кашель, одышку, сердцебиения, дисфагию, которые носят преимущественно рефлекторный характер.
|
1. Боли в области сердца являются основным субъективным проявлением сухого перикардита. 2. Наиболее характерными особенностями перикардиальной боли являются:
постоянный, длительный и однообразный характер боли;
связь с положением тела (боли усиливаются в положении лежа на спине и ослабевают в вертикальном положении);
связь с дыханием и кашлем (усиление при глубоком вдохе и кашле);
отсутствие купирующего эффекта нитроглицерина. |
Следует все же помнить, что при туберкулезных, уремических и опухолевых перикардитах боли в области сердца могут отсутствовать совсем или быть слабо выраженными.
Осмотр
При наличии болевого синдрома нередко обращает на себя внимание вынужденное сидячее положение больного в постели, которое несколько уменьшает соприкосновение друг с другом воспаленных листков перикарда (рис. 12.2), и боль в области сердца становится менее интенсивной. Отмечается также поверхностное частое дыхание.
|
|
|
Рис. 12.2. Влияние положения тела на взаимное расположение висцерального и париетального листков перикарда при сухом (фибринозном) перикардите: а — вертикальное положение; б — положение лежа на спине |
Осмотр, пальпация и перкуссия сердца
При осмотре, пальпации и перкуссии сердца никаких специфических признаков сухого перикардита обычно выявить не удается. В редких случаях, при более распространенном и выраженном воспалении листков перикарда, пальпаторно над областью сердечной тупости можно ощутить слабое низкочастотное дрожание — своеобразный эквивалент шума трения перикарда.
Аускультация
При сухом перикардите тоны сердца не изменены. Основным аускультативным признаком заболевания является шум трения перикарда.
Шум имеет непостоянный характер, синхронен с фазами сердечной деятельности, но не всегда совпадает с ними, начинаясь в систоле и заканчиваясь в диастоле.
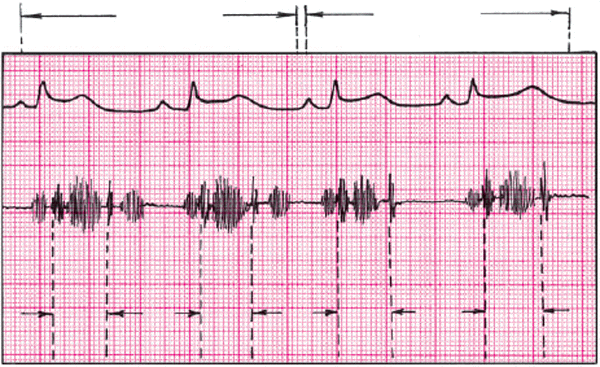
Начало заболевания проявляется нежным, ограниченным по протяжению шумом, возникающим обычно на высоте боли. Такой шум трудно отличим от короткого систолического шума. Увеличение фибринозных наложений формирует классический характер шума трения перикарда. Он становится грубым, жестким, высокочастотным, напоминающим скрип снега под ногами или трение листков бумаги друг о друга. В половине случаев к двухкомпонентному шуму (систола предсердий и желудочков) присоединяется третий компонент шума в период раннего диастолического наполнения желудочков (рис. 12.3).
|
|
|
Рис. 12.3. Трехкомпонентный (слева) и двухкомпонентный (справа) шум трения перикарда при сухом (фибринозном) перикардите. Арабскими цифрами «1», «2», «3» обозначены, соответственно, предсердный, систолический и диастолический компоненты шума. S — систола; D — диастола |
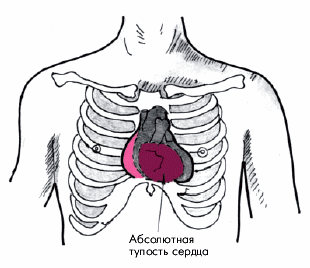
Местом аускультации шума трения перикарда является зона абсолютной тупости сердца. Важным отличительным признаком описываемого шума является его плохая проводимость. Он не проводится даже в зону относительной тупости сердца (Е.Е. Гогин, 1996). Шум носит непостоянный, преходящий характер (может исчезать в течение нескольких часов и появляться на следующий день). Усиление контакта висцерального и париетального листков с соответствующим усилением шума трения перикарда возможно при выполнении таких приемов, как надавливание стетоскопом на грудную стенку, наклон больного вперед, запрокидывание головы назад, глубокий выдох.
Следует помнить, что отсутствие при аускультации шума трения перикарда еще не исключает диагноз сухого перикардита.
|
Шум трения перикарда при сухом перикардите отличается следующими особенностями: 1. Шум выслушивается исключительно в зоне абсолютной тупости сердца и никуда не проводится. 2. Шум непостоянен и может меняться в течение суток у одного и того же больного. 3. Шум трения перикарда усиливается:
в вертикальном и наклоненном вперед положении пациента;
при максимальном выдохе;
при надавливании фонендоскопом на грудную стенку.
|
Шум трения перикарда следует отличать от плевроперикардиальных шумов, которые выслушиваются при прекардиальном сухом плеврите. Плевроперикардиальный шум выслушивается синхронно с сердечным ритмом, но отличается от шума трения перикарда некоторыми особенностями, отраженными в табл. 12.2.
Таблица 12.2
Отличия шума трения перикарда и плевроперикардиального шума
|
Признаки |
Шум трения перикарда |
Плевроперикардиальный шум |
|
Причина |
Сухой перикардит |
Сухой прекардиальный плеврит |
|
Место выслушивания |
Абсолютная тупость сердца |
Относительная тупость сердца |
|
Изменение при задержке дыхания |
Сохраняется |
Исчезает |
Артериальный пульс и АД
Артериальный пульс и АД при сухом перикардите практически не изменяются.
Лабораторные данные
Лабораторные данные неспецифичны. Возможен лейкоцитоз, сдвиг формулы крови влево, увеличение СОЭ, повышение содержания серомукоида, С-реактивного протеина, гипергаммаглобулинемия и т.д.
Электрокардиограмма
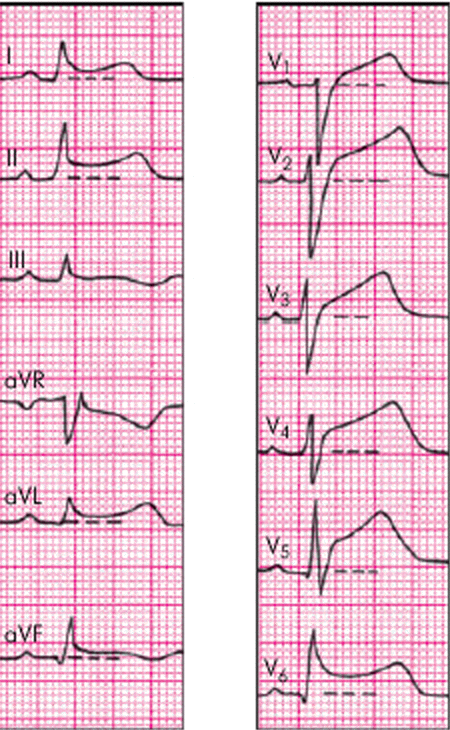
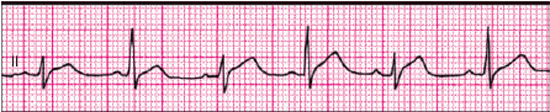
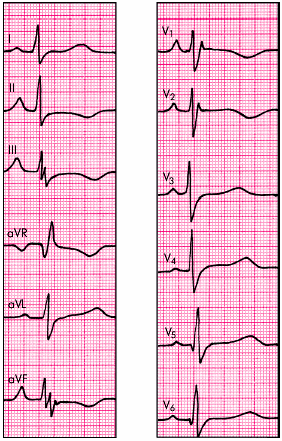
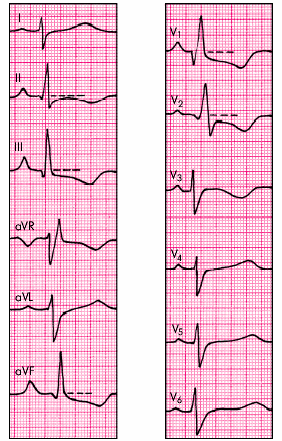
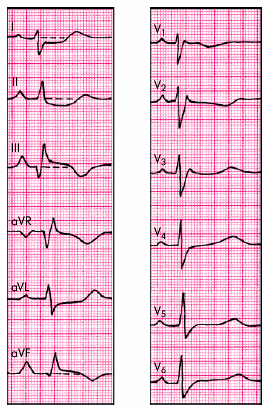
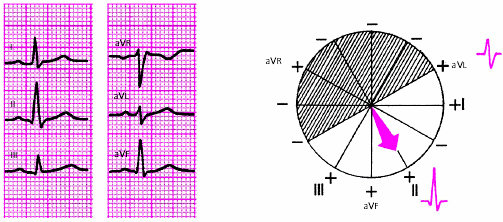
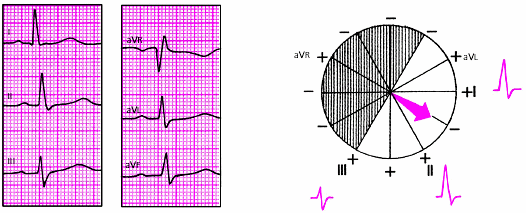
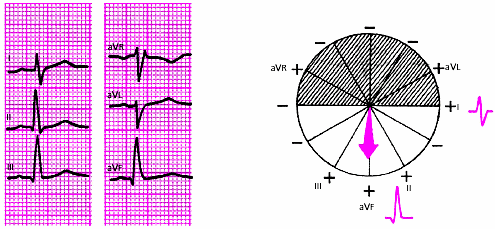
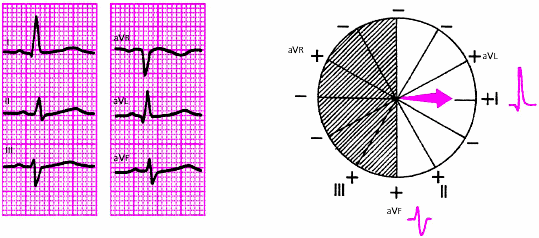
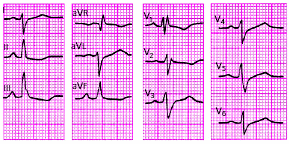
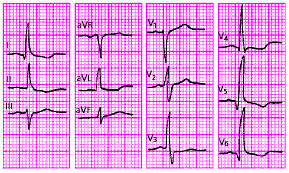
Электрокардиографические изменения при остром перикардите обусловлены сопутствующим повреждением субэпикардиальных слоев миокарда, что выражается в смещении сегмента RS–Т выше изолинии. В отличие от субэпикардиального (или трансмурального) повреждения миокарда при ИБС, когда эти изменения выявляются, как правило, лишь в нескольких электрокардиографических отведениях, при острых перикардитах подъем сегмента RS–Т регистрируется в большинстве стандартных, усиленных однополюсных отведений от конечностей и в нескольких грудных отведениях. Это обусловлено тем, что при остром перикардите, как правило, имеет место большая площадь поражения, затрагивающая многие участки сердечной мышцы (рис. 12.4). Кроме того, в отличие от инфаркта миокарда при острых перикардитах обычно имеет место конкордантный (однонаправленный) подъем сегмента RS–Т, т.е. не наблюдается дискордантного смещения сегмента ниже изолинии в отведениях, активные электроды которых расположены над участками миокарда, противоположными субэпикардиальному повреждению.
|
Рис. 12.4. Электрокардиограмма при остром перикардите |
|
Через несколько дней сегмент RS–Т возвращается к изолинии и в этих же отведениях нередко формируются отрицательные зубцы Т, что указывает на нарушение процесса реполяризации в субэпикардиальных участках миокарда.
Следует помнить также, что возникновение острого перикардита обычно не сопровождается появлением патологических зубцов Q. Появление выпота в полости перикарда (экссудативный перикардит) может сопровождаться значительным снижением вольтажа всех зубцов ЭКГ. Кроме того, при острых перикардитах на ЭКГ можно выявить признаки синусовой тахикардии, а также различных нарушений ритма и проводимости.
|
Наиболее типичными электрокардиографическими признаками острого перикардита являются:
конкордантный (однонаправленный) подъем сегмента RS–T во многих ЭКГ–отведениях;
отсутствие патологического зубца Q;
инверсия зубца Т во многих отведениях;
значительное снижение вольтажа ЭКГ (при появлении экссудата в полости перикарда). |
Эхокардиограмма
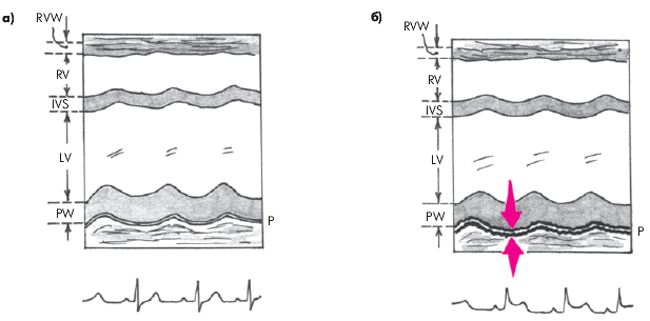
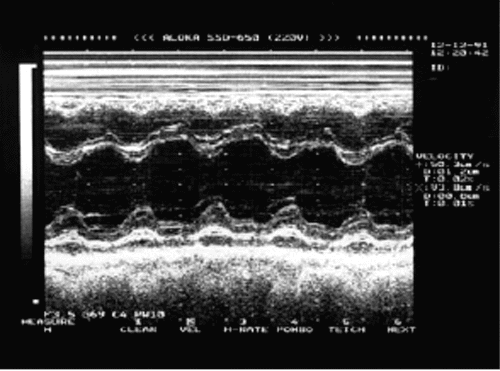
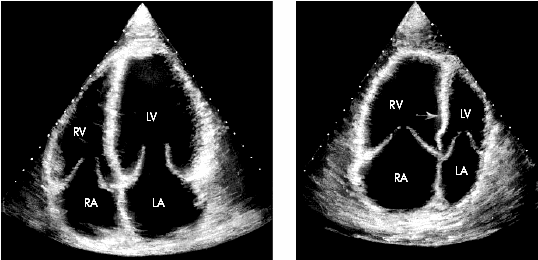
В большинстве случаев при ограниченном сухом (фибринозном) перикардите на ЭхоКГ каких-либо специфических признаков заболевания обнаружить не удается. Если имеется более распространенное и выраженное воспаление перикарда, при М-модальном и двухмерном эхокардиографическом исследовании выявляется утолщение листков перикарда, иногда небольшое расхождение листков (сепарация) и появление между ними узкого эхонегативного пространства, что свидетельствует о наличии в полости перикарда очень небольшого количества экссудата.
На рис. 12.5 показана одномерная ЭхоКГ, зарегистрированная у больного с сухим (фибринозным) перикардитом.
|
|
|
|
Рис. 12.5. Одномерная эхокардиограмма, зарегистрированная у больного с сухим (фибринозным) перикардитом (б). Для сравнения показана ЭхоКГ здорового человека (а). Объяснение в тексте |
|
|
12.3.2. Экссудативный (выпотной) перикардит |
|
|
|
|
Особенности патогенеза
Экссудативный (выпотной) перикардит характеризуется распространенным (тотальным) воспалением листков перикарда, в связи с чем нарушается всасывание образующегося экссудата, и в полости перикарда накапливается большое количество воспалительной жидкости.
В большинстве случаев выпотной перикардит проходит стадию сухого перикардита. У больных с туберкулезной, аллергической, опухолевой и некоторыми другими формами воспаления формирование выпотного перикардита минует стадию сухого перикардита, и экссудат накапливается в полости перикарда с самого начала заболевания.
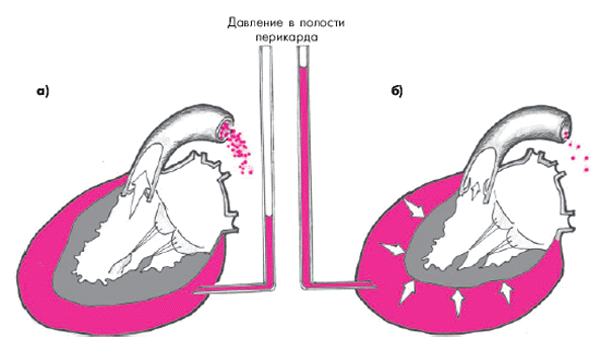
Гемодинамическое значение перикардиального выпота определяется объемом и скоростью его накопления, а также состоянием листков перикарда (рис. 12.6). Так, медленное накопление воспалительного экссудата, как правило, сопровождается постепенным растяжением наружного листка перикарда, заполнением перикардиальных карманов и медленным увеличением объема полости (рис. 12.6, а). В этих случаях повышения внутриперикардиального давления долго не происходит и внутрисердечная гемодинамика заметно не изменяется. В то же время значительное скопление экссудата в полости перикарда может привести к сдавлению трахеи, пищевода, возвратного нерва, участков легочной ткани, непосредственно прилегающих к сердцу, что сопровождается соответствующими клиническими симптомами (см. ниже).
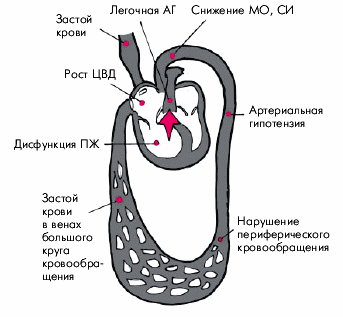
Если перикардиальный выпот накапливается очень быстро, растяжения наружного листка перикарда, адекватного увеличенному объему воспалительной жидкости, не происходит, и давление в полости перикарда существенно возрастает (рис. 12.6, б). Это приводит к сдавлению камер сердца и резкому уменьшению диастолического наполнения желудочков. Развивается так называемая тампонада сердца. В отличие от рестриктивной или гипертрофической кардиомиопатии, при которых также нарушено диастолическое наполнение желудочков, при тампонаде сердца никогда не бывает застоя крови в легких. Это объясняется тем, что при внешнем сдавлении сердца прежде всего нарушается диастолическое наполнение правого желудочка, возникает застой крови в венах большого круга кровообращения, тогда как в легочную артерию поступает сравнительно малый объем крови. В результате уменьшается величина преднагрузки на ЛЖ, его ударный выброс и нарушается перфузия периферических органов и тканей, тогда как давление наполнения ЛЖ остается нормальным или пониженным. Кроме того, при тампонаде сердца, как правило, наблюдается выраженное сдавление полых вен, которое еще больше усугубляет нарушения кровообращения. Важно помнить, что в положении лежа в большей степени нарушается отток из верхней полой вены, а в положении сидя — из нижней (почечное и портальное кровообращение).
|
|
|
Рис. 12.6. Схематическое изображение экссудативного перикардита без тампонады (а) и с тампонадой сердца (б) |
|
1. Формирование выпотного (экссудативного) перикардита в большинстве случаев (за редким исключением) проходит стадию сухого перикардита. 2. При медленном накоплении выпота в полости перикарда и небольшом объеме воспалительной жидкости существенных гемодинамических сдвигов может не происходить, тогда как быстрое накопление экссудата и значительный его объем могут приводить к развитию тампонады сердца. 3. Важнейшими гемодинамическими следствиями развивающейся при выпотном перикардите тампонады сердца являются:
уменьшение диастолического наполнения правых отделов сердца;
застой крови в венах большого круга кровообращения;
гиповолемия малого круга кровообращения;
уменьшение преднагрузки на ЛЖ и снижение его ударного объема;
нарушение перфузии периферических органов и тканей.
4. Для тампонады сердца не характерно возникновение застоя крови в малом круге кровообращения. |
Жалобы
Если экссудат в полости перикарда накапливается медленно и тампонада сердца не развивается, клинические проявления болезни могут ограничиться, в основном, признаками воспалительного синдрома. Больные с инфекционным экссудативным перикардитом жалуются на лихорадку, ознобы, симптомы интоксикации.
В самом начале заболевания (стадия сухого перикардита) могут отмечаться боли в области сердца (см. выше), однако по мере накопления экссудата и расхождения листков перикарда боли уменьшаются и исчезают. Тем не менее многие больные все же отмечают сохраняющееся ощущение тяжести в области сердца.
В более редких случаях могут появиться симптомы, связанные со сдавлением близлежащих органов:
-
трахеи (“лающий” кашель);
-
пищевода (нарушение проглатывания пищи — дисфагия);
-
легких (одышка);
-
возвратного гортанного нерва (осиплость голоса) и т.п.
Хотя перечисленные симптомы могут встречаться при любых формах выпотного перикардита, все же они более характерны для случаев, сопровождающихся тампонадой сердца.
Осмотр
При больших объемах перикардиального выпота больные нередко занимают вынужденное сидячее положение в постели. При экссудативном перикардите это связано с тем, что в положении лежа на спине значительно усугубляются гемодинамические нарушения, связанные с затруднением притока крови к сердцу. В частности, в горизонтальном положении больного происходит резкое сдавление экссудатом устья верхней полой вены. В результате нарушается приток крови к сердцу, уменьшается сердечный выброс, АД, появляются тахикардия, одышка.
Осмотр, пальпация и перкуссия сердца
При осмотре грудной клетки иногда можно заметить некоторое выбухание передней грудной стенки в прекардиальной области, а также легкую отечность кожи и подкожной клетчатки в области сердца (перифокальная воспалительная реакция). Верхушечный толчок ослаблен или не пальпируется совсем.
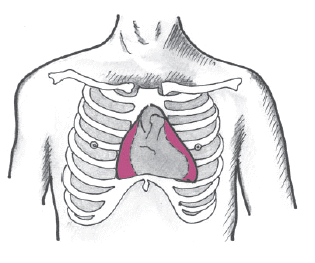
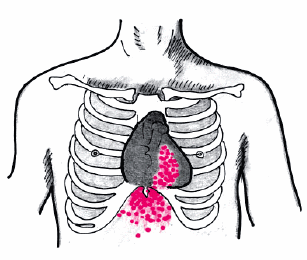
В типичных случаях границы сердца расширены во все стороны (рис. 12.7), причем почти над всей поверхностью сердца определяется абсолютно тупой перкуторный звук. При этом создается впечатление резко расширенной абсолютной тупости сердца, которая в нижних отделах практически совпадает с границами относительной тупости.
Конфигурация сердца приобретает своеобразную треугольную или трапециевидную форму. Причем границы сердечной тупости изменяются в зависимости от положения тела больного. В положении лежа сердечная тупость принимает более округлую форму. В положении сидя или стоя сердечная тупость еще больше расширяется в области нижних межреберий, тогда как во II–III межреберьях ее размеры по понятным причинам уменьшаются.
|
Рис. 12.7. Конфигурация сердца при экссудативном перикардите |
|
Аускультация
В начальных стадиях заболевания (стадия сухого перикардита) над областью абсолютной тупости сердца может выслушиваться шум трения перикарда (см. выше). Однако по мере накопления в полости перикарда экссудата шум трения перикарда исчезает из-за отсутствия контакта между перикардиальными листками.
Следует подчеркнуть, что при сравнительно небольшом или умеренном количестве экссудата у больного можно иногда выслушать непостоянный шум трения перикарда, слышимый только при определенном положении тела больного и быстро исчезающий при его изменении. Шум, например, улавливается иногда только при запрокидывании головы назад (симптом Герке) или во время глубокого вдоха (симптом Потена).
В результате смещения сердца кзади тоны сердца становятся слышимыми медиальнее верхушечного толчка, а в нижнелевых отделах сердечной тупости они резко ослаблены (Е.Е. Гогин, 1996).
Артериальный пульс и АД
При отсутствии признаков сдавления (тампонады) сердца АД может быть не изменено. Тенденция к снижению систолического и пульсового АД указывает на возможные гемодинамические нарушения, связанные со сдавлением крупных вен (уменьшение преднагрузки) или развивающуюся тампонаду сердца.
Рентгенологическое исследование
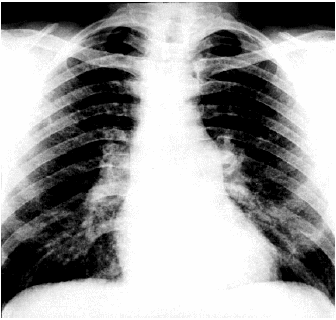
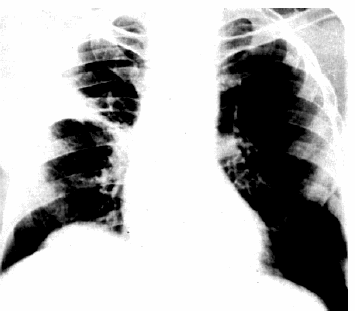
При рентгенологическом исследовании отмечают увеличение тени сердца, сглаживание сердечного контура, исчезновение “талии” сердца (рис. 12.8). Тень сосудистого пучка становится короткой. При изменении положения тела контуры сердца также изменяются. Характерна ослабленная пульсация контура тени сердца, тогда как пульсация аорты остается достаточно интенсивной. Считают, что треугольная форма тени сердца возникает при длительно существующем хроническом выпоте, поскольку наружный листок перикарда при этом теряет свою эластичность, становится ригидным.
|
Рис. 12.8. Рентгенограмма сердца в прямой проекции больного с экссудативным перикардитом |
|
Эхокардиограмма
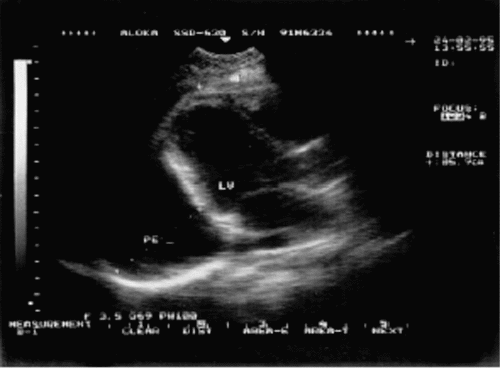
При наличии патологического выпота в полости перикарда, превышающего нормальный объем серозной жидкости (около 30–50 мл), на эхокардиограмме обнаруживают разделение листков перикарда с образованием эхонегативного пространства за задней стенкой ЛЖ, причем диагностическое значение имеет диастолическая сепарация листков перикарда. Движение париетального листка перикарда при этом уменьшается или исчезает совсем, тогда как экскурсия эпикардиальной поверхности сердца возрастает (гиперкинезия эпикарда), что служит косвенным признаком наличия жидкости в полости перикарда.
Количественное определение объема выпота в полости перикарда с помощью ЭхоКГ затруднено, хотя считается, что 1 см эхонегативного пространства между листками перикарда соответствует 150–400 мл, а 3–4 см — 500–1500 мл жидкости.
Незначительное количество выпота при М-модальном исследовании можно обнаружить только в области задней стенки ЛЖ, причем величина сепарации листков перикарда не превышает 3–5 мм (рис. 12.9). При двухмерном исследовании из парастернального доступа по короткой или длинной оси эхонегативное пространство также располагается за ЛЖ и имеет вид тонкого полумесяца.
|
|
|
Рис. 12.9. Двухмерная эхокардиограмма у больного со значительным количеством выпота Одномерная эхокардиограмма при выпотном перикардите. Отмечается уплотнение и умеренная сепарация листков перикарда |
При умеренном количестве выпота величина эхонегативного пространства достигает 4–8 мм. Жидкость можно обнаружить не только за ЛЖ, но и за ЛП. При двухмерном исследовании максимальное количество жидкости выявляется в области верхушки.
Значительное количество выпота сопровождается появлением эхонегативного пространства (размером 9–20 мм и более) как сзади, так и спереди камер сердца (рис. 12.10). Возникает гиперкинезия свободных стенок ЛЖ и МЖП и другие нарушения.
|
|
|
|
Рис. 12.10. Двухмерная эхокардиограмма у больного со значительным количеством выпота в полости перикарда (РЕ). Жидкость определяется за задней стенкой левого желудочка, в области верхушки сердца и перед правым желудочком |
|
|
12.3.3. Клиническая картина экссудативного перикардита, осложненного тампонадой сердца |
|
|
|
|
У больных с тампонадой сердца, обусловленной экссудативным перикардитом, в клинической картине обычно преобладают симптомы, связанные с уменьшением венозного притока крови к сердцу и низким сердечным выбросом:
-
прогрессирующая общая слабость и неспособность больных выполнять даже минимальные физические нагрузки;
-
сердцебиение (тахикардия рефлекторного происхождения);
-
головокружение, а в тяжелых случаях — преходящие нарушения сознания, указывающие на недостаточную перфузию головного мозга;
-
нарастающая одышка.
|
Причина прогрессирующей одышки у больных с тампонадой сердца заключается не в венозном застое крови в легких, который не характерен для тампонады сердца (см. выше), а в гиповолемии малого круга кровообращения, ведущей к нарушению перфузионно-вентиляционных соотношений в легких и газового состава крови. |
Дальнейшее нарастание давления в полости перикарда и критическое снижение сердечного выброса приводят к возникновению мучительных приступов резкой слабости, сопровождающихся тахикардией, одышкой, падением АД, нитевидным пульсом, профузным холодным потом, нарушениями сознания, снижением диуреза, т.е. признаками кардиогенного шока. Нередко у больных появляется страх смерти.
Сдавление органов, сосудов и нервных стволов, расположенных в непосредственной близости от сердца (трахеи, пищевода, полых вен, возвратного гортанного нерва и др.), нередко приводит к появлению следующих симптомов:
-
кашель (сдавление трахеи);
-
дисфагия (сдавление пищевода);
-
осиплость голоса (сдавление возвратного гортанного нерва) и другие.
Наконец, при медленном прогрессировании тампонады сердца и длительном ее существовании нарастают признаки венозного застоя в большом круге кровообращения, причем увеличение печени и появление асцита обычно предшествуют возникновению периферических отеков. При этом больные предъявляют следующие жалобы:
-
боли в правом подреберье, связанные с увеличением размеров печени;
-
увеличение живота в объеме (асцит);
-
диспепсические явления, похудание и анорексия, обусловленные венозным застоем в портальной системе и нарушением функции органов брюшной полости.
-
появление отеков нижних конечностей.
Следует помнить также, что хотя типичные перикардиальные боли в грудной клетке у больных с тампонадой сердца отсутствуют, многие пациенты жалуются на своеобразное ощущение постоянного давления в области сердца (“камень на сердце”).
Осмотр и исследование органов брюшной полости и легких
В тяжелых случаях внешний вид больных с тампонадой сердца достаточно характерен. Больные обычно занимают вынужденное положение. Они сидят в постели, туловище наклонено вперед, и как бы застывают в позе глубокого поклона. Иногда больные встают на колени, упираясь лбом и плечами в подушку (поза Брейтмана). Такое положение уменьшает сдавление экссудатом устья верхней полой вены и частично разгружает бассейн этой вены, способствуя небольшому увеличению венозного притока крови к сердцу.
Характерны бледность кожных покровов, нередко в сочетании с диффузным серым цианозом, похолодание конечностей. При возникновении приступов резкой слабости, сопровождающихся падением АД, частым нитевидным пульсом, бледность и цианоз усиливаются, появляется липкий холодный пот и другие симптомы, свойственные кардиогенному шоку.
Отечный синдром, обусловленный нарушением венозного притока крови к сердцу, сдавлением полых вен и повышением ЦВД, обычно появляется у больных с хронической тампонадой сердца. В этих случаях у больных можно выявить:
-
болезненность в правом подреберье и увеличение размеров печени, особенно левой доли, что связано со сдавлением нижней полой вены;
-
наличие свободной жидкости в брюшной полости (асцит);
-
отеки на стопах и голенях.
-
изредка развивается отек одной из рук (чаще левой), сопровождающийся расширением вен и цианозом; такая односторонняя отечность может быть вызвана сдавлением безымянной вены.
При исследовании легких обращает на себя внимание отсутствие влажных хрипов и других признаков застоя крови в системе малого круга кровообращения, несмотря на наличие у больных с тампонадой сердца нарастающей одышки.
Исследование сердца
При осмотре, пальпации, перкуссии и аускультации сердца у больных с тампонадой обычно обнаруживают те же изменения, что и при экссудативном перикардите без сдавления камер сердца: ослабление или исчезновение верхушечного толчка, расширение границ сердца, треугольную или шаровидную конфигурацию сердца ослабление тонов сердца, стойкую тахикардию (см. выше).
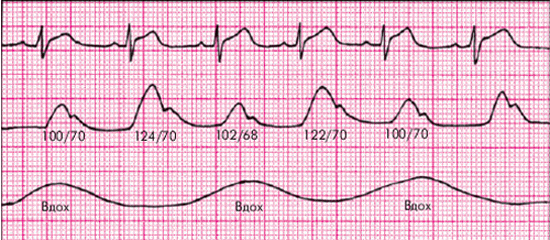
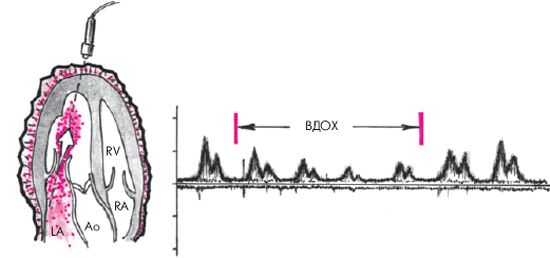
Отличительной особенностью экссудативного перикардита, осложненного тампонадой сердца, является парадоксальный пульс. Этот феномен заключается в значительном (более 10–12 мм рт. ст.) снижении систолического АД во время вдоха (рис. 12.11). Возникновение этого важного диагностического признака объясняют следующим образом. При тампонаде сердца, которая закономерно сопровождается уменьшением размеров его камер, ПП и ПЖ очень чутко реагируют на фазы дыхания. Как известно, во время вдоха за счет возникновения отрицательного давления в плевральной полости происходит увеличение венозного возврата крови к правым отделам сердца; их кровенаполнение несколько возрастает, что приводит к неизбежному увеличению диастолических размеров этих камер сердца. Во время выдоха, наоборот, приток крови к правым отделам сердца уменьшается и давление в них быстро падает до уровня давления в полости перикарда и даже ниже него. В результате ПЖ и ПП во время выдоха спадаются (коллабируют).
|
|
|
Рис. 12.11. Парадоксальный пульс, зарегистрированный у больного с тампонадой сердца. Сверху вниз: ЭКГ, кривая давления в аорте, пневмограмма. На вдохе — выраженное падение систолического АД |
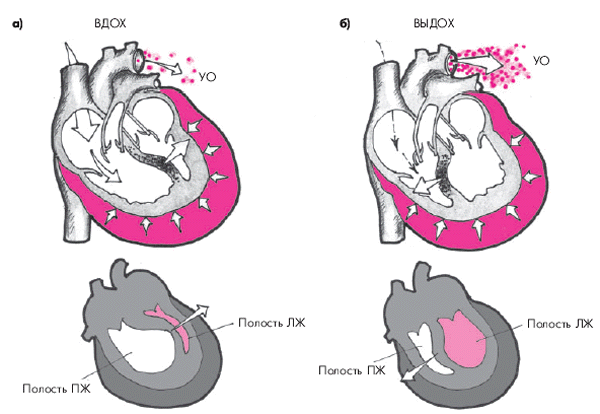
Поскольку увеличение объемов правых отделов сердца на вдохе лимитируется большим количеством экссудата в полости перикарда, находящегося под высоким давлением, увеличение объема ПЖ осуществляется за счет парадоксального движения МЖП в сторону ЛЖ, объем которого в результате этого резко уменьшается (рис. 12.12, а). Наоборот, во время выдоха происходит коллабирование ПЖ; МЖП смещается в сторону ПЖ, что сопровождается увеличением размеров ЛЖ (рис. 12.12, б).
|
|
|
Рис. 12.12. Схема, поясняющая механизм возникновения парадоксального пульса у пациентов с тампонадой сердца: а — во время вдоха происходит увеличение притока крови к правому сердцу, смещение МЖП в сторону ЛЖ и ограничение его объема; б — во время выдоха — коллабирование ПЖ и ПП и смещение МЖП в сторону ПЖ |
Таким образом, при уменьшении объема ПЖ (на выдохе) ЛЖ увеличивается, а при увеличении ПЖ (на вдохе) ЛЖ уменьшается в размерах. Это и является основной причиной колебаний величины УО в зависимости от фаз дыхания, а также соответствующих изменений величины систолического АД и скорости изгнания крови из ЛЖ, которая оценивается при допплеровском исследовании потоков крови (см. ниже).
Следует помнить, что парадоксальный пульс не является патогномоничным признаком тампонады сердца. Этот феномен встречается также при хронических обструктивных заболеваниях легких, ТЭЛА, инфаркте миокарда ПЖ и (реже) при констриктивном перикардите и рестриктивной кардиомиопатии.
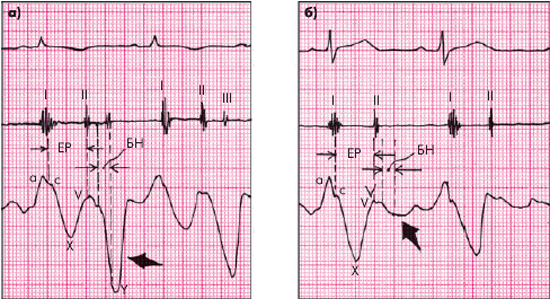
Вторым важным отличительным признаком тампонады сердца является выраженное набухание югулярных вен и значительное уменьшение их пульсации, вызванные увеличением ЦВД и высоким внутриперикардиальным давлением, которое препятствует наполнению правых отделов сердца и, соответственно, опорожнению полых вен. Этот феномен лучше определяется при регистрации кривой давления в ПП или югулярной флебограммы в виде отсутствия так называемого Y-спада флебограммы (подробнее см. ниже).
Добавим, что при аускультации сердца выявляется ослабление I и II тонов. Несмотря на выраженное нарушение диастолического наполнения желудочков, дополнительные тоны, в том числе перикард-тон, у больных с тампонадой сердца, как правило, не выявляются.
|
Наиболее важными клиническими признаками, указывающими на возможное наличие тампонады сердца, у больных с экссудативным перикардитом являются: 1. Жалобы больных, обусловленные низким сердечным выбросом: слабость, невозможность выполнения физической нагрузки, стойкая тахикардия, нарастание одышки, головокружение и др. 2. Данные осмотра: характерное вынужденное положение тела, бледность кожных покровов, асцит, гепатомегалия, периферические отеки. 3. Парадоксальный пульс — снижение систолического АД на вдохе более чем на10–12 мм рт. ст. 4. Выраженное набухание шейных вен и уменьшение их пульсации. |
Электрокардиограмма
На ЭКГ, зарегистрированной у больного с тампонадой сердца, выявляются признаки, свойственные больным с экссудативным перикардитом:
-
низкий вольтаж ЭКГ;
-
относительно кратковременный подъем сегмента RS–Т в нескольких отведениях;
-
неспецифические изменения зубца Т (сглаженность, инверсия).
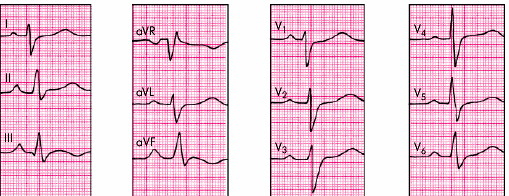
В некоторых случаях при наличии тампонады сердца можно обнаружить феномен электрической альтернации (изменения амплитуды) комплекса QRS за счет смещения сердца, как бы “плавающего” внутри воспалительной жидкости (рис. 12.13). Следует помнить, что альтернация комплекса QRS, кроме тампонады сердца, может встречаться при напряженном пневмотораксе, ДКМП, констриктивном перикардите и у больных ИБС, перенесших ИМ. Более специфичным для тампонады сердца является полная электрическая альтернация — изменения амплитуды зубца Р, комплекса QRS и зубца Т.
|
|
|
Рис. 12.13. Феномен электрической альтернации, зарегистрированный у больного с выпотным перикардитом и тампонадой сердца |
Эхокардиографическое исследование
Эхокардиографическое исследование обычно позволяет диагностировать не только наличие экссудата в полости перикарда, но и выявить некоторые ранние признаки формирующейся тампонады сердца. Важно, что эти изменения могут быть обнаружены до появления клинических признаков гемодинамических нарушений.
1. Уменьшение коллабирования на вдохе нижней полой вены. Как было показано выше, в норме во время вдоха за счет отрицательного давления в плевральной полости происходит увеличение венозного притока крови к правому сердцу. В результате нижняя полая вена на вдохе спадается, причем глубокий вдох сопровождается уменьшением диаметра нижней полой вены более чем на 50% от исходных значений. При развитии тампонады сердца степень коллабирования нижней полой вены после глубокого вдоха уменьшается (меньше 50%).
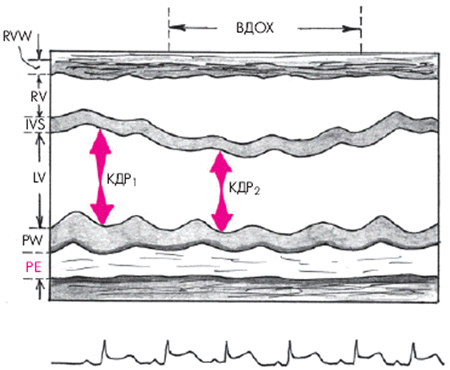
2. Размеры полости ПЖ и ЛЖ обычно уменьшены. Наиболее важный признак, соответствующий феномену парадоксального пульса, — это изменение объемов полостей желудочков в зависимости от фаз дыхания: на вдохе увеличиваются размеры ПЖ и уменьшаются размеры ЛЖ, а на выдохе увеличиваются размеры ЛЖ и уменьшаются размеры ПЖ. Эти изменения, как правило, сопровождаются парадоксальными движениями МЖП: на вдохе она смещается в сторону ЛЖ, а на выдохе — в сторону ПЖ (рис. 12.14).
|
Рис. 12.14. Одномерная ЭхоКГ, демонстрирующая патологическое смещение во время вдоха МЖП в сторону ЛЖ и уменьшение объема ЛЖ, что является главной причиной возникновения парадоксального пульса у больных с тампонадой сердца |
|
3. Во время выдоха может наблюдаться диастолический коллапс ПЖ, когда его свободная стенка соприкасается с МЖП. Это указывает на то, что давление в полости перикарда начинает превышать диастолическое давление в ПЖ.
4. При допплеровском исследовании можно обнаружить значительное повышение давления в ПЖ, ПП, а также давления наполнения ПЖ, которое иногда становится равным давлению наполнения ЛЖ.
5. При допплеровском исследовании можно выявить также колебания значений скорости потока крови в выносящем тракте ЛЖ и трансмитрального диастолического потока крови: она увеличивается во время выдоха и уменьшается во время вдоха (рис. 12.15). Эти признаки соответствуют выявляемому клинически у больных с подострой тампонадой сердца феномену парадоксального пульса и дыхательным колебаниям систолического АД.
6. Наконец, у больных с тампонадой сердца, так же как у всех пациентов с выпотным перикардитом, выявляются расхождение листков перикарда и наличие жидкости в полости перикарда.
|
|
|
Рис. 12.15. Изменение во время дыхания амплитуды допплеровского сигнала трансмитрального диастолического потока крови у больного с выпотным перикардитом и тампонадой сердца |
Рентгенологическое исследование
При значительном выпоте в полости перикарда размеры тени сердца увеличены, а контуры сглажены. Тень сердца располагается срединно. При рентгеноскопии можно заметить резкое снижение амплитуды пульсации контуров сердца или пульсация не определяется совсем. В то же время пульсация аорты и ствола легочной артерии сохранена. При накоплении в полости перикарда сравнительно небольшого количества экссудата (менее 200–300 мл) рентгенологическая картина может оказаться практически нормальной. При рентгенологическом исследовании у больных с тампонадой сердца обращает на себя внимание также нормальный легочный рисунок и отсутствие признаков застоя крови в легких.
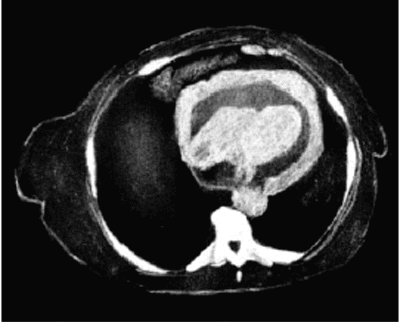
Высокой информативностью обладает метод компьютерной рентгеновской томографии. На рис. 12.16 представлена компьютерная томограмма, зарегистрированная у больного с перикардиальным выпотом, осложненным тампонадой сердца.
|
|
|
Рис. 12.16. Компьютерная томограмма больного с перикардиальным выпотом, осложненным тампонадой сердца |
Югулярная флебограмма
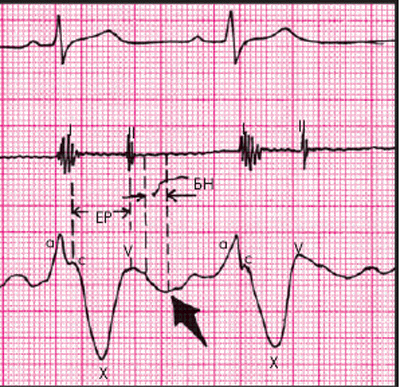
Главной особенностью югулярной флебограммы, зарегистрированной у больных с тампонадой сердца, является слабо выраженная или отсутствующая волна Y, которая соответствует по времени фазе быстрого наполнения ПЖ (рис. 12.17). Это говорит о том, что диастолическое наполнение ПЖ и, соответственно, опорожнение ПП и югулярных вен резко нарушены из-за высокого давления в полости перикарда. На флебограмме фиксируется только отрицательная волна Х, соответствующая систоле ПЖ.
|
|
|
Рис. 12.17. Югулярная флебограмма, зарегистрированная у больного с тампонадой сердца. Сохраняется Х-коллапс, возникающий во время периода изгнания крови (ЕР), тогда как волна Y, соответствующая фазе быстрого наполнения желудочка (БН), сглажена (обозначено стрелкой) |
Катетеризация полостей сердца
При катетеризации полостей сердца обнаруживают значительное повышение среднего давления в ПП, которое на 2–3 мм рт. ст. превышает давление в полости перикарда. Именно этот градиент давления обеспечивает в условиях развившейся тампонады сердца медленное диастолическое наполнение ПЖ. Часто давление в ПП повышается настолько, что становится почти равным ДЗЛА, диастолическому давлению в легочной артерии и ПЖ. Такое “выравнивание давлений” — один из характерных, хотя и неспецифических, признаков тампонады сердца. Так же как и на югулярной флебограмме, на кривой давления в ПП определяются пологий или отсутствующий Y-спад и крутой Х-спад.
Феномен парадоксального пульса выявляется на кривой давления в ЛЖ.
Пункция полости перикарда
Пункция полости перикарда у больных экссудативным перикардитом, в том числе осложненным тампонадой сердца, проводится с диагностической и лечебной целями. Основными показаниями к проведению пункции являются:
нарастающие симптомы тампонады сердца (обычно пункция проводится экстренно, по жизненным показаниям, с целью эвакуации жидкости и уменьшения сдавления сердца);
подозрение на гнойный экссудативный перикардит;
отсутствие тенденции к рассасыванию экссудата (затяжное течение выпотного перикардита);
уточнение природы выпотного перикардита.
Пункция перикарда противопоказана при значительных нарушениях в системе гемостаза и геморрагическом синдроме.
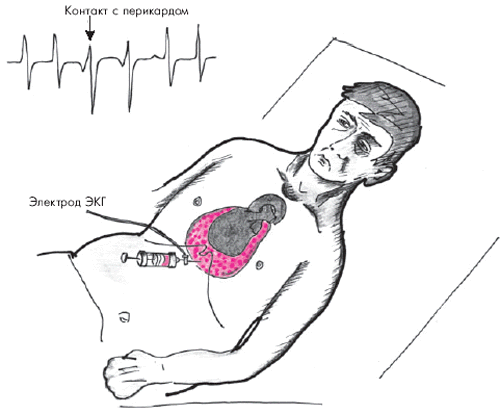
Техника пункции
Существует несколько способов пункции перикарда. Наиболее распространенной и безопасной считается методика Марфана. Пункцию осуществляют в положении больного лежа на спине с приподнятым на 30° головным концом кровати. Такое положение обеспечивает скопление выпота в нижней части полости перикарда (рис. 12.18). Пункцию делают под местной анестезией (например, 1% раствор лидокаина) в надчревной области, примерно на 0,5 см левее мечевидного отростка. Для пункции чаще используют длинную иглу, присоединенную к шприцу. К игле зажимом присоединяют проводник, соединенный с электродом грудного отведения ЭКГ.
Иглу вводят под углом 45° к поверхности грудной клетки по направлению к левому плечевому суставу до соприкосновения ее с париетальным листком перикарда. Об этом свидетельствует появление на ЭКГ негативных комплексов QRS (см. рис. 12.18, вверху). Иглу продвигают еще на 2–3 см в полость перикарда. Если на ЭКГ внезапно регистрируется подъем сегмента RS–Т, это указывает на контакт иглы с миокардом. В этом случае иглу следует потянуть назад, в полость перикарда. Подъем сегмента RS–Т при этом исчезает.
|
|
|
Рис. 12.18. Пункция полости перикарда (схема) |
Потягивая поршень шприца на себя, удаляют содержимое полости перикарда. В полость вводят раствор фурациллина или антибиотиков и иглу удаляют. Иногда в полости перикарда оставляют мягкий тефлоновый катетер, с помощью которого осуществляют постоянное дренирование полости, повторные промывания и введение лекарственных средств. Катетер должен быть удален не позже чем через 48–72 ч после его постановки.
Описанная методика пункции полости перикарда достаточно безопасна и редко приводит к развитию осложнений, к числу которых относятся:
-
прокол миокарда;
-
гемоторакс или пневмоторакс;
-
воздушная эмболия;
-
нарушения сердечного ритма;
-
инфекция.
Исследование перикардиальной жидкости
Диагностическая пункция позволяет провести:
-
оценку физико-химических свойств перикардиального выпота;
-
цитологическое исследование клеточного состава выпота;
-
бактериологическое исследование;
-
иммунологические тесты.
Изучение физических свойств полученной жидкости позволяет, прежде всего, дифференцировать экссудат от накопления в полости перикарда жидкости невоспалительного генеза (транссудата). Такое скопление в полости перикарда транссудата, получившее название “гидроперикард”, встречается при целом ряде патологических состояний:
-
сердечной недостаточности (правожелудочковой или бивентрикулярной);
-
заболеваниях, сопровождающихся гипоальбуминемией и снижением онкотического давления плазмы;
-
заболеваниях, при которых имеются выраженные нарушения сосудистой проницаемости;
-
кахексии;
-
гипотиреозе;
-
марантических отеках.
Транссудат при гидроперикарде прозрачен, содержание белка в нем не превышает 30 г/л, плотность ниже 1,018, проба Ривальта отрицательная.
Воспалительный экссудат отличается более высоким содержанием белка (более 30 г/л), более высокой удельной плотностью (больше 1,018) и положительной пробой Ривальта. Важное диагностическое значение имеет характер экссудата (серозный, фибринозный, гнойный, геморрагический), который нередко можно оценить макроскопически.
Цитологическое и бактериологическое исследование полученной жидкости проводят с целью уточнения природы выпотного перикардита. Так, преобладание в пунктате нейтрофилов характерно для гнойных экссудатов, возбудителями которых являются стрептококки, пневмококки, грамотрицательные бактерии и др., а высокое содержание лимфоцитов характерно, например, для туберкулезных перикардитов.
При подозрении на заболевания соединительной ткани жидкость исследуют на наличие антинуклеарных антител и LЕ–клеток.
|
12.3.4. Констриктивный перикардит |
|
|
Констриктивный (сдавливающий) перикардит (от лат. сonstrictio — сдавление) характеризуется утолщением листков перикарда, облитерацией его полости, нередко кальцификацией перикарда, что приводит к сдавлению сердца и нарушению диастолического наполнения камер сердца.
Наиболее частыми причинами развития констриктивного перикардита являются (Е. Braunwald):
-
туберкулезый перикардит;
-
гнойный перикардит;
-
перикардит при ревматических болезнях (ревматизм, ревматоидный артрит, системная красная волчанка и др.);
-
посттравматический перикардит;
-
послеоперационный перикардит (после операций на сердце);
-
перикардит вследствие лечебного радиационного облучения средостения;
-
перикардит, развивающийся на фоне гистоплазмоза;
-
опухолевый перикардит;
-
острый вирусный (идиопатический) перикардит;
-
перикардит при уремии, леченной гемодиализом и др.
Туберкулез как причина констриктивного перикардита встречается, вероятно, более чем у 1/2 больных, ревматическое поражение сердечной сорочки — в 15–20% случаев, травма сердца (в том числе послеоперационная) — в 10% и стрептококковая инфекция — еще в 5–10% (Р.Ш. Саитгареев, 2002). В последние годы большую роль в возникновении констриктивного перикардита отводят вирусному, или идиопатическому поражению перикарда.
Таким образом, констриктивный (сдавливающий) перикардит в большинстве случаев — это возможный неблагоприятный исход любого острого экссудативного перикардита (серозного, серозно-фибринозного, гнойного и т.д.). Как известно, в большинстве случаев процесс заживления экссудативного перикардита заканчивается практически полным рассасыванием воспалительного выпота. Иногда в силу разных причин этого не происходит и начинается организация выпота с образованием фиброзных перикардиальных спаек (сращений) между утолщенными листками перикарда (адгезивный, или слипчивый перикардит), а в дальнейщем — с постепенной частичной или полной облитерацией полости перикарда (констриктивный, или сдавливающий перикардит) (см. рис. 12.1). В результате образуется плотный рубец, который окружает сердце со всех сторон, сдавливает его и ограничивает диастолическое наполнение камер сердца. При длительном хроническом течении констриктивного перикардита возникает выраженная кальцификация перикарда. В этих случаях сердце окружено еще более жестким известковым панцирем, образуется так называемое “панцирное сердце”. Процесс рубцевания и кальцификации может захватывать субэпикардиальные слои миокарда, в том числе в области локализации КА, диафрагмальной поверхности сердца и атриовентрикулярной борозды.
Следует помнить, что констриктивный перикардит может явиться следствием не только выпотного (экссудативного) перикардита, но и фибринозного воспаления сердечной сорочки, т.е. сухого перикардита, хотя это происходит достаточно редко.
Особенности изменений гемодинамики
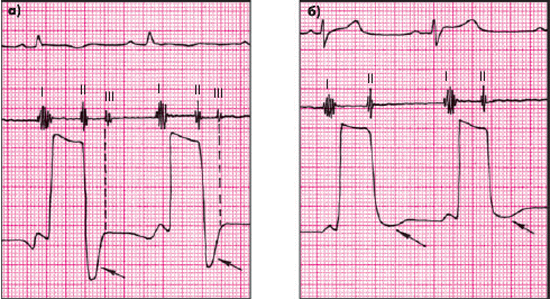
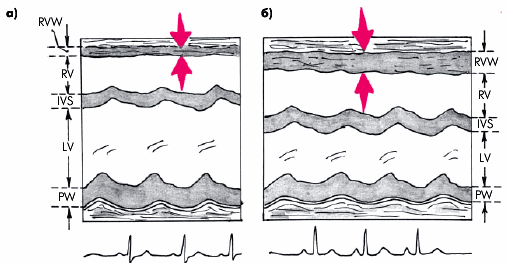
Основной причиной тяжелых гемодинамических расстройств у больных констриктивным перикардитом является выраженное нарушение диастолического наполнения обоих желудочков, обусловленное наличием преграды, создаваемой на пути диастолического потока крови ригидным перикардом. В отличие от тампонады сердца при констриктивном перикардите наполнение желудочков происходит в очень короткий промежуток времени, сразу после открытия атриовентрикулярных клапанов, что на югулярной флебограмме или кривой давления в ПП (рис. 12.19) проявляется крутым Y-спадом (“Y-коллапсом”), свидетельствующим о быстром опорожнении ПП. Как только объем желудочка достигает своего предела, обусловленного ригидным перикардом, наполнение желудочков внезапно прекращается. Таким образом, при констриктивном перикардите желудочки наполняются кровью в течение очень короткого времени — в период ранней диастолы; все остальное время такого наполнения не происходит. В силу этого кривая внутрижелудочкового давления при констриктивном перикардите (рис. 12.20, а) приобретает своеобразный вид, напоминающий символ, обозначающий “квадратный корень”: быстрое наполнение желудочка, характеризующееся скачкообразным подъемом давления в нем, сменяется горизонтальной “изолинией” (“диастолическое заполнение и плато”).
Напомним, что при тампонаде сердца, обусловленной скоплением экссудата в полости перикарда, наполнение ПЖ также затруднено, но продолжается в течение всей диастолы (замедленно), в связи с чем на кривой давления в ПП отсутствует “Y-коллапс” (рис. 12.19, б), а на кривой внутрижелудочкового давления определяется пологий замедленный подъем давления в желудочке (рис. 12.20, б). Эти принципиальные отличия имеют значение в формировании некоторых особенностей клинической картины заболевания.
|
|
|
Рис. 12.19. Югулярная флебограмма, зарегистрированная у больного констриктивным перикардитом (а) и пациента с тампонадой сердца, осложнившей экссудативный перикардит (б) |
|
|
|
Рис. 12.20. Кривая давления в ЛЖ, зарегистрированная у больного констриктивным перикардитом (а) и пациента с тампонадой сердца, осложнившей экссудативный перикардит (б). Объяснение в тексте |
Нарушение диастолического наполнения камер сердца приводит к трем основным гемодинамическим следствиям:
1. Уменьшению ударного объема сердца, сопровождающемуся снижением АД и нарушением перфузии периферических органов и тканей. Характерно, что функция миокарда при этом долгое время остается нормальной. 2. Повышению диастолического давления в обоих желудочках, среднего давления в предсердиях и давления в венах большого круга кровообращения. Иными словами, речь идет о выраженном застое крови в большом круге кровообращения. Важнейшими особенностями такого застоя крови являются:
-
преобладание симптомов надпеченочной портальной гипертензии (асцит, гепатомегалия, спленомегалия и др.), что связывают с сужением печеночных вен перикардиальными сращениями;
-
умеренно выраженные периферические отеки;
-
отсутствие или слабая выраженность застоя в малом круге кровообращения, несмотря на высокое давление в ЛП и КДД ЛЖ. Это объясняется уменьшением ударного выброса ПЖ и, соответственно, развивающейся гиповолемией малого круга кровообращения.
3. Наличию малых или нормальных размеров желудочков сердца (“малое сердце”).
|
Констриктивный перикардит характеризуется следующими особенностями гемодинамики: 1. Нарушением диастолического наполнения обоих желудочков, сопровождающимся повышением КДД в желудочках и среднего давления в предсердиях, а также сохранением нормальной сократимости желудочков. 2. Повышением венозного давления и застоем крови в большом круге кровообращения, преимущественно в системе воротной вены (надпеченочная портальная гипертензия). 3. Отсутствием венозного застоя крови в легких. 4. Уменьшением ударного объема и тенденцией к снижению АД и перфузии периферических органов и тканей. 5. Малыми или нормальными размерами желудочков сердца. |
Жалобы
Клинические проявления констриктивного перикардита связаны с перечисленными выше гемодинамическими нарушениями. В типичных случаях характерно наличие так называемой “триады Бека”:
-
высокого венозного давления;
-
асцита;
-
“малого тихого сердца”.
Скорость формирования развернутой клинической картины констриктивного перикардита колеблется от 1 месяца до нескольких лет с момента возникновения выпотного перикардита.
У больных констриктивным перикардитом довольно рано появляются симптомы, связанные с низким сердечным выбросом: слабость, быстрая утомляемость, сердцебиения (тахикардия) и т.п. Вначале эти симптомы появляются только во время физической нагрузки, а затем и в покое.
К этим симптомам вскоре присоединяется одышка, возникающая, как правило, при физической нагрузке. В покое ощущение нехватки воздуха выражено слабо. Как было сказано выше, причиной возникновения одышки являются не столько застойные явления в легких, которые в целом не характерны для констриктивного перикардита, сколько снижение объема крови, поступающей в легочную артерию, что приводит к изменению перфузионно-вентиляционных соотношений в легких и нарушению газового состава крови. По понятным причинам эти явления усугубляются на фоне физической нагрузки, что связано, главным образом, с развивающейся тахикардией, выраженным укорочением диастолы и критическим уменьшением диастолического наполнения желудочков и сердечного выброса.
Характерно, что в отличие от сердечной недостаточности, одышка при констриктивном перикардите, как правило, не нарастает в горизонтальном положении больного, т.е. отсутствуют признаки ортопноэ. Важно отметить, что приступы сердечной астмы и отек легких практически не встречаются при констриктивном перикардите.
Повышение венозного давления и связанный с этим застой крови в венозном русле большого круга кровообращения сопровождаются жалобами на увеличение живота в объеме (асцит), чувство тяжести в правом подреберье (гепатомегалия). Позже появляются отеки на ногах. Диспепсические явления (анорексия и др.), а также снижение массы тела объясняются, прежде всего, нарушением функции печени.
Осмотр и исследование органов брюшной полости и легких
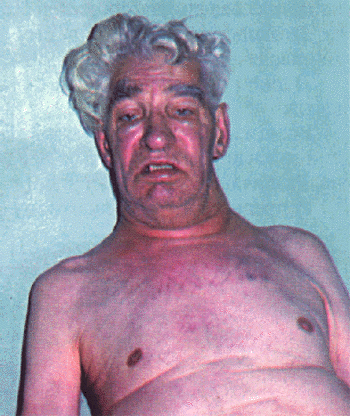
В далеко зашедших случаях заболевания обращают на себя внимание выраженное похудание больного и цианоз. При значительном сдавлении устья верхней полой вены лицо становится одутловатым, шея выглядит утолщенной, отечной, кожа лица и шеи приобретает выраженную цианотическую окраску, вены шеи набухшие. Отек и цианоз распространяются на голову и плечи (рис. 12.21, см. цветную вклейку). Такой симптомокомплекс, получивший название “воротник Стокса”, свидетельствует о существенном нарушении кровотока по верхней полой вене и встречается не только при констриктивном перикардите, но и при других заболеваниях, сопровождающихся сдавлением вены, например, при раке легкого или опухоли средостения и т.п.
|
|
|
Рис. 12.21. Внешний вид больного с механическим препятствием кровотоку в верхней полой вене ("воротник Стокса") |
Несмотря на одышку, усиливающуюся при физической нагрузке, больные обычно занимают горизонтальное положение в постели, лежат низко, без подголовника, хотя при этом резко усиливаются цианоз и одутловатость лица. Это отличает больных с констриктивным перикардитом от пациентов с бивентрикулярной недостаточностью, которые, как известно, стремятся занять вертикальное положение (ортопноэ).
Самый характерный и постоянный внешний признак констриктивного перикардита, выявляемый при объективном исследовании, — это выраженный асцит и гепатомегалия, являющиеся следствием надпеченочной портальной гипертензии. Последняя развивается не только в результате повышения ЦВД, но и вследствие сдавления печеночных вен у места их прохождения через париетальный листок сердечной сумки. Печень увеличена значительно, особенно ее левая доля. Печень плотная, болезненная при пальпации. К другим проявлениям портальной гипертензии относятся развитие венозных коллатералей (портокавальных анастомозов) на передней брюшной стенке и спленомегалия.
Следует подчеркнуть, что асцит и выраженная гепатомегалия обычно предшествуют появлению отеков на ногах, что также является очень характерным признаком констриктивного перикардита. Часто именно эти два симптома (асцит и гепатомегалия) преобладают в клинической картине заболевания, напоминая клинические проявления цирроза печени (“псевдоцирроз” Пика).
Так же как и при тампонаде сердца, несмотря на значительные гемодинамические нарушения и наличие одышки, признаков застойных явлений в легких у больных констриктивным перикардитом выявить, как правило, не удается.
Исследование сердца и сосудов
Важными признаками констриктивного перикардита являются расширение и набухание шейных вен, сохраняющиеся даже после интенсивной терапии диуретиками. При этом, в отличие от случаев тампонады сердца, хорошо заметна пульсация вен, в частности, их диастолический коллапс (симптом Фридрейха), что отражает характерную для констриктивного перикардита форму кривой давления в ПП и югулярных венах, в частности, очень крутую и глубокую волну Y (“Y–коллапс”), механизм возникновения которой был описан выше (см. рис. 12.19).
Констриктивный перикардит, пожалуй, единственное заболевание, при котором ЦВД достигает столь высоких значений (200–300 см. вод. ст.). Причем венозное давление и, соответственно, набухание шейных вен заметно увеличиваются на вдохе (симптом Куссмауля). Известно, что во время вдоха развивается отрицательное внутриплевральное давление, что приводит к увеличению притока крови к правому сердцу. В норме это сопровождается некоторым спадением вен, поскольку кровь более интенсивно заполняет ПП и ПЖ, обладающие нормальной сократимостью и диастолическим тонусом. При констриктивном перикардите объем диастолического наполнения строго лимитирован перикардиальным рубцом, окружающим сердце. Поэтому усиление венозного притока крови к крупным венам не сопровождается более активным расслаблением камер сердца, и венозное давление еще больше возрастает на вдохе.
При пальпации сердца верхушечный толчок, как правило, обнаружить не удается, отсутствует и эпигастральная пульсация. При глубоком вдохе иногда может определяться необычное систолическое западение или втяжение нижней части грудины и межреберных промежутков. Этот феномен указывает на наличие спаек между наружным листком перикарда и передней стенкой грудной клетки и диафрагмой.
Границы сердца в большинстве случаев не расширены. Интересно, что при перемене положения тела (например, при повороте больного на левый бок), границы сердца не смещаются, поскольку неподвижный рубцовый панцирь, в который заключено сердце, фиксирован к средостению.
При аускультации I и II тоны глухие. Часто определяется трехчленный ритм (ритм галопа), образованный дополнительным патологическим III тоном, который определяется в самом начале диастолы (см. рис. 12.19, а и 12.20, а). Это так называемый “перикард-тон” или “тон броска”. Он возникает в результате внезапной остановки диастолического потока крови из предсердий в желудочки, обусловленной наличием рубцово измененного и ригидного перикарда. Перикард-тон обычно отличается большой интенсивностью.
Систолическое и пульсовое АД обычно понижены. В отличие от тампонады сердца, парадоксальный пульс при констриктивном перикардите встречается достаточно редко (не более чем в 20–25% случаев).
Электрокардиограмма
На ЭКГ в типичных случаях выявляется триада признаков:
-
низкий вольтаж комплекса QRS;
-
отрицательные и двухфазные зубцы Т во всех стандартных и грудных отведениях;
-
расширенный высокий зубец Р или фибрилляция предсердий.
Мерцательная аритмия встречается у 1/3 больных констриктивным перикардитом. Если имеется вовлечение в патологический процесс миокарда желудочков или АВ-борозды, на ЭКГ могут появляться признаки внутрижелудочковых или атриовентрикулярных блокад.
Рентгенологическое исследование
При рентгенологическом исследовании обычно обнаруживается ряд важных диагностических признаков:
-
относительно маленькое или нормальное сердце (точнее, желудочки) при одновременном увеличении размеров предсердий;
-
отсутствие “талии” сердца и дифференциации дуг в связи с характерным выпрямлением контуров сердца;
-
неровность контуров сердца в связи с наличием многочисленных сращений перикарда;
-
обызвествление перикарда, обнаруживаемое примерно у 1/3 больных констриктивным перикардитом.
Катетеризация
На кривой давления в ПП определяются отрицательная Х-волна и особенно глубокая и крутая отрицательная Y–волна (“Y–коллапс”), отражающая быстрое, но кратковременное движение крови из предсердий в желудочки в самую раннюю фазу диастолы. Одновременно на кривой давления в желудочке определяется феномен “диастолического заполнения и плато”, т.е. кривая давления имеет вид квадратного корня (см. рис. 12.20, а).
Важным признаком является повышение давления в ПП и выравнивание диастолического давления в ПП, ПЖ, легочной артерии, а также давления заклинивания легочной артерии (ДЗЛА). Обычно разница между величинами диастолического давления в этих камерах сердца не превышает 5 мм рт. ст. Характерно, что при констриктивном перикардите среднее давление в ПП не снижается на вдохе.
При изучении систолической функции ЛЖ обращает на себя внимание снижение величины УО при сохраненной ФВ. Сердечный выброс (МО) обычно нормальный за счет высокой частоты сердечных сокращений (ЧСС).
Югулярная флебограмма
В отличие от больных с тампонадой сердца, при констриктивном перикардите на югулярной флебограмме выявляется глубокая отрицательная Y–волна (“Y–коллапс”), отражающая быстрое, но кратковременное наполнение ПЖ во время фазы быстрого наполнения желудочка (см. рис. 12.19, а), механизм которого описан выше.
Эхокардиографическое исследование
Эхокардиографическое исследование позволяет не только выявить морфологические изменения перикарда, характерные для констриктивного перикардита, но и количественно оценить гемодинамические изменения, обусловленные сдавлением сердца. В типичных случаях у больных констриктивным перикардитом при эхокардиографическом исследовании выявляются следующие признаки:
1. Утолщение, значительное уплотнение и сращение листков перикарда. Эхонегативное пространство между листками заполнено негомогенной слоистой массой, менее эхоплотной, чем сам перикард. Эта слоистая масса как бы склеивает оба листка перикарда (адгезия), поэтому во время сердечного цикла наблюдается одинаковое параллельное переднезаднее движение листков перикарда и эпикарда.
2. Отсутствие движения миокарда ЛЖ после короткого раннего диастолического наполнения. Этот признак соответствует глубокой Y–волне на югулярной флебограмме или кривой давления в ПП.
3. Нормальные или уменьшенные размеры желудочков и умеренная дилатация предсердий.
4. Недостаточное коллабирование нижней полой вены (менее 50%) после глубокого вдоха, свидетельствующее о высоком венозном давлении.
|
12.4. Лечение перикардитов |
|
|
Выбор наиболее адекватного способа лечения острого перикардита зависит от клинико-морфологической формы заболевания и его этиологии.
Острый сухой (фибринозный) перикардит
Впервые выявленный острый перикардит требует госпитализации больного и ограничения физической активности. Необходимо регулярно контролировать уровни артериального и венозного давлений и ЧСС. Показаны также повторные эхокардиографические исследования с целью своевременной диагностики формирования выпота в полости перикарда.
В большинстве случаев ограничиваются назначением нестероидных противовоспалительных лекарственных средств (НПВС):
-
диклофенак (вольтарен) — 100–200 мг в сутки;
-
индометацин — 25–50 мг каждые 6–8 ч;
-
ибупрофен — 400–800 мг;
-
мовалис — 7,5–15 мг 2 раза в сутки.
Глюкокортикоиды целесообразно назначать только в следующих клинических ситуациях:
-
при интенсивном болевом синдроме, не поддающемся лечению НПВС;
-
при тяжелом течении диффузных заболеваний соединительной ткани (системная красная волчанка, ревматоидный артрит, полимиозит и др.), осложненных острым перикардитом;
-
при аллергическом лекарственном перикардите;
-
при аутоиммунных острых перикардитах.
Суточные дозы и длительность приема глюкокортикоидов подбираются в зависимости от этиологии и характера перикардита и основного заболевания. При интенсивном болевом синдроме, например, глюкокортикоиды назначают в суточной дозе 40–60 мг в течение 5–7 дней с последующим снижением дозы и отменой препарата (подробнее о тактике лечения глюкокортикоидами — см. последующие главы руководства).
При вирусном (идиопатическом) перикардите рекомендуют воздерживаться от применения глюкокортикоидов (M. Freed, J.D. Band).
Антибиотики при сухом (фибринозном) перикардите назначают только в тех случаях, когда воспаление сердечной сорочки возникает на фоне явной бактериальной инфекции — сепсиса, инфекционного эндокардита, пневмонии, наличия гнойного очага и т.д. В зависимости от установленного или предполагаемого возбудителя этих патологических процессов назначают антибиотики пенициллинового ряда (оксациллин, ампициллин, аугментин и др.), цефалоспорины, современные макролиды (сумамед и др.), фторхинолоновые производные (ципрофлоксацин, офлоксацин и др.). Основные принципы и тактика лечения антибиотиками подробно изложены в последующих главах руководства.
При туберкулезном перикардите назначают комбинированную противотуберкулезную терапию, например, изониазид, рифампицин, пиразинамид и другие в сочетании с глюкокортикоидами. В этих случаях специфическое лечение назначается и проводится под контролем фтизиатра.
В остальных случаях от применения антибиотиков следует воздержаться в связи с возможными побочными, в том числе аллергическими, реакциями, способными только осложнить течение перикардита.
Острый экссудативный перикардит без тампонады сердца
Тактика лечения острых выпотных перикардитов без сдавления сердца в основном та же, что и сухих перикардитов различного генеза. При этом требуется особенно строгий и регулярный контроль (в том числе и эхокардиографический) за основными гемодинамическими показателями (АД, ЦВД, ЧСС, УИ, СИ, и т.д.), объемом экссудата и признаками, указывающими на развитие тампонады сердца.
Лечение включает обычно назначение постельного режима и НПВС. Антибиотики используют, как правило, при экссудативных перикардитах, развившихся на фоне бактериальной инфекции или при гнойных перикардитах.
Возможно также назначение глюкокортикоидов, в большинстве случаев способствующих более быстрому рассасыванию выпота, особенно в случаях аллергических, аутоиммунных перикардитов и перикардитов, развившихся на фоне диффузных заболеваний соединительной ткани.
При установленном или предполагаемом гнойном перикардите, помимо парентерального введения антибиотиков, показана пункция перикарда (см. выше), максимальное удаление гнойного экссудата, промывание полости перикарда раствором фурациллина или антибиотиков и повторное введение антибиотиков через катетер.
Пункция перикарда показана также при затягивающемся рассасывании экссудата (более двух недель лечения) и необходимости уточнения его природы и характера (например, для выявления специфической туберкулезной, грибковой, опухолевой и другой этиологии заболевания). В этих случаях результаты пункции помогают выбрать более адекватную тактику ведения больных.
Тампонада сердца
Тампонада сердца, развившаяся в результате выпотного перикардита, как правило, требует проведения неотложного перикардиоцентеза. Предварительно для стабилизации гемодинамики внутривенно капельно вводят 300–500 мл плазмы, коллоидных растворов или 0,9% раствора натрия хлорида, а также инотропные средства (дигоксин, добутамин). Это позволяет восстановить уровень системного АД и ударный объем и подготовить больного к проведению перикардиоцентеза.
Констриктивный перикардит
Единственным радикальным способом лечения констриктивного перикардита является субтотальная перикардэктомия — резекция перикарда. При этом сердце освобождается от сдавливающей капсулы, вначале в области левого, а затем — правого желудочка. Обратная последовательность приводит, как правило, к развитию отека легких.
Во время подготовки к операции назначают диуретики, ограничивают потребление соли, обеспечивают соблюдение постельного режима. С осторожностью назначают сердечные гликозиды, которые уменьшают риск развития сердечной недостаточности после проведения операции, следствием которой является значительное и внезапное увеличение преднагрузки на правый и левый желудочки.
В большинстве случаев (около 90%) в течение 3–4 месяцев после операции наступает улучшение состояния больных, хотя операционная летальность достигает 10%. После операции необходимо тщательное наблюдение за больным, перенесшим операцию перикардэктомии, и при необходимости — лечение диуретиками, ингибиторами АПФ и, с осторожностью, сердечными гликозидами. При туберкулезном или гнойном констриктивном перикардите после операции показано длительное лечение антибиотиками или противотуберкулезными препаратами.
|
1. Основные принципы лечения больных с острым (сухим или экссудативным) перикардитом формулируются следующим образом:
госпитализация и динамическое наблюдение (АД, ЦВД, ЧСС, эхокардиографический контроль за гемодинамическими показателями);
ограничение физической активности, постельный режим;
назначение НПВС;
назначение глюкокортикоидов преимущественно при интенсивном болевом синдроме (сухой перикардит), аллергических и аутоиммунных перикардитах, а также перикардитах, развивающихся на фоне диффузных заболеваний соединительной ткани;
назначение антибиотиков только при гнойных перикардитах и перикардитах, развившихся на фоне выраженной бактериальной инфекции (сепсис, пневмония и т.д.).
2. При гнойном экссудативном перикардите, помимо парентерального введения антибиотиков, показан перикардиоцентез с максимальным удалением экссудата, промыванием полости и повторным введением антибиотиков в полость перикарда (через катетер). 3. При тампонаде сердца показан экстренный (по жизненным показаниям) перикардиоцентез с удалением экссудата. 4. При констриктивном перикардите — субтотальная перикардэктомия.
|
||
|
|
12.5. Прогноз |
|
|
|
|
|
В большинстве случаев прогноз сухого (фибринозного) перикардита вполне благоприятный. На фоне адекватно назначенной терапии происходит быстрое уменьшение признаков воспаления. У части больных перикардит характеризуется затяжным или рецидивирующим течением. Наконец, примерно в 1/4 случаев возможна трансформация сухого (фибринозного) перикардита в выпотной (экссудативный) и даже (редко) в констриктивный (сдавливающий) перикардит.
При остром экссудативном перикардите в большинстве случаев выздоровление наступает через 2–6 недель. Тампонада сердца развивается примерно у 15% больных с острым перикардитом, а исход в констриктивный перикардит наблюдается у 10% больных. Еще в 10–20% случаев происходит рецидивирование перикардита. Нередко прогноз определяется характером, тяжестью и адекватностью терапии основного заболевания, осложнившегося перикардитом (ревматические болезни, туберкулез, опухоли, уремия и т.д.).
Отдаленный прогноз констриктивного перикардита зависит от эффективности оперативного вмешательства (перикардэктомии). В большинстве случаев успешно проведенная операция обеспечивает высокую выживаемость и качество жизни больных. При отсутствии оперативного лечения прогноз неблагоприятный.
|
Глава 13. Хроническое легочное сердце |
|
|
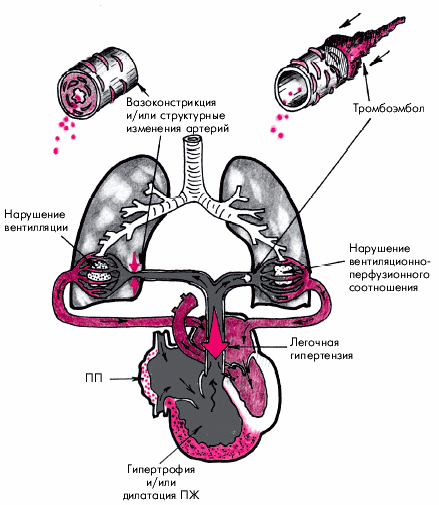
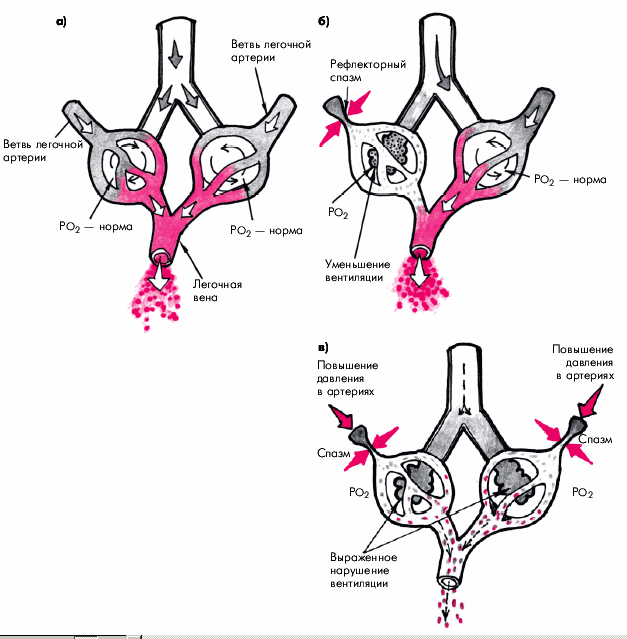
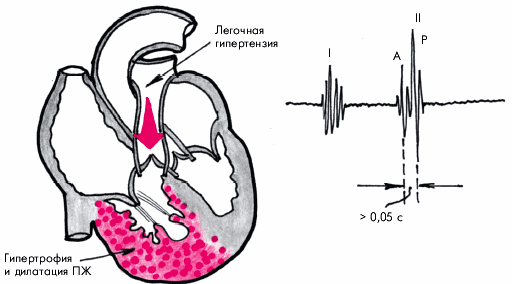
Легочным сердцем (ЛС) называют вторичное увеличение ПЖ (его гипертрофию и/или дилатацию), которое обусловлено легочной артериальной гипертензией, развившейся в результате заболеваний, нарушающих функцию легких, т.е. ведущих к развитию дыхательной недостаточности (рис. 13.1). Легочное сердце развивается не только вследствие заболеваний паренхимы легких, воздухоносных путей или сосудов легких, но и в результате поражения скелета и нервно-мышечного аппарата грудной клетки, а также нарушений центральной регуляции дыхания (E.H. Амосова). Следует помнить, что к понятию “легочное сердце” не относится увеличение ПЖ, вызванное нарушениями функции и структуры легких, которые обусловлены первичным поражением левых отделов сердца (например, стенозом левого атриовентрикулярного отверстия, постинфарктным кардиосклерозом и т.д.) или врожденными пороками сердца.
|
|
|
Рис. 13.1. Схема изменений ПЖ и ПП при хроническом легочном сердце, обусловленном нарушением альвеолярной вентиляции и вентиляционно-перфузионных соотношений. Объяснение в тексте |
Сведения об истинной распространенности ЛС весьма противоречивы, поскольку диагностика этого патологического синдрома затруднена, особенно в тех случаях, когда отсутствуют признаки правожелудочковой недостаточности. По некоторым сведениям, на долю ЛС приходится примерно 5–10% всех случаев сердечно-сосудистых заболеваний у взрослых. Однако есть основания считать, что ЛС относится к более распространенной патологии, особенно среди мужчин в возрасте старше 50 лет, и по частоте занимает 3-е место после ИБС и АГ (А.Р. Fishman).
|
13.1. Этиология |
|
|
В табл. 13.1 представлены наиболее частые причины легочного сердца. Различают острое и хроническое ЛС.
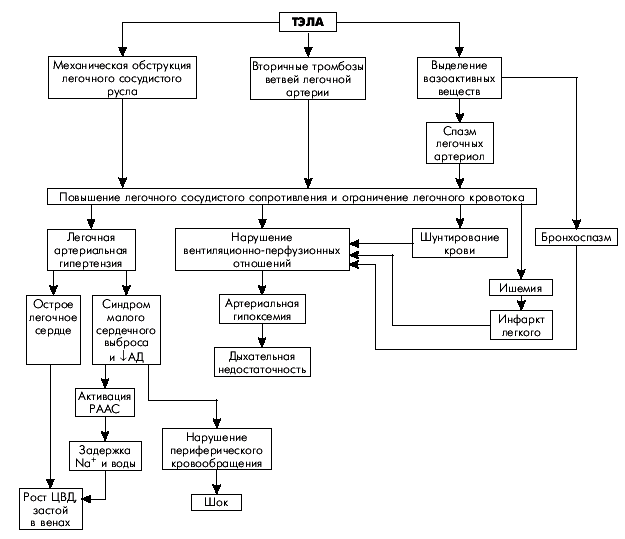
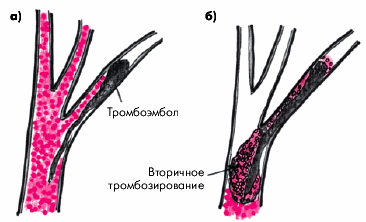
Острое легочное сердце развивается в течение нескольких часов или дней в результате внезапного и значительного повышения давления в легочной артерии и практически во всех случаях сопровождается острой правожелудочковой недостаточностью (без предшествующей гипертрофии ПЖ) (рис. 13.2, а). Наиболее частой причиной острого ЛС является тромбоэмболия ветвей легочной артерии (подробнее — см. главу 14).
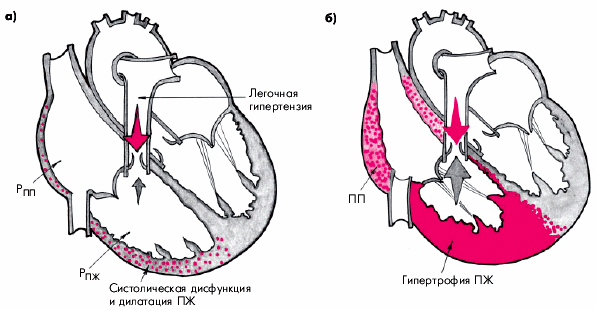
Хроническое легочное сердце характеризуется постепенным и медленным (в течение нескольких лет) формированием легочной артериальной гипертензии и развитием гипертрофии ПЖ (компенсированное хроническое ЛС) (рис. 13.2, б). В дальнейшем по мере повышения давления в легочной артерии развивается систолическая дисфункция ПЖ и появляются признаки правожелудочковой недостаточности (декомпенсированное хроническое ЛС).
Существует множество причин, ведущих к формированию хронического ЛС (см. табл. 13.1). Чаще всего это различные бронхолегочные заболевания, протекающие с выраженным нарушением структуры легочной ткани и/или альвеолярной гипоксией (хронический обструктивный бронхит, бронхоэктазы, фиброз легочной ткани, обусловленный хроническими патологическими процессами в легочной паренхиме и др.).
|
|
|
Рис. 13.2. Схематическое изображение морфологических изменений при остром (а) и хроническом (б) легочном сердце |
Таблица 13.1
Основные причины легочного сердца
|
Варианты легочного сердца |
Основные причины легочного сердца |
|
Острое ЛС |
1. Тромбоэмболия ветвей легочной артерии 2. Клапанный пневмоторакс 3. Массивные плевриты 4. Астматический статус |
|
Хроническое ЛС |
1. Заболевания паренхимы легких · Пневмосклерозы · Фиброз легких вследствие туберкулеза · Фиброз легких вследствие пневмокониозов · Фиброзирующий альвеолит · Хронические пневмониты и фиброз легких при диффузных заболеваниях соединительной ткани · Врожденные заболевания паренхимы легких (муковисцидоз, поликистоз, гипоплазия легких и др.) · Гранулематозные заболевания с поражением легких (саркоидоз и др.) · Состояние после резекции легких |
|
2. Заболевания воздухоносных путей · Хронический обструктивный бронхит · Бронхоэктазы · Бронхиальная астма · Хроническая обструктивная эмфизема легких · Стеноз трахеи · Синдром обструктивного ночного апноэ · Врожденные аномалии ротоглотки |
|
|
3. Поражение легочного сосудистого русла · Рецидивирующие тромбоэмболии и тромбозы мелких ветвей легочной артерии · Васкулиты при диффузных заболеваниях соединительной ткани (узелковый периартериит и др.) · Первичная легочная гипертензия |
|
|
4. Торакодиафрагмальные заболевания · Кифосколиоз · Нейро-мышечные заболевания (полиомиелит, миастения, миопатии и мышечные дистрофии) · Обширные плевральные спайки (шварты) и фиброторакс |
|
|
5. Нарушения функции дыхательного центра · Идиопатическая альвеолярная гиповентиляция · Синдром ночного апноэ центрального происхождения · Длительное пребывание в высокогорной местности · Ожирение (синдром Пиквика) |
|
Частыми причинами хронического ЛС, по-видимому, являются рецидивирующие тромбоэмболии мелких ветвей легочной артерии, клинические проявления которых в некоторых случаях могут быть очень скудными.
Наконец, хроническое ЛС может явиться следствием выраженных деформаций грудной клетки (например, кифосколиоза) или даже нарушений центральной регуляции дыхания (синдром ночного апноэ).
|
1. Тромбоэмболия крупных ветвей легочной артерии является основной причиной быстрого (в течение нескольких часов или дней) развития острого легочного сердца, которое проявляется, в первую очередь, клиническими признаками острой правожелудочковой недостаточности.
2. Основными причинами хронического легочного сердца являются:
|
13.2. Патогенез
|
13.2.1. Механизмы легочной артериальной гипертензии |
|
|
В основе развития хронического ЛС лежит постепенное формирование легочной артериальной гипертензии, обусловленной несколькими патогенетическими механизмами. Хотя значение каждого из них различно в зависимости от этиологии легочной гипертензии, все же главным звеном ее патогенеза в большинстве случаев является альвеолярная гипоксия, возникающая в условиях нарастающей неравномерности альвеолярной вентиляции.
1. Гипоксическая легочная вазоконстрикция. В нормально функционирующем легком существует достаточно сложный механизм регуляции местного кровотока, зависящего в первую очередь от парциального давления кислорода в альвеолярном воздухе. Этот механизм известен под названием рефлекса Эйлера–Лильестранда. Если в физиологических условиях в относительно небольшом участке легкого происходит снижение парциального давления кислорода в альвеолярном воздухе, то в этом же участке рефлекторно возникает местная вазоконстрикция, которая приводит к адекватному ограничению кровотока (рис. 13.3, б). В результате местный легочный кровоток как бы приспосабливается к интенсивности легочной вентиляции, и нарушений вентиляционно-перфузионных соотношений не происходит.
Если альвеолярная гиповентиляция выражена в большей степени и распространяется на обширные участки легочной ткани (например, при выраженном фиброзе легких или обструктивных заболеваниях легких и т.д.), развивается генерализованное повышение тонуса легочных артериол, ведущее к повышению общего легочного сосудистого сопротивления и легочной гипертензии (рис. 13.3, в).
Механизм гипоксической легочной вазоконстрикции до конца не ясен. Вероятно, он реализуется при участии САС, а также вазоконстрикторных эндотелиальных факторов. Эндотелины и ангиотензин II прямо стимулируют сокращение гладкой мускулатуры сосудистой стенки, тогда как снижение синтеза простагландина PGI2, эндотелиального расслабляющего фактора (NO) еще больше усиливает эти вазоконстрикторные влияния.
|
|
|
Рис. 13.3. Схема, иллюстрирующая действие механизма местной саморегуляции легочного кровотока Эйлера–Лильестранда: а — легочный кровоток при нормальном парциальном давлении кислорода (РО 2 ); б — локальное снижение альвеолярной вентиляции и парциального давления кислорода, сопровождающееся местным рефлекторным спазмом малых ветвей легочной артерии; в — выраженное распространенное снижение альвеолярной вентиляции, ведущее к генерализованой вазоконстрикции и повышению давления в легочной артерии |
2. Влияние гиперкапнии. Гиперкапния (увеличение концентрации СО2 в крови) также способствует развитию легочной гипертензии. Однако высокая концентрация СО2 действует не прямо на тонус легочных сосудов, а опосредованно — преимущественно через обусловленный ею ацидоз (снижение рН меньше 7,2).
Кроме того, задержка двуокиси углерода (СО2) способствует снижению чувствительности дыхательного центра к СО2, что еще больше уменьшает вентиляцию легких и способствует легочной вазоконстрикции.
3. Анатомические изменения легочного сосудистого русла. Большое значение в патогенезе легочной гипертензии имеют структурные изменения в сосудистом русле, к которым относятся:
-
сдавление и запустевание артериол и капилляров вследствие постепенно прогрессирующих фиброза легочной ткани и эмфиземы легких;
-
развитие утолщения сосудистой стенки за счет гипертрофии мышечных клеток медии и появления продольного слоя миоцитов в интиме, что сопровождается уменьшением просвета легочных артериол и способствует увеличению выраженности и длительности вазоконстрикторных реакций;
-
множественные микротромбозы, возникающие в условиях хронического нарушения кровотока и повышенной агрегации тромбоцитов;
-
рецидивирующие тромбоэмболии мелких ветвей легочной артерии;
развитие бронхопульмональных анастомозов, т.е. анастомозов между ветвями бронхиальных артерий, относящихся к большому кругу кровообращения, и разветвлениями легочной артерии (малый круг). Поскольку давление в бронхиальных артериях выше, чем в малом круге кровообращения, происходит перераспределение крови из системы бронхиальных артерий в систему ветвей легочной артерии, что существенно увеличивает легочное сосудистое сопротивление.
васкулиты (например, при системных заболеваниях соединительной ткани) также характеризуются пролиферацией интимы, сужением и облитерацией просвета сосудов.
Все перечисленные патологические изменения сосудистого русла легких закономерно приводят к прогрессирующему увеличению легочного сосудистого сопротивления и развитию легочной гипертензии.
4. Нарушения бронхиальной проходимости. Развитию альвеолярной гипоксии и формированию ЛС больше подвержены больные, страдающие хроническими обструктивными заболеваниями легких (хроническим обструктивным бронхитом, бронхиальной астмой) с преобладанием признаков обструктивной дыхательной недостаточности (“blue bloaters” — “синие одутловатые”). Именно эти больные отличаются выраженной неравномерностью легочной вентиляции, что обусловливает значительные нарушения вентиляционно-перфузионных соотношений, усугубляет альвеолярную гипоксию и приводит к генерализованному проявлению механизма гипоксической легочной вазоконстрикции.
У пациентов с преобладанием рестриктивных нарушений и диффузными поражениями легких альвеолярная гипоксия выражена значительно меньше. Например, больные с выраженной диффузной эмфиземой легких (“pink puffers” — “розовые пыхтящие”) гораздо меньше подвержены развитию легочной гипертензии и хронического ЛС.
К числу дополнительных факторов, влияющих на формирование легочной артериальной гипертензии, относятся:
повышенная вязкость крови и агрегация тромбоцитов;
увеличение МО;
тахикардия.
Выраженный эритроцитоз и полицитемия, характерные для многих бронхолегочных заболеваний, сопровождаются увеличением агрегации эритроцитов и вязкости крови, что еще больше затрудняет кровоток по сосудистому руслу легких, увеличивая его сопротивление. Кроме того, повышение вязкости и замедление кровотока способствуют образованию пристеночных тромбов мелких ветвей легочной артерии.
Увеличение сердечного выброса (МО) обусловлено тахикардией и гиперволемией, которые весьма характерны для больных хроническим ЛС. Одной из возможных причин гиперволемии, по видимому, является гиперкапния, способствующая увеличению концентрации альдостерона в крови и, соответственно, задержке Nа+ и воды.
Таким образом, описанные механизмы повышения легочного сосудистого сопротивления и формирования легочной артериальной гипертензии тесным образом связаны с характером и выраженностью изменений в воздухоносных путях и сосудистом русле легких. Поэтому любое обострение бронхолегочных заболеваний, как правило, сопровождается усугублением легочной гипертензии. Наоборот, эффективное лечение воспалительных изменений в легочной паренхиме или дыхательных путях в большинстве случаев сопровождается уменьшением давления в системе малого круга. Это следует учитывать при подборе соответствующей терапии, направленной на снижение легочного сосудистого сопротивления, поскольку любые попытки такой терапии могут оказаться безуспешными, если одновременно не проводится лечение активного воспалительного процесса в бронхолегочной системе.
|
В основе развития хронического ЛС лежит постепенное формирование легочной артериальной гипертензии, обусловленной несколькими патогенетическими механизмами. К наиболее значимым из них относятся: 1. Гипоксическая легочная вазоконстрикция, обусловленная сложным механизмом регуляции местного кровотока, зависящим от парциального давления кислорода в альвеолярном воздухе (рефлекс Эйлера–Лильестранда). Механизм гипоксической легочной вазоконстрикции реализуется, вероятно, при участии САС, а также вазоконстрикторных эндотелиальных факторов. 2. Гиперкапния и ацидоз. 3. Анатомические изменения легочного сосудистого русла в виде сдавления и запустевания артериол и капилляров вследствие постепенно прогрессирующих фиброза легочной ткани и эмфиземы легких, развития утолщений сосудистой стенки за счет гипертрофии мышечных клеток, множественных микротромбозов, рецидивирующих тромбоэмболий мелких ветвей легочной артерии и васкулитов. 4. Нарушения бронхиальной проходимости у больных с обструктивными заболеваниями легких. 5. Повышенная вязкость крови, обусловленная эритроцитозом и полицитемией, характерными для дыхательной недостаточности. 6. Увеличение сердечного выброса (МО), обусловленное тахикардией и гиперволемией. |
||
|
|
13.2.2. Основные изменения гемодинамики |
|
|
|
|
|
В результате формирования легочной АГ развиваются и постепенно прогрессирует ряд гемодинамических изменений, наиболее характерных для больных с развернутой клинической картиной хронического ЛС:
1. Гипертрофия правого желудочка (без нарушения его функции), развивающаяся в ответ на выраженное и длительное увеличение постнагрузки (компенсированное ЛС).
2. Постепенное снижение систолической функции ПЖ, сопровождающееся повышением КДД ПЖ, его дилатацией и развитием застоя крови в венозном русле большого круга кровообращения (декомпенсированное ЛС).
3. Тенденция к увеличению ОЦК, задержке Nа+ и воды в организме.
4. На поздних стадиях заболевания — снижение сердечного выброса и уровня АД в результате уменьшения притока крови в малый круг кровообращения и, соответственно, наполнения ЛЖ (преимущественно за счет критического падения систолической функции ПЖ и формирования “второго барьера” в виде выраженных структурных изменений сосудистого русла легких).
Патогенез острого ЛС отличается от описанных механизмов формирования хронического ЛС и подробно изложен в главе 14.
|
13.3. Клиническая картина |
|
|
У большинства больных хроническим ЛС долгое время преобладают характерные клинические признаки воспалительного процесса в бронхолегочной системе, а также дыхательной недостаточности. Клинические проявления легочной АГ, эксцентрической гипертрофии миокарда ПЖ и, тем более, — систолической дисфункции ПЖ, выявляются достаточно поздно, хотя некоторые из них могут быть установлены с помощью современных инструментальных методов исследования. Проблема ранней диагностики хронического ЛС усугубляется тем, что в начальных стадиях заболевания давление в легочной артерии повышается только во время физической нагрузки или при обострении воспалительного процесса в легких, тогда как в покое или в период ремиссии болезни остается почти нормальным.
Развернутая клиническая картина ЛС характеризуется повышением среднего давления в легочной артерии выше 25 мм рт. ст., наличием выраженной гипертрофии миокарда ПЖ, его дилатацией, а также признаками прогрессирующей изолированной правожелудочковой недостаточности.
Жалобы
Одышка является наиболее характерным субъективным проявлением легочной АГ. Однако на ранних стадиях развития заболевания ее трудно отличить от проявлений собственно дыхательной недостаточности, характерной для больных с хроническими воспалительными процессами в легких. В этих случаях следует учитывать отсутствие других объективных признаков, указывающих на наличие легочной АГ (гипертрофия ПЖ, допплер-эхокардиографические признаки повышения среднего давления в легочной артерии и др.), а также четкую связь одышки с кашлем, отделением мокроты, повышением температуры тела и объективными признаками бронхиальной обструкции или рестриктивных нарушений.
Одышка при легочной АГ возникает в результате ограничения легочного кровотока, вызванного генерализованным спазмом артериол, уменьшением их просвета, микротромбозами и тромбоэмболиями мелких ветвей легочной артерии, а также запустевания легочного сосудистого русла. Это приводит к нарушению оксигенации крови в легких, артериальной гипоксемии и раздражению дыхательного центра. Следует, правда, иметь в виду, что ощущение одышки не всегда соответствует выраженности артериальной гипоксемии, гиперкапнии и уровню давления в легочной артерии.
Характерно, что одышка при легочной АГ может уменьшаться преимущественно на фоне эффективного применения бронхолитиков, дачи кислорода, активной противовоспалительной терапии, тогда как применение сердечных гликозидов или диуретиков не только не уменьшает одышку, но может ухудшить состояние больного. В отличие от одышки, связанной с левожелудочковой недостаточностью и венозным застоем крови в легких, одышка при легочной АГ не усиливается в горизонтальном положении больного и не уменьшается в положении сидя.
Тахикардия является весьма характерным, хотя и неспецифичным, признаком легочной АГ. Нередко она может быть проявлением дыхательной недостаточности и рефлекторного повышения активности САС у больных с артериальной гипоксемией.
Боли в области сердца выявляются более чем у половины больных хроническим ЛС. Нередко боли возникают при физической нагрузке, однако нитроглицерин обычно не купирует боль, тогда как применение эуфиллина сопровождается положительным эффектом.
Хотя боли в области сердца и не носят характера типичной стенокардии, принято считать, что причиной их возникновения является относительная коронарная недостаточность, обусловленная значительным увеличением мышечной массы ПЖ, относительно недостаточным развитием капиллярной сети, рефлекторным спазмом правой КА, затруднением коронарного кровотока в ПЖ в связи с повышением в нем конечно-диастолического давления. Вероятно, имеет также значение инфекционно-токсическое поражение миокарда, а также пульмонокардиальный рефлекс.
Слабость, повышенная утомляемость, тяжесть в нижних конечностях и другие признаки снижения толерантности к физической нагрузке нередко выявляются у больных ЛС, особенно при возникновении признаков правожелудочковой недостаточности. Эти симптомы обусловлены преимущественно нарушением перфузии периферических органов и тканей, возникающим на определенной стадии болезни (уменьшение сердечного выброса, периферическая вазоконстрикция), а также в результате характерной для больных с дыхательной недостаточностью артериальной гипоксемии. Определенное значение имеют, вероятно, нарушения периферического кровотока, вызванные активацией САС и РААС.
Отеки на ногах — одна из наиболее характерных жалоб больных с декомпенсированным ЛС. Вначале отеки локализуются в области стоп и лодыжек, появляются у больных к вечеру, а к утру могут проходить. По мере прогрессирования правожелудочковой недостаточности отеки распространяются на область голеней и бедер и могут сохраняться в течение всего дня, усиливаясь к вечеру.
Абдоминальные расстройства. К проявлениям хронической правожелудочковой недостаточности у больных ЛС относятся также жалобы на боли или чувство тяжести в правом подреберье, связанные с увеличением печени и растяжением глиссоновой капсулы.
У некоторых больных декомпенсированным ЛС появляются интенсивные боли в эпигатральной области, тошнота, рвота, метеоризм. Обычно эти клинические проявления связывают с гипоксией, которая снижает защитные свойства слизистой оболочки желудка, 12-перстной кишки и кишечника и приводит к ее повреждению. Не исключено, что эти расстройства особенно часто возникают у пациентов с сопутствующим абдоминальным атеросклерозом.
В тяжелых случаях правожелудочковой недостаточности отмечается быстрое увеличение живота в объеме за счет формирующегося асцита.
Церебральные расстройства чаще выявляются у больных с тяжелой дыхательной недостаточностью и декомпенсированным ЛС. Выраженная энцефалопатия у этих больных возникает в результате хронической гиперкапнии и гипоксии головного мозга, а также нарушений сосудистой проницаемости и отека головного мозга. При этом у части больных наблюдается повышенная возбудимость, агрессивность, эйфория и даже психозы. У других больных энцефалопатия проявляется вялостью, подавленностью, сонливостью днем и бессонницей ночью, головокружениями, мучительными головными болями. В тяжелых случаях могут возникать эпизоды потери сознания, сопровождающиеся судорогами.
Коллаптоидный вариант течения заболевания, характеризующийся эпизодами резкой слабости, головокружений, внезапным падением АД, профузным холодным потом и тахикардией, как правило, возникает у больных с тяжелой декомпенсацией, выраженной легочной АГ (“второй барьер”) и тенденцией к падению сердечного выброса. Эти клинические проявления в большинстве случаев указывают на плохой прогноз заболевания.
Осмотр
Компенсированное легочное сердце
Внешний вид больных с компенсированным ЛС неспецифичен и скорее отражает внешние проявления основного заболевания легких и дыхательной недостаточности. В стадии компенсации, когда преобладают клинические проявления дыхательной недостаточности и артериальной гипоксемии, в большинстве случаев можно обнаружить цианоз, который носит диффузный характер (центральный цианоз). На лице, ушах, шее и верхней половине туловища выявляется синюшная окраска кожных покровов с сероватым, землистым оттенком (рис. 13.4, см. цветную вклейку). Цианоз часто усиливается при наклоне больного вперед. Конечности при этом остаются теплыми, поскольку отсутствуют существенные нарушения периферического кровотока. В этих случаях цианоз обусловлен существенным нарушением оксигенации крови в легких и увеличением абсолютного количества восстановленного гемоглобина (выше 40–50 г/л) в крови, оттекающей от легких.
У больных с выраженной гиперкапнией иногда появляется своеобразный болезненный румянец на щеках, обусловленный патологическим расширением периферических сосудов под действием СО2. Правда, этот признак также не является специфичным для ЛС и может обнаруживаться у больных с выраженной дыхательной недостаточностью и нарушением газового состава крови.
При общем осмотре больного ЛС нередко выявляется также расширение и увеличение количества сосудов на коже и конъюнктивах, что также связывают с действием хронической гиперкапнии. В этой связи следует напомнить, что увеличение содержания СО2 в крови сопровождается неодинаковой реакцией периферических сосудов: сосуды кожи и головного мозга расширяются, а сосуды скелетных мышц и органов брюшной полости — спазмируются. В случаях тяжелой дыхательной недостаточности даже у больных компенсированным ЛС иногда можно обнаружить так называемые “кроличьи (или лягушачьи) глаза эмфизематика”, обусловленные заметным расширением и увеличением количества сосудов конъюнктивы.
Наконец, у больных с хроническими нагноительными заболеваниями легких (бронхоэктазами, хроническим гнойным бронхитом) часто выявляется утолщение концевых фаланг рук и ног (симптом “барабанных палочек”) с характерной деформацией ногтевых пластинок в виде “часовых стекол” (см. рис 9.3).
Декомпенсированное легочное сердце
У больных декомпенсированным ЛС, наряду с клиническими признаками, описанными выше, появляются некоторые симптомы, указывающие на наличие застоя крови в венозном русле большого круга кровообращения и значительное повышение ЦВД.
Выраженный цианоз — один из важных внешних признаков декомпенсированного ЛС. При возникновении правожелудочковой недостаточности у больных ЛС цианоз нередко приобретает смешанный характер: на фоне диффузного синюшного окрашивания кожи, характерного для больных с дыхательной недостаточностью, определяется выраженный цианоз губ, кончиков пальцев рук и ног, кончика носа, подбородка, ушей. Характерно, что даже на фоне хронического застоя крови в венозном русле большого круга кровообращения конечности в большинстве случаев остаются теплыми, возможно в связи с периферической вазодилатацией, обусловленной гиперкапнией. Исключение составляют лица с тяжелым течением заболевания, снижением сердечного выброса и нарушением периферического кровотока.
Отеки нижних конечностей у больных декомпенсированным ЛС обусловлены преимущественно застоем крови в большом круге кровообращения и повышением гидростатического давления. Определенное значение имеет также задержка Nа+ и воды в организме, обусловленная, главным образом, повышением активности РААС и содержания альдостерона и АДГ. Отеки локализуются на стопах, голенях, а у тяжелых больных, длительно сохраняющих постельный режим, — в области поясницы.
Набухание шейных вен является важным клиническим признаком повышения ЦВД и застоя крови в венах большого круга кровообращения (см. рис. 2.13). Следует, правда, помнить, что набухание шейных вен можно выявить не только у больных с декомпенсированным ЛС и правожелудочковой недостаточностью, но и у пациентов с обструкцией мелких бронхов и выраженной эмфиземой легких. В этих случаях набухание шейных вен обусловлено повышением внутригрудного давления и нарушением оттока крови по венам в правое сердце. Набухание вен шеи вместе с центральным цианозом бывает особенно значительным при приступах мучительного малопродуктивного кашля у больных с обструктивным бронхитом или при приступах бронхиальной астмы. В главе 2 была подробно описана методика ориентировочного определения уровня ЦВД при осмотре вен шеи.
Нередко набухание шейных вен у больных хроническим ЛС больше выражено во время вдоха, что свидетельствует о значительном повышении ЦВД и затруднении кровотока из крупных вен в ПП и ПЖ (симптом Куссмауля).
В тяжелых случаях можно выявить абдоминально-югулярный (гепато-югулярный) рефлюкс — увеличение набухания шейных вен при надавливании рукой на переднюю брюшную стенку (см. главу 2). Напомним, что сдавление печени и увеличение венозного притока крови к сердцу в норме, при достаточной сократительной способности ПЖ, не сопровождаются набуханием шейных вен и увеличением ЦВД. У больных с правожелудочковой недостаточностью, снижением насосной функции ПЖ и застоем в венах большого круга кровообращения абдоминально-югулярная проба приводит к усилению набухания вен шеи и возрастанию ЦВД.
Лицо у больных с правожелудочковой недостаточностью (см. рис. 2.15) нередко одутловато, кожа желтовато-бледная со значительным цианозом губ, кончика носа, ушей; рот полуоткрыт, глаза тусклые (лицо Корвизара).
Наконец, в терминальной стадии хронической правожелудочковой недостаточности у больных хроническим ЛС иногда развивается “сердечная кахексия”, причинами которой являются нарушения функции органов брюшной полости, вызванные застоем крови в системе воротной вены: ухудшение всасывания в кишечнике, снижение белково- синтетической функции печени, выраженная анорексия, тошнота, рвота и.т.п. Важное значение имеет также длительная гиперактивация САС, РААС и системы цитокинов, в частности фактора некроза опухолей a, которые обладают повреждающим действием на периферические ткани.
Исследование органов дыхания
При исследовании органов дыхания обнаруживают разнообразные изменения, зависящие от характера основного патологического процесса в легких, которые явились причиной формирования ЛС.
В большинстве случаев можно выявить признаки эмфиземы легких. Грудная клетка приобретает бочкообразную форму, определяются развернутый (больше 90°) эпигастральный угол, увеличение межреберных промежутков, сглаженность или выбухание надключичных ямок. Перкуторный звук над легкими становится коробочным, верхние границы легких смещены вверх, нижние — вниз. Уменьшена дыхательная экскурсия нижнего края легких.
В более редких случаях выявляется кифосколиотическая форма грудной клетки (рис. 13.5), которая также может явиться причиной вентиляционных расстройств и формирования хронического ЛС.
При аускультации на фоне разнообразных изменений основных дыхательных шумов, как правило, выслушиваются сухие и/или влажные хрипы, крепитация, что в большинстве случаев позволяет уточнить характер основного патологического процесса в легких.
Жидкость в плевральной полости (гидроторакс, чаще правосторонний) нередко выявляется при декомпенсированном ЛС и наличии застоя крови в венах большого круга кровообращения.
|
Рис. 13.4. Лицо больного с вентиляционной дыхательной недостаточностью и диффузной (серым) цианозом |
|
|
Рис. 13.5. Кифосколиотическая грудная клетка |
|
Исследование органов брюшной полости
Гепатомегалия выявляется практически у всех больных декомпенсированным ЛС. Печень увеличена в размерах, при пальпации уплотнена, болезненна, край печени закруглен. Тем не менее, проводя исследование больных с хроническим ЛС, следует помнить, что нижние границы печени у этих больных могут быть опущены за счет выраженной эмфиземы легких. Поэтому при исследовании таких больных не следует ограничиваться перкуссией и пальпацией нижнего края печени: необходимо определять размеры этого органа по Курлову или Образцову.
Выраженная правожелудочковая недостаточность сопровождается появлением свободной жидкости в брюшной полости — асцитом.
Осмотр, пальпация и перкуссия сердца
Осмотр и пальпация сердца позволяют выявить гипертрофию и дилатацию ПЖ еще на стадии компенсированного легочного сердца, т.е. до появления первых клинических признаков правожелудочковой недостаточности. Наиболее характерно появление сердечного толчка — выраженной разлитой пульсации слева от грудины, в зоне абсолютной тупости сердца, а также в эпигастральной области, обусловленной гипертрофированным и дилатированным ПЖ (рис. 13.6). Этот важнейший клинический признак долгое время остается единственным указанием на наличие у больного с хроническими заболеваниями легких морфологических изменений в ПЖ, вызванных легочной АГ.
Смещение вправо правой границы относительной тупости сердца, а также расширение абсолютной тупости сердца (рис. 13.7) указывают на наличие выраженной дилатации ПЖ.
|
Рис. 13.6. Сердечный толчок и эпигастральная пульсация у больного с хроническим легочным сердцем |
|
|
Рис. 13.7. Изменение границ относительной и абсолютной тупости сердца при хроническом легочном сердце |
|
Аускультация сердца
Наиболее характерным аускультативным признаком легочной АГ является акцент II тона на легочной артерии. Расщепление II тона во II межреберье слева от грудины, также нередко выявляемое у больных с легочной АГ, обычно указывает на замедление изгнания крови из гипертрофированного ПЖ, более позднее закрытие створок клапана легочной артерии и, соответственно, более позднее формирование пульмонального компонента II тона (рис. 13.8).
|
|
|
Рис. 13.8. Механизм формирования акцента и расщепления II тона при хроническом легочном сердце |
I тон сердца может быть несколько ослаблен за счет более медленного сокращения гипертрофированного и дилатированного ПЖ. В то же время у половины больных компенсированным и субкомпенсированным ЛС I тон сохранен или даже несколько усилен, что связывают с поворотом сердца вокруг продольной оси и приближением гипертрофированного и дилатированного ПЖ к поверхности грудной клетки.
Правожелудочковый IV тон сердца иногда выявляется при выраженной гипертрофии ПЖ. Его появление у больных с ЛС косвенно может указывать на наличие выраженной диастолической дисфункции ПЖ и увеличение вклада ПП в его диастолическое наполнение. При возникновении систолической дисфункции ПЖ и выраженной его объемной перегрузки иногда выявляется правожелудочковый патологический III тон сердца.
Следует подчеркнуть, что в далеко зашедших случаях ЛС при выраженной дилатации ПЖ может развиться относительная недостаточность трехстворчатого клапана, аускультативным проявлением которой является систолический шум в трикуспидальной зоне, усиливающийся при глубоком вдохе (симптом Риверо–Корвалло).
Наконец, в редких случаях в месте аускультации легочной артерии (II межреберье слева от грудины) и вдоль левого края грудины выслушивается мягкий, дующий диастолический шум, начинающийся сразу после II тона. Шум обусловлен относительной недостаточностью клапана легочной артерии вследствие ее расширения, связанного с длительным существованием легочной АГ (см. главу 8).
Артериальный пульс и АД
При выраженной легочной АГ и снижении систолической функции ПЖ нередко наблюдается уменьшение притока крови к левым отделам сердца, что сопровождается отчетливой тенденцией к снижению системного АД. В тяжелых случаях заболевания уменьшается наполнение, напряжение и величина артериального пульса. Иногда можно выявить парадоксальный пульс в виде снижения систолического АД во время вдоха больше чем на 10 мм рт. ст. (см. главу 12). Как правило, выявляется тахикардия, а также разнообразные нарушения ритма сердца.
|
Наиболее диагностически значимыми объективными признаками хронического ЛС и легочной АГ являются: 1. Наличие выраженного разлитого сердечного толчка и эпигастральной пульсации (гипертрофия и дилатация ПЖ). 2. Акцент и расщепление II тона на легочной артерии (высокое давление в легочной артерии и замедление изгнания крови из ПЖ). 3. Смещение вправо правой границы сердца и расширение абсолютной тупости сердца (дилатация ПЖ). 4. Появление клинических признаков правожелудочковой недостаточности (смешанный цианоз, отеки, набухание шейных вен, гепатомегалия, гидроторакс, асцит). 5. Сочетание каждого из указанных признаков с наличием у больного хронических заболеваний бронхолегочного аппарата, поражения легочных сосудов или торако-диафрагмальными поражениями. |
||
|
|
13.4. Лабораторная и инструментальная диагностика |
|
|
|
|
|
Анализ крови
В клиническом анализе крови у больных хроническим ЛС в большинстве случаев выявляется эритроцитоз, увеличение гематокрита и содержания гемоглобина, что является весьма характерным для хронической артериальной гипоксемии. В тяжелых случаях развивается полицитемия с увеличением содержания эритроцитов, тромбоцитов и лейкоцитов. Уменьшение СОЭ часто ассоциируется с повышением вязкости крови, что также закономерно наблюдается у многих больных, страдающих дыхательной недостаточностью.
Описанные изменения в анализах крови, естественно, не являются прямым доказательством наличия ЛС, но они, как правило, указывают на выраженность легочной артериальной гипоксемии — основного звена патогенеза хронического ЛС.
Электрокардиография
При электрокардиографическом исследовании у больных хроническим ЛС выявляются признаки гипертрофии ПЖ и ПП. Наиболее ранние изменения ЭКГ — это появление в отведениях II, III, aVF (иногда в V1) высокоамплитудных, с заостренной вершиной, зубцов Р (P-pulmonale), причем их длительность не превышает 0,10 с.
Несколько позже начинают выявляться ЭКГ-признаки гипертрофии ПЖ. В зависимости от уровня давления в легочной артерии, величины мышечной массы ПЖ и выраженности сопутствующей эмфиземы легких у больных ЛС можно выявить три типа ЭКГ-изменений, два из которых описаны в главе 8. Напомним, что rSR'-тип наблюдается при умеренной гипертрофии ПЖ, когда его масса приближается к массе миокарда ЛЖ или несколько меньше ее (рис. 13.9):
-
появление в отведении V1 комплекса QRS типа rSR';
-
увеличение амплитуды зубцов R'V1 и SV5, 6 ; при этом амплитуда R'V1 > 7 мм или R'V1 + SV5, 6 > 10,5 мм;
-
признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
-
увеличение длительности интервала внутреннего отклонения в правом грудном отведении (V1) больше 0,03 с;
-
смещение сегмента RS–T вниз и появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
-
смещение электрической оси сердца вправо (угол a > +100°) (непостоянный признак).
|
Рис. 13.9. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и rSr'-тип гипертрофии ПЖ) |
|
qR-тип выявляется при выраженной гипертрофии ПЖ, когда его масса несколько больше массы миокарда ЛЖ. Для этого типа ЭКГ-изменений характерно (рис. 13.10):
-
появление в отведении V1 комплекса QRS типа QR или qR;
-
увеличение амплитуды зубцов RV1 и SV5, 6. При этом амплитуда RV1 > 7 мм или RV1 + SV5, 6 > 10,5 мм;
-
признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
-
увеличение длительности интервала внутреннего отклонения в правом грудном отведении (V1) более 0,03 с;
-
смещение сегмента RS–T вниз и появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
-
смещение электрической оси сердца вправо (угол a > +100°) (непостоянный признак).
Таким образом, основные отличия этих двух типов ЭКГ-изменений при гипертрофии ПЖ заключаются в форме комплекса QRS в отведении V1.
|
Рис. 13.10. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и qR-тип гипертрофии ПЖ) |
|
S-тип ЭКГ-изменений часто наблюдается у больных с выраженной эмфиземой легких и хроническим ЛС, когда гипертрофированное сердце резко смещается кзади, преимущественно за счет эмфиземы. При этом вектор деполяризации желудочков проецируется на отрицательные части осей грудных отведений и отведений от конечностей (признаки поворота сердца вокруг поперечной оси верхушкой кзади). Это объясняет существенные особенности изменений комплекса QRS у этих больных (рис. 13.11):
-
во всех грудных отведениях от V1 до V6 комплекс QRS имеет вид rS или RS c выраженным зубцом S;
-
в отведениях от конечностей часто регистрируется синдром SISIISIII (признак поворота сердца вокруг поперечной оси верхушкой кзади);
-
на ЭКГ выявляются признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
-
определяется вертикальная позиция электрической оси сердца.
|
|
|
Рис. 13.11. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и S-тип гипертрофии ПЖ) |
Следует отметить, что при всех трех типах ЭКГ-изменений диагноз гипертрофии ПЖ косвенно подтверждается наличием признаков гипертрофии ПП (P-pulmonale), выявляемых в отведениях II, III и aVF.
Рентгенологическое исследование
Рентгенологическое исследование позволяет уточнить характер поражения легких, а также выявить несколько важных рентгенологических признаков, указывающих на увеличение размеров ПЖ и наличие легочной АГ (рис. 13.12 и 13.13):
1. Выбухание ствола легочной артерии в правой передней косой проекции и реже в прямой проекции (расширение II дуги левого контура сердца).
2. Расширение корней легких.
3. Увеличение размеров ПЖ в правой и левой передней, а также в левой боковой проекциях и уменьшение ретростернального пространства (рис. 13.13).
4. Значительное выбухание заднего контура тени сердца вплоть до сужения ретрокардиального пространства, что наблюдается при выраженной гипертрофии и дилатации ПЖ, который смещает ЛЖ кзади (см. рис. 13.13, б).
5. Расширение ствола и центральных ветвей легочной артерии, которое сочетается с обеднением сосудистого рисунка на периферии легочных полей за счет сужения мелких легочных артерий.
|
Рис. 13.12. Рентгенограмма сердца в прямой проекции больного с хроническим легочным сердцем |
|
|
Рис. 13.13. Смещение контуров тени сердца в правой передней (а) и левой передней (б) проекциях при значительной дилатации и гипертрофии правого желудочка (схема). Заметно значительное сужение ретростернального пространства и выбухание ствола легочной артерии. Ретрокардиальное пространство также сужено (б) за счет оттеснения левого желудочка кзади увеличенным правым желудочком |
|
Эхокардиография
Эхокардиографическое исследование у больных хроническим ЛС проводится с целью:
-
объективного подтверждения наличия гипертрофии ПЖ и ПП;
-
оценки систолической функции ПЖ;
-
косвенного определения давления в легочной артерии.
1. Выявление гипертрофии миокарда правого желудочка. Эхокардиографическая диагностика гипертрофии ПЖ представляет достаточно сложную проблему. Это связано, прежде всего, с трудностями, возникающими при ручном контурировании эндокарда желудочка, отличающегося выраженной трабекулярностью, а также с недостаточной визуализацией этого отдела сердца, бульшая часть которого в норме расположена за грудиной.
Гипертрофия миокарда ПЖ может быть диагностирована при М-модальном (одномерном) исследовании с достаточно высокой степенью вероятности при толщине передней стенки ПЖ, превышающей 5 мм (рис. 13.14). Правда, это справедливо только в тех случаях, когда при ультразвуковом исследовании достигнута хорошая визуализация эндокарда передней стенки ПЖ.
Предварительное двухмерное исследование из парастернального доступа по короткой оси сердца или из апикальной четырехкамерной позиции нередко позволяет добиться лучшей визуализации ПЖ и выбрать оптимальное направление ультразвукового луча, пересекающего стенку ПЖ при М-модальном исследовании.
Несомненно, что более тщательный поиск признаков гипертрофии миокарда ПЖ показан в тех случаях, когда при двухмерном исследовании определяется дилатация этого отдела сердца, в большинстве случаев указывающая на наличие объемной или систолической перегрузки ПЖ.
|
|
|
Рис. 13.14. Определение толщины передней стенки правого желудочка (RVW) по одномерным эхокардиограммам, зарегистрированным из парастернального доступа у здорового человека (а) и больного хроническим легочным сердцем с гипертрофией правого желудочка (б) |
|
|
|
Рис. 13.15. Двухмерные эхокардиограммы, зарегистрированные в апикальной четырехкамерной позиции в норме (а) и у больного хроническим легочным сердцем с выраженной дилатацией правого желудочка (б). В последнем случае верхушка сердца образована ПЖ, объем которого существенно превышает объем ЛЖ, отмечается парадоксальное движение МЖП в сторону левого желудочка (отмечено стрелкой) |
2. Оценка систолической функции правого желудочка подробно описана в главе 2. Напомним, что эта оценка основана, прежде всего, на выявлении признаков дилатации ПЖ, например, при регистрации М-модальной ЭхоКГ из парастернального доступа по короткой оси сердца (см. рис. 2.32). В норме КДРПЖ составляет около 15–20 мм, а при дилатации ПЖ обычно превышает 26 мм.
Дилатация ПЖ сравнительно хорошо выявляется при двухмерном исследовании в парастернальной позиции по короткой оси (см. рис. 2.33), а также в апикальной четырехкамерной позиции, в которой дилатированный ПЖ как бы оттесняет ЛЖ в сторону, занимая, хотя бы частично, верхушку сердца (рис. 13.15, б), в норме образованную только ЛЖ (рис. 13.15, а).
Сократимость ПЖ чаще всего оценивается визуально, качественно — по характеру и амплитуде движения передней стенки ПЖ и МЖП. Например, объемная перегрузка ПЖ у больных с декомпенсированным ЛС характеризуется не только расширением его полости, но также усиленной пульсацией его стенок и парадоксальными движениями МЖП: во время систолы МЖП прогибается в полость ПЖ, а во время диастолы — в сторону ЛЖ.
Наконец, косвенно о нарушении функции ПЖ можно судить также по размерам ПП, которое обычно хорошо визуализируется из парастернального доступа по короткой оси на уровне основания сердца; из апикальной четырехкамерной позиции и из субкостального доступа по длинной и короткой осям. В норме ПП и ЛП в этих позициях имеют примерно одинаковые размеры. Дилатация ПП приводит к доминированию его изображения.
Следует добавить, что систолическая дисфункция ПЖ может быть оценена по степени коллабирования нижней полой вены во время вдоха. В норме на высоте глубокого вдоха коллабирование нижней полой вены составляет примерно 50%. Недостаточное ее спадение на вдохе указывает на повышение давления в ПП и в венозном русле большого круга кровообращения.
3. Диагностика легочной артериальной гипертензии необходима для оценки тяжести течения и прогноза хронического ЛС. С этой целью используется допплеровское исследование формы потока крови в выносящем тракте ПЖ и в устье клапана легочной артерии. При нормальном давлении в легочной артерии форма потока крови приближается к куполообразной и симметричной, а при легочной гипертензии становится треугольной или двухпиковой (см. рис. 2.35).
Количественное определение систолического давления в легочной артерии (СДЛА) возможно при использовании постоянно-волнового допплеровского исследования трикуспидальной регургитации, а диастолического давления — при оценке максимальной скорости диастолической регургитации крови из легочной артерии в ПЖ. Методика эхокардиографического определения систолического, диастолического и среднего давления в легочной артерии изложена в главе 2.
Катетеризация правых отделов сердца и легочной артерии
Катетеризация правых отделов сердца является основным методом прямого измерения давления в легочной артерии. Исследование проводят в специализированных клиниках по стандартной методике (см. главу 6), используя “плавающий” катетер Свана–Ганца. Катетер вводится через внутреннюю яремную, наружную яремную, подключичную или бедренную вену в правое предсердие, затем в правый желудочек и легочную артерию, измеряя давление в этих камерах сердца. Когда катетер находится в одной из ветвей легочной артерии, баллончик, расположенный на конце катетера, раздувают. Кратковременная окклюзия сосуда позволяет измерять давление окклюзии легочной артерии (давление заклинивания — ДЗЛА), которое примерно соответствует давлению в легочных венах, ЛП и конечно-диастолическому давлению в ЛЖ.
При катетеризации полостей сердца и легочной артерии у больных хроническим ЛС выявляют достоверные признаки легочной гипертензии — значения давления в легочной артерии больше 25 мм рт. ст. в покое или больше 35 мм рт. ст. при нагрузке. При этом остается нормальным или даже пониженным давление заклинивания легочной артерии (ДЗЛА) — не больше 10–12 мм рт. ст. Напомним, что для больных с левожелудочковой недостаточностью или пороками сердца, сопровождающимися венозным застоем крови в легких, повышенное давление в легочной артерии сочетается с повышением ДЗЛА до 15–18 мм рт. ст. и выше.
Исследование функции внешнего дыхания
Как было показано выше, в основе возникновения легочной АГ и формирования хронического ЛС в большинстве случаев лежат нарушения функции внешнего дыхания, ведущие к развитию альвеолярной гипоксии и легочной артериальной гипоксемии. Поэтому тяжесть течения, прогноз и исходы хронического ЛС, а также выбор наиболее эффективных способов лечения этого заболевания во многом определяются характером и выраженностью нарушений функции легких. В связи с этим основными задачами исследования функции внешнего дыхания (ФВД) у больных ЛС являются:
-
диагностика нарушений функции внешнего дыхания и объективная оценка тяжести дыхательной недостаточности;
-
дифференциальная диагностика обструктивных и рестриктивных расстройств легочной вентиляции;
-
обоснование патогенетической терапии дыхательной недостаточности;
-
оценка эффективности проводимого лечения.
Эти задачи решаются с помощью ряда инструментальных и лабораторных методов исследования: спирометрии, спирографии, пневмотахографии, тестов на диффузионную способность легких и др.
Наиболее информативными показателями ФВД, которые используются для оценки функционального состояния легких у больных хроническим ЛС, являются следующие:
1. Общая емкость легких (ОЕЛ).
2. Жизненная емкость легких (ЖЕЛ).
3. Остаточный объем легких (ООЛ).
4. Функциональная остаточная емкость (ФОЕ).
5. Объем форсированного выдоха за первую секунду (ОФВ1).
6. Индекс Тиффно (ОФВ1/ФЖЕЛ, %) — отношение объема форсированного выдоха за первую секунду (ОФВ1, или FEV1) к форсированной жизненной емкости легких (ФЖЕЛ, или FVC).
7. Максимальная объемная скорость выдоха на уровне 25%, 50% и 75% форсированной жизненной емкости легких (МОС25%, МОС50%, МОС75%).
8. Средняя объемная скорость выдоха на уровне 25–75% от ФЖЕЛ (СОС25–75%).
9. Пиковая объемная скорость выдоха (ПОСвыд).
Способы определения этих и некоторых других показателей ФВД, а также интерпретация выявляемых изменений, подробно обсуждаются в последующих главах руководства.
|
13.5. Лечение |
|
|
В основе лечения больных с хроническим ЛС лежат мероприятия, направленные, прежде всего, на предотвращение легочной АГ и правожелудочковой недостаточности. Это возможно только при активном воздействии на основной патологический процесс в легких, приведший к возникновению ЛС. Успех лечения зависит в первую очередь от улучшения альвеолярной вентиляции, коррекции артериальной гипоксемии, гиперкапнии и ацидоза. Воздействие на эти, главные, звенья патогенеза ЛС в большинстве случаев уменьшает напряженность гипоксической легочной вазоконстрикции и способствует снижению давления в легочной артерии даже на стадии декомпенсированного ЛС.
Коррекция легочной артериальной гипоксемии
Наиболее эффективными методами коррекции альвеолярной вентиляции и газового состава крови у большинства больных ЛС являются:
-
ингаляция кислорода;
-
применение бронхолитиков;
-
применение антибиотиков.
1. Ингаляция кислорода является одним из наиболее эффективных методов коррекции артериальной гипоксемии и гиперкапнии. Она позволяет восстанавливать поврежденные при дыхательной недостаточности функции ЦНС, печени, почек; устраняет метаболический ацидоз, уменьшает катехоламинемию, улучшает механические свойства самих легких и т.п.
Показаниями для назначения кислородотерапии являются следующие клинические симптомы, возникающие у больного с дыхательной недостаточностью (А.П. Зильбер):
-
выраженный цианоз;
-
тахипноэ;
-
тахикардия или брадикардия;
-
системная артериальная гипотензия или гипертензия;
-
признаки метаболического ацидоза;
-
признаки артериальной гипоксемии (парциальное давление кислорода в артериальной крови — РаО2 — ниже 65 мм рт. ст.).
В стационарах для ингаляции кислорода обычно используют носовой катетер, что создает меньше дискомфорта для пациента, позволяя ему говорить, принимать пищу, кашлять и т.д. При этом во вдыхаемой смеси создается достаточно безопасная концентрация кислорода, не превышающая 40%. Это позволяет длительно, на протяжении нескольких дней или даже недель, осуществлять оксигенотерапию, не опасаясь развития ее осложнений. В некоторых случаях оксигенотерапию проводят с помощью лицевой маски, которая обеспечивает более высокую концентрацию кислорода. Нельзя использовать для оксигенотерапии вдыхание 100% кислорода, так как это способствует угнетению дыхательного центра и развитию гиперкапнической комы. Следует также помнить, что при ингаляции кислорода требуется обязательное увлажнение вдыхаемой кислородной смеси.
Продолжительность оксигенотерапии зависит от тяжести состояния больного и колеблется от 60 мин 3–4 раза в день до 14–16 ч в сутки. В некоторых случаях эффект может быть получен только через 3–4 недели ежедневной оксигенотерапии.
Для получения кислорода могут использоваться так называемые концентраторы (пермеаторы), выделяющие кислород из воздуха. Они позволяют добиться концентрации кислорода во вдыхаемой смеси около 40–50% и могут использоваться в домашних условиях при необходимости длительной (в течение нескольких месяцев) оксигенотерапии.
При неэффективности самостоятельного дыхания кислородом и парциальном давлении СО2 в артериальной крови (РСО2) более 60 мм рт. ст. целесообразно использовать методы искусственной вспомогательной вентиляции легких.
В настоящее время доказана способность длительной оксигенотерапии эффективно снижать давление в легочной артерии, уменьшать признаки дыхательной и сердечной недостаточности и достоверно увеличивать продолжительность жизни больных с хроническим ЛС.
2. Улучшение бронхиальной проходимости является вторым обязательным условием снижения артериальной гипоксемии и гиперкапнии. В зависимости от характера основного патологического процесса в легких применяют различные бронходилататоры, отхаркивающие средства и муколитики.
Бронхолитики по механизмам действия делят на три группы:
-
стимуляторы b-адренергических рецепторов (сальбутамол, беротек, изадрин, алупент);
-
холинолитики (атровент, тровентол);
-
метилксантины (теофиллин, теопек, теодур и др.).
Применяются и комбинированные препараты: беродуал (беротек + атровент), эудур (теофиллин + тербуталин) и др.
Коррекция мукоцилиарного клиренса также оказывает существенное влияние на бронхиальную проходимость, вентиляцию легких и газовый состав крови. Перспективными считают лекарственные средства, улучшающие слизеобразование и стимулирующие образование сурфактанта (бромгексин), муколитики (калия йодид), щелочные ингаляции и т.п.
Выбор каждого из этих лекарственных средств зависит от характера основного патологического процесса в легких и должен учитывать возможность побочных эффектов, а также конкретные показания и противопоказания к назначению этих препаратов, подробно изложенные в последующих главах.
3. Антибиотики остаются основным этиологическим средством лечения бронхолегочной инфекции у больных хроническим ЛС. Адекватно подобранная неспецифическая антибактериальная терапия в большинстве случаев приводит к уменьшению воспалительной реакции в бронхиальном дереве и легочной ткани, восстановлению вентиляции в легких и уменьшению легочной артериальной гипоксемии. Лечение проводится с учетом лекарственной чувствительности флоры возможных побочных эффектов, в том числе кардиотоксического действия антибиотиков (см. ниже).
|
Длительная оксигенотерапия, адекватное применение бронходилататоров и антибиотиков способствует уменьшению признаков дыхательной и сердечной недостаточности и удлиняет жизнь больных ЛС. Уменьшение артериальной гипоксемии, гиперкапнии и ацидоза способствует снижению вазоконстрикции легочных артериол и давления в легочной артерии. |
Коррекция легочного сосудистого сопротивления
Вторым направлением лечения больных с хроническим ЛС является применение некоторых медикаментозных средств, снижающих повышенное легочное сосудистое сопротивление (величину постнагрузки на ПЖ), приток крови к правым отделам сердца (уменьшение преднагрузки), объем циркулирующей крови (ОЦК) и давление в легочной артерии. С этой целью используют следующие препараты:
-
блокаторы медленных кальциевых каналов;
-
ингибиторы АПФ;
-
нитраты;
-
a1-адреноблокаторы и некоторые другие лекарственные средства.
1. Блокаторы медленных кальциевых каналов (антагонисты кальция). Их эффективность при легочной АГ продемонстрирована в некоторых краткосрочных клинических и экспериментальных исследованиях (S. Rich, B. Brundage). Показано, что антагонисты кальция способствуют не только снижению тонуса сосудов малого круга кровообращения, но и расслаблению гладкой мускулатуры бронхов, уменьшают агрегацию тромбоцитов и повышают устойчивость миокарда к гипоксии.
Дозы антагонистов кальция подбирают индивидуально, в зависимости от величины давления в легочной артерии и переносимости препаратов. При умеренном повышении давления в легочной артерии, например, у больных с ЛС, развившемся на фоне хронических обструктивных болезней легких (ХОБЛ) или рецидивирующей тромбоэмболии, антагонисты кальция назначают в средних терапевтических дозах:
-
нифедипин — 60–80 мг в сутки;
-
дилтиазем — 360–420 мг в сутки;
-
исрадипин (ломир) 5–10 мг в сутки.
Значительное повышение давления в легочной артерии у больных с первичной легочной гипертензией требует применения более высоких доз антагонистов кальция:
-
нифедипин — 100–120 мг в сутки;
-
дилтиазем — до 600 мг в сутки;
-
исрадипин (ломир) до 20 мг в сутки.
Лечение начинают с минимальных переносимых доз препаратов, постепенно увеличивая их каждые 4–6 дней под контролем клинической картины заболевания, давления в легочной артерии и системного АД. Лечение проводят длительно, на протяжении 5–6 недель, если не возникают побочные эффекты препаратов. Тем не менее в 30–40% случаев такое лечение оказывается неэффективным, что нередко указывает на наличие необратимых органических изменений сосудистого русла.
В целом применение антагонистов кальция у больных ЛС требует осторожности, в первую очередь, из-за возможного критического снижения системного АД и некоторых других нежелательных эффектов этих лекарственных средств.
2. Ингибиторы АПФ. Эти препараты, обладающие уникальными фармакологическими свойствами, в последние годы все шире используются для лечения больных с хроническим ЛС, прежде всего пациентов с признаками сердечной декомпенсации. Воздействие ингибиторов АПФ на легочное сосудистое сопротивление объясняется несколькими важными эффектами, подробно рассмотренными в главе 2. Напомним, что воздействие ингибиторов АПФ на гуморальную (эндокринную) РААС и уменьшение под их влиянием образования циркулирующего АII имеет несколько важных последствий.
-
Расширение сосудов (артериол и вен), которое обусловлено, прежде всего, уменьшением сосудосуживающих влияний самого АII, а также угнетением инактивации одного из наиболее мощных вазодилататоров организма — брадикинина. Последний, в свою очередь, стимулирует секрецию эндотелиальных факторов расслабления (PGI2, NO, ЭГПФ), также обладающих выраженным вазодилатирующим и антиагрегантным эффектами. В результате происходит не только системная артериальная вазодилатация, но и снижается легочное сосудистое сопротивление. Кроме того, венозная дилатация, развивающаяся под действием ингибиторов АПФ, способствует уменьшению притока крови к правому сердцу, снижению давления наполнения и, соответственно, величины преднагрузки на ПЖ.
-
Под действием ингибиторов АПФ уменьшается синтез альдостерона в надпочечниках, что сопровождается снижением альдостеронзависимой реабсорбции Nа+ и воды в дистальных канальцах почек. Одновременно уменьшается секреция ионов К+.
-
Снижая содержание циркулирующего АII, ингибиторы АПФ уменьшают ангиотензинзависимую реабсорбцию Nа+ и воды в проксимальных канальцах. Таким образом, происходящее под действием ингибиторов АПФ уменьшение задержки Nа+ и воды также ведет к уменьшению ОЦК и величины преднагрузки.
-
Наконец, ингибиторы АПФ подавляют стимулированное ангиотензином II образование норадреналина и, соответственно, снижают активность САС.
В результате этих и некоторых других эффектов ингибиторов АПФ уменьшается величина пред- и постнагрузки на ПЖ, ОЦК и снижается повышенное давление в легочной артерии.
У больных ЛС с признаками сердечной декомпенсации ингибиторы АПФ назначают в относительно небольших дозах:
-
каптоприл 12,5–25 мг в сутки;
-
эналаприл 5–10 мг в сутки;
-
периндоприл (престариум) — 2 мг в сутки и т.д.
У больных с компенсированным ЛС рекомендуют более высокие суточные дозы препаратов:
-
каптоприл до 50–75 мг в сутки;
-
эналаприл 20–40 мг в сутки;
-
периндоприл (престариум) — 4–8 мг в сутки и т.д.
Все же следует иметь в виду, что ингибиторы АПФ оказывают выраженное дилатирующее действие, прежде всего, на сосуды большого круга кровообращения, поэтому лечение может сопровождаться системной артериальной гипотензией. Следует также учитывать и другие нежелательные эффекты препаратов и противопоказания к их использованию.
3. Нитраты. Эти препараты относятся к вазодилататорам преимущественно венозного типа. Благодаря своим фармакологическим свойствам, нитраты существенно уменьшают венозный возврат крови к правому сердцу, “разгружая” малый круг кровообращения и снижая тем самым давление в легочной артерии. Чаще используют пролонгированные препараты изосорбид-динитрата или изосорбид-5-мононитрата, предназначенные для приема внутрь (см. главу 5).
Применение нитратов оказывается эффективным примерно у половины больных с хроническим ЛС, хотя у части больных может развиваться артериальная гипотензия или толерантность к приему препаратов (подробнее см. главу 4).
4. a1-адреноблокаторы. Действие этих веществ заключается в селективной блокаде a1-адренорецепторов гладкомышечных клеток сосудов, что способствует значительной артериолярной и венозной вазодилатации, снижению ОПСС и легочного сосудистого сопротивления. Кроме того, дилатация вен сопровождается депонированием крови в емкостных сосудах, уменьшением притока крови к сердцу и величины преднагрузки на ПЖ.
Учитывая возможность тяжелых гипотензивных (в том числе ортостатических) реакций при приеме a1-адреноблокаторов, для лечения больных хроническим ЛС рекомендуют использовать минимальные суточные дозы этих препаратов. С этой целью лучше использовать новый высокоспецифичный a1-адреноблкатор доксазозин, который в отличие от празозина может приниматься 1 раз в сутки в дозе 0,5–2 мг. Помимо выраженного вазодилатирующего действия, доксазозин снижает агрегацию тромбоцитов и повышает фибринолитическую активность крови, а также благоприятно действует на липидный профиль, повышая содержание ЛВП и снижая ХС ЛНП и триглицериды.
Следует все же иметь в виду, что длительное применение у больных ЛС a1-адреноблокаторов в реальной клинической практике часто наталкивается на серьезные трудности, в основном из-за побочных эффектов этих препаратов. Лучшие результаты получают у больных с сопутствующей эссенциальной АГ.
Критически оценивая результаты лечения вазодилататорами больных хроническим ЛС, необходимо отметить следующее. Несмотря на то что при однократном применении этих препаратов в большинстве случаев удается достоверно снизить давление в легочной артерии, эффективность курсового назначения этих лекарственных средств все же существенно ниже, чем эффективность длительной низкопоточной оксигенотерапии и/или адекватного противовоспалительного лечения бронхолегочных заболеваний. Пока не получено убедительных доказательств того, что длительное лечение вазодилататорами увеличивает продолжительность и улучшает качество жизни больных хроническим ЛС.
Следует также помнить, что в отдельных случаях применение вазодилататоров может даже усугублять нарушения газообмена в легких. Например, эффективное снижение тонуса легочных артериол и увеличение кровотока в участках легких, пораженных воспалительным или фиброзирующим процессом, иногда может ухудшать вентиляционно-перфузионные соотношения в этих областях, особенно, если терапия вазодилататорами не подкрепляется адекватной коррекцией нарушений легочной вентиляции. Это приводит к усугублению артериальной гипоксемии и активирует механизм гипоксической легочной вазоконстрикции. В результате давление в легочной артерии может повыситься еще больше.
В некоторых случаях уменьшение легочного сосудистого сопротивления, наступающее под действием вазодилататоров, и снижение величины постнагрузки на ПЖ могут сопровождаться увеличением МО (естественно, при сохраненной систолической функции ПЖ), что является одним из факторов, способствующих повышению давления в легочной артерии. Этому способствует также рефлекторная тахикардия, развивающаяся при лечении некоторыми вазодилататорами. Наконец, следует также иметь в виду возможность критического падения системного АД под действием этих препаратов.
Таким образом, лечение антагонистами кальция, ингибиторами АПФ, нитратами и a1-адреноблокаторами больных хроническим ЛС следует проводить с большой осторожностью, желательно под контролем не только системного АД и ЧСС, но и давления в легочной артерии, ОЦК и функционального состояния легких. Применение этих лекарственных средств имеет смысл только на фоне адекватной коррекции нарушений легочной вентиляции и лечения бронхолегочных заболеваний.
|
1. У больных с хроническим ЛС с целью снижения легочного сосудистого сопротивления и давления в легочной артерии могут использоваться вазодилататоры: блокаторы медленных кальциевых каналов, ингибиторы АПФ, нитраты и a1-адреноблокаторы. 2. Применение вазодилататоров у больных с хроническим ЛС требует большой осторожности и адекватного контроля за гемодинамикой и функциональным состоянием легких, поскольку в некоторых случаях назначение этих лекарственных средств может ухудшить вентиляционно-перфузионные соотношения в легких, что способствует росту давления в легочной артерии. 3. Лечение вазодилататорами должно сопровождаться адекватной коррекцией нарушений легочной вентиляции и лечением бронхолегочных заболеваний (длительная оксигенотерапия, применение антибиотиков, бронхолитиков и т.п.). Без такой комплексной терапии длительное применение вазодилататоров у больных ХОБЛ и ЛС практически не влияет на продолжительность и качество жизни больных. |
Коррекция гемореологических нарушений и агрегации тромбоцитов
Повышение вязкости крови, агрегации тромбоцитов и свертываемости крови, характерное для больных хроническим ЛС, оказывает существенное влияние на легочное сосудистое сопротивление и прогноз. Кроме того, в тяжелых случаях эти нарушения ведут к развитию вторичных тромбозов мелких ветвей легочной артерии, что также способствует прогрессированию легочной АГ. Это оправдывает использование некоторых способов коррекции гемореологических нарушений и повышенной агрегации тромбоцитов, особенно у пациентов с высокими цифрами давления в легочной артерии. К числу таких методов относятся:
-
Кровопускание по 200–300 мл крови. Оно показано при увеличении гематокрита больше 55–60% и высоком давлении в легочной артерии. Хотя однократное кровопускание на время улучшает состояние больного, повторные процедуры редко приводят к стабилизации уровня давления в легочной артерии.
-
Низкомолекулярные гепарины. Лечение низкомолекулярными гепаринами (например, фраксипарином по 0,6 2 раза в сутки подкожно) в первую очередь показано больным ЛС, развившемся на фоне рецидивирующей тромбоэмболии мелких ветвей легочной артерии. В поддерживающих дозах фраксипарин может использоваться у больных ЛС до 3–6 месяцев. Менее эффективным оказывается назначение гепарина по 5000 ЕД 2 раза в день подкожно.
Реополиглюкин внутривенно капельно по 200–400 мл 2 раза в неделю.
Трентал внутрь по 100–400 мг 2–3 раза в день.
Особенности лечения правожелудочковой недостаточности
При развитии декомпенсированного ЛС с признаками правожелудочковой недостаточности применяют диуретики, ингибиторы АПФ и в некоторых случаях — сердечные гликозиды.
Диуретики показаны при появлении клинических признаков правожелудочковой недостаточности, в частности, при наличии отечного синдрома и высоких значений ОЦК. Обычно используют сильнодействующие петлевые диуретики (подробнее — см. главу 2). Эти препараты целесообразно сочетать с приемом калийсберегающих диуретиков или антагонистов альдостерона (альдактона, верошпирона и др.). Лечение начинают с малых суточных доз. Дозу препарата подбирают индивидуально. Медленное постепенное увеличение дозы мочегонных (“титрование дозы”) в большинстве случаев позволяет избежать резкого уменьшения ОЦК и снижения системного АД.
Следует также помнить, что неконтролируемое применение мощных диуретиков у больных ЛС может вызвать метаболический алкалоз, который способствует усугублению гиперкапнии. Последняя, как известно, снижает чувствительность дыхательного центра к СО2, что ведет к еще большему ухудшению легочной вентиляции и, как следствие, к возрастанию давления в легочной артерии.
Сердечные гликозиды. Необходимость применения этих лекарственных средств у больных декомпенсированным ЛС ограничена, прежде всего, случаями, осложненными фибрилляцией предсердий и сопутствующей левожелудочковой недостаточностью (например, у пациентов, страдающих ИБС). Используют, как правило, малые дозы гликозидов, например, дигоксин по 0,25 мг 1 раз в день.
В остальных случаях сердечные гликозиды у больных ЛС, как правило, малоэффективны, поскольку они не воздействуют на основной механизм развития легочной АГ — легочное сосудистое сопротивление. Мало того, увеличение под действием сердечных гликозидов ударного выброса ПЖ является фактором, повышающим уровень давления в легочной артерии. Следует также учитывать, что лечение сердечными гликозидами больных хроническим ЛС особенно часто сопровождается развитием гликозидной интоксикации и нарушениями сердечного ритма. Поэтому на длительный срок эти лекарственные средства больным, как правило, не назначаются.
Ингибиторы АПФ. Длительное применение этих лекарственных препаратов у больных с декомпенсированным ЛС в целом имеет большие преимущества перед другими способами лечения правожелудочковой недостаточности. Ингибиторы АПФ способны оказывать влияние не только на основные звенья патогенеза сердечной недостаточности, вызывая гемодинамическую и нейрогормональную “разгрузку” сердца, но и положительно влиять на уровень давления в легочной артерии (см. выше). Имеются сообщения о том, что длительное применение ингибиторов АПФ у больных декомпенсированным ЛС сопровождается замедлением прогрессирования сердечной недостаточности, снижением летальности, улучшением прогноза и качества жизни больных.
Механизмы положительного влияния ингибиторов АПФ на состояние больных с сердечной недостаточностью подробно обсуждались в главе 2. Напомним, что эффективность применения этих препаратов при сердечной декомпенсации связана, прежде всего, с устранением активации тканевых РАС и выражается в следующих положительных реакциях:
замедление процессов ремоделирования сердца, сосудов и других органов;
обратное развитие гипертрофии миокарда желудочков;
предотвращение прогрессирования дилатации ПЖ;
замедление формирования интерстициального фиброза миокарда;
снижение диастолической ригидности ПЖ.
Кроме того, ингибиторы АПФ, воздействуя на гуморальную (эндокринную) РААС и угнетая образование циркулирующего ангиотензина II, способствуют выраженной гемодинамической разгрузке сердца и снижению величины пред- и постнагрузки на ПЖ. Эти эффекты ингибиторов АПФ обеспечиваются:
-
системной вазодилатацией артериол (уменьшение постнагрузки) и вен (уменьшение преднагрузки);
-
уменьшением синтеза альдостерона в надпочечниках и снижением реабсорбции Nа+ и воды в дистальных канальцах почек (снижение ОЦК и величины преднагрузки);
-
уменьшением активности САС.
Применение ингибиторов АПФ у больных декомпенсированным ЛС требует соблюдения тех же принципов лечения, рекомендованных Европейским обществом кардиологов (1997), которые были изложены в главе 2. Для лечения используют современные препараты II и III поколений, начальные и поддерживающие дозы которых представлены в табл. 13.2.
Таблица 13.2
Начальная и поддерживающая дозы ингибиторов АПФ при лечении больных декомпенсированным легочным сердцем
|
Препарат |
Начальная доза, мг в сутки |
Поддерживающая доза, мг в сутки |
|
Беназеприл |
2,5 |
до 5–10 |
|
Каптоприл |
18,75 (в 3 приема) |
до 50–75 (в 3 приема) |
|
Эналаприл |
2,5 |
до 10–20 (в 2 приема) |
|
Лизиноприл |
2,5 |
до 5–20 (1 раз в сутки) |
|
Квинаприл |
2,5–5 |
до 10–20 (в 2 приема) |
|
Периндоприл |
2 |
4 |
|
Рамиприл |
1,25–2,5 |
2,5–5 |
При длительном лечении ингибиторами АПФ необходимо также учитывать возможные побочные эффекты этих препаратов и соблюдать описанные ранее меры предосторожности (см. главу 2).
Таким образом, комплексное лечение больных хроническим ЛС должно предусматривать адекватную терапию основного заболевания, коррекцию легочной артериальной гипоксемии, воздействие на гемореологические показатели, агрегацию тромбоцитов и свертываемость крови, гемодинамическую и нейрогормональную “разгрузку” сердца и острожное применение вазодилататоров, снижающих давление в легочной артерии.
Прогноз
Прогноз в большинстве случаев зависит от характера и тяжести основного заболевания бронхолегочной системы. Наиболее серьезный прогноз имеют пациенты с первичной легочной АГ и рецидивирующими тромбоэмболиями мелких ветвей легочной артерии. Продолжительность жизни больных декомпенсированным ЛС с признаками прогрессирующей правожелудочковой недостаточности и отечным синдромом обычно не превышает 2,5–5 лет.
|
Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце |
|
|
Тромбоэмболия легочной артерии (ТЭЛА) — это окклюзия просвета основного ствола или ветвей легочной артерии частичками тромба, сформировавшегося в венах большого круга кровообращения или полостях правого сердца, переносимыми в малый круг кровообращения с током крови. Механическая закупорка ствола или ветвей легочной артерии тромбоэмболом сопровождается генерализованным спазмом легочных артериол, что приводит к резкому ограничению кровотока в легких.
ТЭЛА — распространенное и прогностически весьма неблагоприятное осложнение различных заболеваний, травм и оперативных вмешательств. ТЭЛА занимает третье место среди причин смерти населения (после других сердечно-сосудистых заболеваний и злокачественных новообразований). На аутопсии ее выявляют в 7–10% случаев всех патологоанатомических вскрытий. Причем легочная тромбоэмолия при жизни не диагностируется более чем у 1/2 больных. Летальность при возникновении ТЭЛА составляет около 30%, хотя на фоне адекватной и своевременно начатой терапии она снижается до 10%.
|
14.1. Этиология |
|
|
Наиболее частой причиной ТЭЛА является острый тромбоз глубоких вен илеофеморального сегмента. Гораздо реже источником ТЭЛА служат тромбозы глубоких вен голеней. К относительно редким причинам ТЭЛА относятся тромбозы венозных сплетений таза, пристеночные тромбы в полостях правого сердца. Тромбофлебиты поверхностных вен почти никогда не осложняются ТЭЛА.
Следует отметить, что ТЭЛА развивается не во всех случаях острого тромбоза глубоких вен. Например у больных с тромбозами илеофеморальных вен ТЭЛА возникает в половине случаев, а при тромбозе глубоких вен голеней — только в 1–5% случаев. Отрываются и переносятся с током крови в малый круг кровообращения главным образом так называемые флотирующие тромбы, имеющие единственную точку фиксации в своем дистальном отделе. Длина таких тромбов достигает иногда 15–20 см. При тромбах, окклюзирующих просвет сосуда, ТЭЛА не развивается.
В таблице 14.1 перечислены основные факторы, способствующие возникновению тромбоза магистральных вен и, соответственно, ТЭЛА. В первую очередь к ним относятся злокачественные новообразования (около 30% случаев ТЭЛА), которые, как известно, сопровождаются синдромом гиперкоагуляции и угнетением системы фибринолиза.
Одним из ведущих факторов, способствующих тромбообразованию в глубоких венах нижних конечностей, является гиподинамия. Значительное уменьшение работы мышц нижних конечностей приводит к замедлению кровотока в венах, что способствует образованию там тромбов. Особенно опасна гиподинамия у лиц пожилого и старческого возраста, у больных, вынужденных соблюдать постельный режим (ИМ, инсульт, ХСН, переломы костей и т.п.) или страдающих хронической венозной недостаточностью нижних конечностей. Нередко ТЭЛА осложняет течение послеоперационного периода (операции на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно если имеются гнойные осложнения этих операций.
Таблица 14.1
Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей
|
Злокачественные новообразования |
|
Гиподинамия, в том числе необходимость соблюдения постельного режима |
|
Переломы костей или травмы ног |
|
Хирургические вмешательства, в первую очередь на органах брюшной полости и нижних конечностях |
|
Пожилой и старческий возраст |
|
Хроническая сердечная недостаточность |
|
Ожирение |
|
Сахарный диабет |
|
Прием пероральных контрацептивов |
|
Хроническая венозная недостаточность нижних конечностей |
|
Первичные гиперкоагуляционные состояния |
|
Эритремия |
|
Системная красная волчанка |
|
Наследственные факторы (дефицит антитромбина III, протеинов С и S, дисфибриногенемия, гомоцистеинурия и др.) |
|
1. Около 70% случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Тромбофлебит поверхностных вен почти никогда не сопровождается ТЭЛА. 2. К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся:
|
14.2. Патогенез
|
14.2.1. Механизмы обструкции легочно-артериального русла |
|
|
Патогенез гемодинамических и вентиляционных расстройств при ТЭЛА чрезвычайно сложен (рис. 14.1). Ведущим фактором в генезе гемодинамических расстройств при ТЭЛА является механическая обструкция легочно-артериального русла. Причем тромб, оторвавшийся от места своего образования, например в глубоких венах нижних конечностей, и переносимый с током крови в малый круг кровообращения, частично разрушается. Поэтому в большинстве случаев имеет место множественная окклюзия нескольких ветвей легочной артерии разного калибра, часто двусторонняя (немассивная ТЭЛА). В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола легочной артерии, которая, как правило, сопровождается острым (без предвестников) развитием тяжелейшей клинической картины тромбоэмболии, в том числе быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви легочной артерии.
|
|
|
Рис. 14.1. Схема патогенеза острого легочного сердца при тромбоэмболии легочной артерии |
Наряду с механической частичной или полной закупоркой легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга, во многом обусловленный высвобождением из тромбоцитов, оседающих на поверхности тромбоэмбола, вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и др.). В результате легочное сосудистое сопротивление возрастает в еще большей степени. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Следует также помнить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола в проксимальном направлении, т.е. против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную (рис. 14.2).
|
Ведущим фактором, определяющим степень гемодинамических расстройств и нарушения вентиляционно-перфузионных соотношений при ТЭЛА, является обструкция легочно-артериального русла, степень которой зависит от:
В результате этих патологических процессов немассивная ТЭЛА может трансформироваться в массивную. |
|
Рис. 14.2. Увеличение окклюзии ветви легочной артерии за счет вторичного тромбозирования эмбола. а — первоначальная эмболия одной из мелких ветвей ЛА; б — образование вторичного местного тромба, увеличивающего размеры обструкции ветвей ЛА |
|
|
|
14.2.2. Гемодинамические последствия тромбоэмболии легочной артерии |
|
|
|
|
|
|
Полное или частичное прекращение легочного кровотока в результате тромбоэмболии легочной артерии приводит к двум основным следствиям, определяющим клиническую картину заболевания и судьбу больного (рис. 14.3):
1. Выраженному нарушению вентиляционно-перфузионных отношений, что приводит к возникновению дыхательной недостаточности и артериальной гипоксемии.
2. Формированию легочной артериальной гипертензии, которая, в свою очередь, является причиной резкого падения МО и системного АД, а также к развитию острой правожелудочковой недостаточности (острого легочного сердца).
Дыхательная недостаточность и артериальная гипоксемия возникают, прежде всего, в результате прекращения кровотока в хорошо вентилируемых альвеолах, что приводит к увеличению внутрилегочного “мертвого пространства” и ухудшению газообмена. Нарушение вентиляционно-перфузионных отношений усугубляется выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяющихся из тромбоцитов (тромбоксан А2, серотонин и др.). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже спустя 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции хорошо перфузируемых альвеол еще больше нарушает газообмен в легких и приводит к усугублению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее области окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также усугубляет артериальную гипоксемию.
Вторым следствием окклюзии ветвей легочной артерии является легочная АГ. Она обусловлена как самой механической окклюзией сосудистого русла тромбоэмболом, так и генерализованным спазмом легочных артериол. В результате повышается легочное сосудистое сопротивление на фоне значительного уменьшения емкости артериального русла. Это приводит к значительному ограничению венозного притока крови в левые отделы сердца и развитию синдрома малого сердечного выброса: уменьшаются МО, СИ, уровень АД, нарушается кровоснабжение жизненно важных органов (головного мозга, сердца, почек). В тяжелых случаях могут развиться признаки так называемого обструктивного шока, включая потерю сознания (синкопе), значительное снижение АД, уменьшение диуреза, стенокардию и т.д.
|
Рис. 14.3. Схема гемодинамических расстройств при тромбоэмболии легочной артерии |
|
Кроме того, значительные цифры давления в легочной артерии и увеличение постнагрузки на ПЖ может приводить к быстрому развитию острого легочного сердца. Повышается систолическое и конечно-диастолическое давление в ПЖ, ПП, желудочек и предсердие дилатируются и возникает застой крови в венозном русле большого круга кровообращения.
|
Для острой ТЭЛА характерно два нарушения гемодинамики и альвеолярной вентиляции: 1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного “мертвого пространства”; бронхоспазм; развитие ателектазов; ишемия легкого и снижение вентиляции; артериоло-венозное шунтирование крови. 2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
синдром малого сердечного выброса, сопровождающийся снижением МО, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек); острая правожелудочковая недостаточность с подъемом КДД ПЖ, ЦВД и (в тяжелых случаях) застоем крови в венах большого круга кровообращения. |
Следует подчеркнуть, что далеко не всегда при ТЭЛА присутствуют все описанные нарушения гемодинамики и альвеолярной вентиляции. Это зависит прежде всего от массивности тромбоэмболии, а также от локализации тромбоэмбола. Наиболее яркие клинические проявления ТЭЛА возникают, когда острое ограничение легочного кровотока достигает 60% от объема всего сосудистого русла легких.
|
14.3. Клиническая картина |
|
|
Клиническая картина заболевания определяется объемом эмболизации легочного сосудистого русла, локализацией тромбоэмбола, уровнем легочной АГ, степенью гемодинамических расстройств и другими факторами.
С практической точки зрения очень удобно деление ТЭЛА на два варианта:
-
массивную и субмассивную ТЭЛА;
-
немассивную ТЭЛА.
Массивная и субмассивная ТЭЛА обусловлена тотальной или субтотальной окклюзией крупной проксимальной ветви или ствола легочной артерии; протекает остро, с бурной клинической симптоматикой и часто заканчивается внезапной смертью. Считают, что в отдельных случаях массивная ТЭЛА может развиться в результате распространенной множественной эмболии более мелких ветвей легочной артерии вследствие предшествующих изменений в легких. Немассивная ТЭЛА связана с эмболией мелких ветвей легочной артерии.
|
14.3.1. Массивная и субмассивная ТЭЛА |
|
|
Клиническая картина тромбоэмболии ствола или крупных ветвей легочной артерии в большинстве случаев характеризуется острым началом заболевания, бурным прогрессированием симптомов эмболии, развитием дыхательной и правожелудочковой недостаточности, падением АД и нарушением перфузии внутренних органов.
|
Массивная и субмассивная ТЭЛА, если она не приводит к быстрому летальному исходу, может сопровождаться развитием нескольких синдромов:
дыхательной недостаточности; инфаркта легкого или инфарктной пневмонии; плеврита (сухого или экссудативного, в том числе геморрагического); острого легочного сердца; артериальной гипотонии; нарушением перфузии внутренних органов. |
Жалобы
Массивная ТЭЛА, как правило, начинается с внезапного появления “необъяснимой” одышки в покое. Число дыхательных движений увеличивается до 20–30 в мин и более. Столь же часто (примерно в 85–90% случаев) появляются боли в грудной клетке. Они чаще локализуются за грудиной, напоминая ангинозные боли при ИМ. Нередко боли носят характер острых плевральных болей, усиливающихся при дыхании, кашле и обусловленных развитием инфаркта легкого, инфарктной пневмонии или сухого плеврита. Реже боли локализуются в правом подреберье и сопровождаются вздутием живота (парез кишечника) и упорной икотой, свидетельствуя, как правило, о поражении диафрагмальной плевры. У половины больных при этом возникает непродуктивный кашель. Только в случаев инфаркта легкого появляется кровохарканье, обычно в виде прожилок крови в мокроте. Примерно в 45–50% случаев отмечается повышение температуры тела выше 37° С, которое обусловлено преимущественно развитием воспалительного процесса в легких и плевре.
У половины больных с массивной ТЭЛА наблюдаются падение АД, коллапс и разнообразные церебральные расстройства (головокружения, кратковременная потеря сознания, выраженная адинамия или, наоборот, возбуждение, непроизвольное мочеиспускание или дефекация, судороги в конечностях и т.д.).
Физикальное исследование
Массивная ТЭЛА сопровождается появлением цианоза, который часто сочетается с бледностью кожных покровов, обусловленной падением АД и нарушением периферического кровообращения (спазм периферических сосудов в ответ на резкое снижение сердечного выброса). Сочетание цианоза и бледности придает кожным покровам своеобразный пепельный оттенок. В некоторых случаях появляется выраженный “чугунный” цианоз лица, области шеи и верхней половины туловища.
В легких определяются ослабленное дыхание, мелкопузырчатые влажные хрипы или крепитация, что указывает на развитие инфарктной пневмонии или инфаркта легкого. Нередко при поражении плевры можно выслушать шум трения плевры.
При исследовании сердечно-сосудистой системы определяются тахикардия более 100 уд. в мин, акцент II тона на легочной артерии, отражающий развитие гипертензии малого круга кровообращения. Характерно также снижение АД. В части случаев определяется парадоксальный пульс (см. главу 12), отражающий возникновение острой правожелудочковой недостаточности (острого легочного сердца). При выраженной систолической дисфункции ПЖ и повышении ЦВД определяются набухание шейных вен, абдоминально-югулярный рефлюкс (см. главу 2).
При развитии острого легочного сердца в V межреберье по левому краю грудины выслушивается патологический III тон (правожелудочковый протодиастолический ритм галопа). При перкуссии сердца в этих случаях можно выявить смещение вправо правой границы относительной тупости и умеренное расширение абсолютной тупости сердца.
|
14.3.2. Немассивная ТЭЛА |
|
|
Тромбоэмболия мелких ветвей легочной артерии в большинстве случаев протекает с менее выраженными симптомами или бессимптомно и нередко остается нераспознанной. Часто немассивная ТЭЛА протекает “под маской” других заболеваний и синдромов (В.Б. Яковлев):
-
повторных “пневмоний” неясной этиологии, часть которых протекает как плевропневмония;
-
быстропроходящих (в течение 2–3 суток) сухих плевритов;
-
экссудативных плевритов, в том числе геморрагических;
-
повторных “необъяснимых” обмороков, коллапсов, нередко сопровождающихся ощущением нехватки воздуха и тахикардией;
-
внезапно возникающего чувства сдавления в груди, затруднения дыхания и последующего повышения температуры тела;
-
“беспричинной” лихорадки, не поддающейся антибактериальной терапии;
-
появлением и/или прогрессированием сердечной недостаточности, резистентной к лечению;
-
появлением и/или прогрессированием симптомов подострого или хронического легочного сердца при отсутствии указаний на хронические заболевания бронхолегочного аппарата.
Следует подчеркнуть, что нередко тяжесть клинической картины заболевания не соответствует объему тромбоэмболической окклюзии. Так, эмболия мелких ветвей легочной артерии может протекать с клинически хорошо очерченными проявлениями инфаркта легкого, интенсивными плевральными болями, признаками дыхательной недостаточности и артериальной гипотонии, тогда как отдельные случаи массивной ТЭЛА могут проявляться только умеренно выраженной одышкой и тахикардией.
Важной задачей клинического и инструментального исследования больных ТЭЛА является установление источника тромбоэмболии. В то же время отчетливые клинические признаки тромбоза глубоких вен нижних конечностей — наиболее частой причины ТЭЛА — обнаруживают только в случаев. Следует помнить, что к числу ранних признаков флеботромбоза глубоких вен относятся:
-
спонтанные боли в области стопы и голени, усиливающиеся при ходьбе;
-
появление боли в икроножных мышцах при тыльном сгибании стопы (симптом Хоманса);
-
локальная болезненность при пальпации по ходу вен;
-
односторонний отек голени, стопы и бедра, выявляемый при осмотре в горизонтальном и вертикальном положении пациента (рис. 14.4).
|
Рис. 14.4. Измерение объема голени и бедра у больных с подозрением на тромбоз глубоких вен нижних конечностей |
|
Более информативным является дуплексное ультразвуковое и допплеровское исследование глубоких вен, которое в большинстве случаев позволяет выявить признаки нарушения венозного кровообращения, локализацию и протяженность тромботической окклюзии.
|
14.4. Лабораторная и инструментальная диагностика |
|
|
К числу обязательных инструментальных исследований, которые проводятся у всех больных с ТЭЛА, относятся ЭКГ, исследование газов артериальной крови, рентгенография органов грудной клетки, эхокардиограмма, вентиляционно-перфузионная сцинтиграфия легких, ультразвуковое исследование магистральных вен нижних конечностей. Большинство из них, за исключением вентиляционно-перфузионной сцинтиграфии легких, используют не столько для подтверждения диагноза ТЭЛА, сколько для исключения других заболеваний, которые протекают со сходной клинической симптоматикой (ИМ, пневмонии, плевритов, хронических обструктивных заболеваний легких, пневмоторакса и др.).
К дополнительным методам исследования относятся ангиография и катетеризация правых отделов сердца.
|
14.4.1. Электрокардиография |
|
|
Электрокардиография применяется, в основном, для исключения острого ИМ, а также диагностики нарушений сердечного ритма, которые часто обнаруживают у больных с ТЭЛА: синусовой тахикардии, фибрилляции и трепетания предсердий, суправентрикулярной и желудочковой экстрасистолии и др. (подробнее см. главу 3).
Лишь в 20–25% случаев, как правило, при массивной ТЭЛА и развитии клинической картины острого легочного сердца, наблюдаются признаки острой перегрузки ПЖ. В этих случаях значительное преобладание электрической активности ПЖ и правой половины МЖП, ведущее к резкому изменению пространственного расположения моментных векторов деполяризации желудочков, напоминает соответствующие нарушения, выявляемые при гипертрофии ПЖ. Наибольшее значение имеют следующие ЭКГ-признаки острого легочного сердца, получившие название “синдрома McGinn — White” (рис. 14.5):
|
Рис. 14.5. Электрокардиограмма при массивной тромбоэмболии легочной артерии и развитии острого легочного сердца. Объяснение в тексте |
|
-
внезапное углубление зубцов QIII и SI (признак QIIISI);
-
подъем сегмента RS–T в отведениях III, aVF, V1 и V2 и дискордантное снижение сегмента RS–T в отведениях I, aVL, V5 и V6;
-
появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
-
полная или неполная блокада правой ножки пучка Гиса.
Характерна также быстрая положительная динамика указанных изменений при купировании тромбоэмболии и улучшении состояния больного.
Довольно часто при ТЭЛА и повышении давления в легочной артерии выявляются признаки острой электрической перегрузки правого предсердия в виде остроконечных высокоамплитудных зубцов Р в отведениях III, II и aVF (P-pulmonale). После эффективного лечения ТЭЛА и нормализации давления в легочной артерии эти признаки быстро уменьшаются и исчезают.
Следует помнить, что примерно в 20–30% случаев, преимущественно при тромбоэмболии мелких ветвей легочной артерии, на ЭКГ вообще могут отсутствовать какие-либо патологические изменения.
|
14.4.2. Рентгенография органов грудной клетки |
|
|
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме малоспецифичных рентгенологических признаков:
-
высокое стояние купола диафрагмы на стороне поражения;
-
инфильтрация легочной ткани (спустя 12–36 ч от начала заболевания);
-
выбухание конуса легочной артерии;
-
увеличение правых отделов сердца;
-
расширение верхней полой вены и др.
Эти признаки лишь с определенной степенью вероятности могут быть ассоциированы с возникновением ТЭЛА, причем только в тех случаях, когда они сочетаются с описанными клиническими симптомами эмболии (внезапно наступающей одышкой, болями в грудной клетке и т.д.).
|
Рис. 14.6. Рентгенограмма легких в прямой проекции при инфаркте легкого (наблюдение Л.С. Розенштрауха с соавт.) |
|
Более специфичным, но относительно редким признаком ТЭЛА является симптом Вестермарка — обеднение легочного рисунка в области поражения, что свидетельствует о массивной эмболии легочной артерии. Этот рентгенологический признак встречается не более чем у 5% больных ТЭЛА. Довольно редко на рентгенограммах можно обнаружить классические признаки инфаркта легкого — треугольную тень в легочном поле, основанием обращенную к плевре (рис. 14.6).
Следует подчеркнуть, что отсутствие изменений на рентгенограмме грудной клетки не исключает диагноза ТЭЛА.
|
14.4.3. Ультразвуковое исследование |
|
|
Эхокардиография у больных с ТЭЛА позволяет выявить объективные признаки острого легочного сердца и повышения давления в легочной артерии, оценить гемодинамические нарушения, а также исключить патологию клапанного аппарата. Методика исследования этих параметров была подробно описана в предыдущих главах руководства.
Ультразвуковое допплеровское исследование глубоких вен нижних конечностей дает возможность объективно подтвердить наличие тромбоза вен и получить важную информацию о его локализации и распространенности. Эти данные необходимы для выбора оптимальной тактики последующего лечения (в том числе хирургического) больных, перенесших ТЭЛА. Наиболее точные данные могут быть получены при использовании дуплексного сканирования вен.
|
14.4.4. Вентиляционно-перфузионная сцинтиграфия легких |
|
|
Ведущее место в диагностике ТЭЛА занимает вентиляционно-перфузионная сцинтиграфия легких, которая представляет собой сочетание радионуклидного исследования региональных нарушений легочной вентиляции (пневмосцинтиграфии) и перфузии (пульмоносцинтиграфии). В табл. 14.2 приведены основные характеристики этих двух методов исследования.
Наибольшее значение имеет методика перфузионной пульмоносцинтиграфии с внутривенным введением микросфер альбумина, меченных 99mTc. Поскольку диаметр этих частиц не превышает 10–30 мкм, они хорошо распределяются в кровотоке и скапливаются в легочных артериолах, причем незначительная часть артериол (не более 0,1%) эмболизируется. Изображение получают с помощью гамма-камеры в шести стандартных позициях. Метод перфузионной сцинтиграфии дает возможность изучить региональную легочную гемодинамику, что может быть использовано для диагностики ТЭЛА. Он отличается высокой чувствительностью, но недостаточно специфичен, поскольку многие патологические процессы в легких сопровождаются региональным снижением перфузии (опухоли легкого, пневмонии, обструктивные заболевания легких, пневмосклероз и т.д.).
Таблица 14.2
Основные характеристики перфузионной и вентиляционной сцинтиграфии
|
Методы |
Изотоп |
Т1/2 |
Способ введения |
Возможности диагностики |
|
Перфузионная пульмоносцинтиграфия |
99mTc 133Xe |
6 ч 5 суток |
Внутривенное введение |
Изучение региональной легочной перфузии |
|
Вентиляционная пневмосцинтиграфия |
81Kr 133Xe |
13 c 5 суток |
Вдыхание газовой смеси |
Изучение региональной воздушной вентиляции |
Более достоверные результаты могут быть получены при одновременном использовании различных модификаций вентиляционного сканирования легких (пневмосцинтиграфии). Для этой цели предпочтительно применение ингаляций воздушно-газовой смеси, содержащей 81Kr с очень коротким периодом полураспада (13 с). Другие радиоактивные изотопы (133Xe и 99mTc), будучи введенными ингаляционно в виде газов (ксенон) или жидких аэрозолей (технеций), также могут использоваться для оценки региональной вентиляции. Однако более продолжительный период их полураспада требует значительного интервала времени между проведением перфузионного и вентиляционного сканирования легких.
Диагноз ТЭЛА наиболее вероятен, если при применении вентиляционного и перфузионного сканирования в двух и более сегментах легкого обнаруживается выраженное несоответствие между значительно сниженной перфузией и нормальной или мало измененной вентиляцией (рис. 14.7), а на обычной рентгенограмме в этой области не удается выявить признаков других патологических процессов, сопровождающихся локальным уменьшением кровотока (опухоль, абсцесс, полость и т.п.). В этих случаях вероятность тромбоэмболии ветвей легочной артерии достигает 90% [J. Rees].
В противоположность этому, если происходит одновременное снижение перфузии и вентиляции, а на рентгенограмме в этой зоне отсутствуют значительные изменения или, наоборот, выявляется обширное поражение, диагноз тромбоэмболии весьма сомнителен.
|
Наиболее достоверный признак ТЭЛА, выявляемый при анализе перфузионных и вентиляционных сканограмм, — это наличие выраженного локального снижения перфузии участка легкого при отсутствии здесь сколько-нибудь значительных вентиляционных расстройств и изменений на обычной рентгенограмме. Признак отличается высокой диагностической точностью, достигающей 90%. Отсутствие изменений на перфузионной и вентиляционной сканограммах практически полностью исключает диагноз ТЭЛА. |
|
Рис. 14.7. Перфузионная (а) и вентиляционная (б) сцинтиграммы при тромбоэмболии легочной артерии. Объяснение в тесте |
|
Если тромбоэмболия осложняется развитием инфаркта легкого, вместе со снижением перфузии, как правило, происходит локальное уменьшение вентиляции, а на рентгенограмме появляются признаки уплотнения легочной ткани.
|
14.4.5. Ангиопульмонография |
|
|
Ангиография сосудов легких (селективная ангиопульмонография) является эталонным методом диагностики ТЭЛА. Информативность этого метода приближается к 100%, в том числе при эмболии мелких ветвей легочной артерии.
Селективная ангиопульмонография — это рентгенологический метод исследования сосудов легких и легочного кровотока, при котором контрастное вещество (уротраст, верографин, урографин и др.) вводится с помощью катетеров непосредственно в сосудистое русло. Для введения рентгеноконтрастного вещества в ствол легочной артерии, левую, правую или концевые (терминальные) ветви легочной артерии производят чрескожную катетеризацию бедренной вены по Сельдингеру и проводят катетер через правое предсердие и правый желудочек в легочную артерию и ее ветви. Для контрастирования бронхиальных или добавочных артерий большого круга кровообращения применяют ретроградную катетеризацию бедренной артерии. Методика и техника венозной и артериальной катетеризации подробно описаны в главах 4 и 6.
Таким образом, селективная ангиопульмонография дает возможность получить максимальную информацию об анатомическом и функциональном состоянии сосудов легких. Наиболее общими показаниями для использования этого метода являются:
1. Тромбоэмболия ветвей легочной артерии, особенно в тех случаях, когда другие методы исследования (например, радионуклидные) дают сомнительные результаты, а антикоагулянтная или тромболитическая терапия чревата повышенным риском кровотечений (J. Rees).
2. Рецидивирующее кровохарканье или легочное кровотечение, генез которых не удается выяснить с помощью обычных методов клинико-инструментального исследования больного.
3. Подозрение на врожденную аномалию легкого или легочных сосудов, когда от точности установления диагноза зависит выбор наиболее рационального метода лечения, включая оперативное вмешательство.
4. Уточнение риска предстоящей операции при точно установленном диагнозе.
Ангиография противопоказана при тяжелом общем состоянии больного, выраженной сердечно-легочной недостаточности с признаками легочной гипертензии, при нарушениях ритма сердца, выраженной печеночно-почечной недостаточности, тромбофлебите или флеботромбозе нижних конечностей, непереносимости препаратов йода.
Исследование выполняется в специально оборудованной операционной, оснащенной рентгенотелевизионной установкой, видеомагнитофоном и скоростной кинокамерой. После катетеризации соответствующих сосудов и селективного введения рентгеноконтрастного вещества получают серию ангиограмм, отражающих динамику заполнения контрастным веществом сосудистого русла в артериальной, капиллярной и венозной фазах кровотока. Оценивают сужение, деформацию, характер ветвлений сегментарных и субсегментарных артерий, наличие артериальной обструкции, “культи” артерии, отсутствие контрастирования определенных зон легкого, а также скорость артериального кровотока, характер возможного перераспределения кровотока и другие признаки.
Наиболее характерными ангиографическими признаками ТЭЛА являются:
-
полная обтурация одной из ветвей легочной артерии и формирование “культи” одной из крупных ее ветвей (рис. 14.8);
-
резкое локальное обеднение сосудистого рисунка, соответствующее бассейну эмболизированной артерии;
-
внутриартериальные дефекты наполнения;
-
расширение обтурированной ветви легочной артерии проксимальнее места обструкции.
|
Рис. 14.8. Схема ангиограммы легких при тромбоэмболии ветви легочной артерии (а). Стрелкой показан артериальный дефект наполнения в области локализации эмбола и обрыв наполнения артерии («культя» артерии). б — нормальная ангиограмма (схема) |
|
Следует помнить, что локальное отсутствие контрастирования дистальных разветвлений легочной артерии (зоны аваскуляризации) и формирование “культи” артерии встречается не только при ТЭЛА, но и при других патологических состояниях (рак легкого, абсцесс, крупная воздушная полость и т.п.). В этих случаях для установления правильного диагноза необходимо учитывать данные других методов исследования (рентгенологического, пульмоносцинтиграфии и т.п.) в сопоставлении с клинической картиной заболевания.
Таким образом, селективная ангиопульмонография позволяет получить наиболее полное представление об изменениях сосудистого русла легких при ТЭЛА.
|
14.5. Лечение |
|
|
В зависимости от объема эмболического поражения сосудистого русла легких и выраженности гемодинамических нарушений используют несколько методов лечения больных ТЭЛА:
-
антикоагулянтную и антитромбоцитарную терапию;
-
тромболитическую терапию;
-
хирургическое лечение.
|
14.5.1. Антикоагулянтная и антитромботическая терапия |
|
|
Антикоагулянтная и антитромботическая медикаментозная терапия служит основным методом лечения больных ТЭЛА. Ее целью являются предотвращение продолжающегося вторичного тромбозирования и увеличения объема поражения, а также профилактика повторных тромбозов глубоких вен нижних конечностей и тромбоэмболии. С этой целью используют нефракционированный и низкомолекулярные (фракционированные) гепарины, методика применения которых была подробно описана в главе 6, а также непрямые антикоагулянты и антиагреганты.
Гепарины. При ТЭЛА наиболее целесообразна следующая схема введения нефракционированного гепарина. Вначале внутривенно струйно (болюсом) вводят 5–10 тыс. МЕ гепарина, а затем продолжают внутривенное капельное введение препарата со скоростью 1000 МЕ в час. Суточная доза гепарина не превышает 30 000 МЕ. В.Б. Яковлев, Л.И. Ольбинская и др. рекомендуют в качестве альтернативной схемы длительного введения гепарина прерывистое внутривенное или подкожное введение гепарина по 5000 МЕ каждые 4 ч. Общая продолжительность гепаринотерапии должна быть не меньше 7–10 дней, поскольку именно в эти сроки происходит лизис и/или организация тромба.
Гепаринотерапия проводится при обязательном контроле активированного частичного тромбопластинового времени (АЧТВ), которое определяют каждые 4 ч, пока, по крайней мере, дважды не будет обнаружено увеличение АЧТВ в 1,5–2 раза выше исходного уровня, после чего АЧТВ определяют 1 раз в сутки. Если АЧТВ увеличивается менее чем в 1,5 раза выше исходного, внутривенно струйно вводят 2–5 тыс. МЕ гепарина и увеличивают скорость инфузии на 25%. Если АЧТВ более чем в 3 раза превышает исходный показатель, скорость инфузии уменьшают на 25%. Противопоказания и побочные эффекты гепарина подробно изложены в главе 6.
В последние годы для лечения больных ТЭЛА успешно используются низкомолекулярные гепарины (фраксипарин, эноксапарин, надропарин, дельтапарин и др.), которые отличаются более высокой эффективностью и вместе с тем более редким возникновением нежелательных побочных явлений, в том числе геморрагических осложнений и тромбоцитопений. Следует помнить, что низкомолекулярные гепарины относительно мало влияют на тромбин и почти не связывают II фактор коагуляции. Поэтому на фоне лечения низкомолекулярными гепаринами мало изменяется время свертывания крови, хотя и наблюдается отчетливый терапевтический эффект, в частности, уменьшение адгезии и агрегации тромбоцитов.
Дозируют низкомолекулярные гепарины индивидуально от 0,3 до 0,8 мг 2 раза в сутки. Считают, что при лечении низкомолекулярными гепаринами специальный лабораторный контроль не требуется, хотя целесообразно все же следить за уровнем тромбоцитов и периодически (1 раз в 3–4 дня) определять АЧТВ, особенно если больной, помимо гепарина, принимает препараты, оказывающие влияние на свертываемость крови (например НПВC). Продолжительность лечения больных ТЭЛА низкомолекулярными гепаринами составляет 7–10 дней.
Непрямые антикоагулянты. Одновременно с применением гепарина больным ТЭЛА уже на 2–3 день заболевания назначают так называемые непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Как известно, витамин К необходим для активации некоторых факторов свертывания крови (II, VII, IX, Х), а также протеинов С и S. Нарушение метаболизма витамина К под действием непрямых антикоагулянтов приводит к выраженному снижению участия этих факторов свертывания в процессе коагуляции. В последние годы наиболее широкое распространение в мировой клинической практике получил варфарин, который успешно используется в качестве непрямого антикоагулянта на протяжении более 50 лет. Недавно препарат разрешен для применения в Российской Федерации.
У больных ТЭЛА прием варфарина или других непрямых антикоагулянтов (синкумар, фенилин, пелентан и др.) в течение 5–8 суток сочетают с применением гепарина. Адекватность дозы этих ЛС контролируется с помощью определения протромбинового времени, величина которого должна превышать исходный уровень в 1,5–2,0 раза. При этом МНО (международное нормализованное отношение) должно быть на уровне 2,0–2,5. Общая продолжительность лечения непрямыми антикоагулянтами должна составлять не менее 3-х месяцев. В некоторых случаях, например у больных с отчетливо выраженным гиперкоагуляционным синдромом (см. ниже), непрямые антикоагулянты принимают в течение года и более.
К числу наиболее частых осложнений терапии непрямыми антикоагулянтами относятся кровотечения, в связи с чем их применение противопоказано у больных, страдающих язвенной болезнью желудка и двенадцатиперстной кишки, язвенным колитом, геморрагическими диатезами и другими заболеваниями, характеризующимися повышенным риском геморрагий.
При возникновении кровотечений на фоне приема непрямых антикоагулянтов необходимо отменить прием этих ЛС. Внутривенно вводится антагонист непрямых антикоагулянтов — витамин К в дозе 5–10 мг ежедневно. Следует помнить, что максимальная эффективность препарата наблюдается только через 20–24 ч после его введения. Поэтому при необходимости срочной остановки кровотечения следует провести трансфузию свежезамороженной плазмы в дозе 10–20 мл/кг массы тела, начав одновременно терапию витамином К.
Антитромботическая терапия. В связи с наличием серьезных побочных эффектов непрямых антикоагулянтов и необходимости постоянного контроля протромбинового времени и АЧТВ в последние годы для профилактики повторных тромбозов и тромбоэмболий все чаще используют длительное введение низкомолекулярных гепаринов и/или применение современных антитромбоцитарных препаратов (тиклопидина и клопидогреля). Как было показано в главе 5, оба препарата относятся к производным тиенопиридина и эффективно блокируют АДФ-рецепторы тромбоцитов, что способствует уменьшению их агрегации.
Тиклопидин применяют в дозе 250 мг 2 раза в сутки, а клопидогрель — 75 мг в сутки в течение длительного времени (от 3-х месяцев до года и более). Более эффективным и безопасным является клопидогрель, который в отличие от тиклопидина не вызывает у больных нейтропению и тромбоцитопению. Побочными эффектами клопидогреля являются диспепсические явления (диарея), желудочно-кишечные кровотечения (относительно редко), заболевания печени, язвенная болезнь желудка и двенадцатиперстной кишки.
Пока не доказана безопасность совместного применения клопидогреля и гепарина, поэтому у больных ТЭЛА целесообразно назначать клопидогрель либо после завершения курса низкомолекулярного гепарина, либо за несколько дней до его отмены.
|
14.5.2. Тромболитическая терапия |
|
|
Показанием для лечения больных ТЭЛА тромболитиками является массивная ТЭЛА, протекающая с выраженными расстройствами гемодинамики — шоком, острой правожелудочковой недостаточностью и высокой легочной артериальной гипертензией. Обычно применяют стрептокиназу, урокиназу или альтеплазу. Схема лечения аналогична таковой, применяемой для лечения больных с острым коронарным синдромом со стойким подъемом сегмента RS–Т (см. главу 6).
Перед лечением и через 4 ч от начала введения тромболитиков контролируют протромбиновое время, АЧТВ, тромбиновое время, уровень фибриногена и продуктов деградации фибрина. Если отсутствуют признаки растворения тромбов, скорость введения препаратов увеличивают в 2 раза.
Эффект тромболитической терапии оценивается по клиническим, и электрокардиографическим данным (уменьшение одышки, тахикардии, цианоза, регресс признаков электрической перегрузки правых отделов сердца), а также по результатам повторной вентиляционно-перфузионной сцинтиграфии или ангиопульмонографии.
|
14.5.3. Хирургическое лечение |
|
|
Хирургическое лечение показано при массивной ТЭЛА, особенно при развитии артериальной гипотонии и острого легочного сердца, в частности у больных, имеющих противопоказания для проведения тромболизиса или применения антикоагулянтов. Чаще всего производят эмболэктомию и устанавливают так называемый кава-фильтр, который препятствует повторной ТЭЛА даже при наличии флотирующего тромба в глубоких венах нижних конечностей.
|
14.6. Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей |
|
|
У больных с высоким риском тромбоза глубоких вен нижних конечностей (см. ниже) показано ультразвуковое допплеровское исследование вен. При обнаружении тромбоза, особенно при наличии в венах флотирующих тромбов, показано хирургическое вмешательство, направленное на предотвращение миграции тромба в легочную артерию. С этой целью используют установку кава-фильтра или способы парциальной окклюзии нижней полой вены с помощью специальных фильтров, устанавливаемых в просвет сосуда непосредственно ниже устья почечных вен. Большое значение имеет медикаментозная профилактика тромбозов глубоких вен нижних конечностей и ТЭЛА. С этой целью используют гепарины, антитромботические препараты и непрямые антикоагулянты (см. выше).
Особенно важна профилактика ТЭЛА у хирургических больных, больных онкологического профиля, а также у пациентов с заболеваниями внутренних органов, сопровождающимися синдромом гиперкоагуляции, тромбофилиями и т.д. В связи с этим целесообразно оценивать степень риска тромбоза и тромбоэмболий у каждого пациента с вышеназванной патологией (табл. 14.3). Показано, что степень риска хорошо коррелирует с частотой тромбоза глубоких вен нижних конечностей и ТЭЛА (табл. 14.4).
Таблица 14.3
Степени риска послеоперационных венозных тромбоэмболических осложнений (по C. Samama и M. Samama, 1999, в модификации)
|
Риск |
Факторы риска, связанные с оперативными вмешательствами |
Факторы риска, связанные с клиническим состоянием больного |
|
Низкий (IА) |
I. Неосложненные вмешательства продолжительностью до 45 мин: Аппендэктомия Грыжесечение Роды Аборт Трансуретральная аденомэктомия и др. |
А. Отсутствуют |
|
Умеренный (IВ, IС, IIА, IIВ) |
II. Большие вмешательства: Холецистэктомия Резекция желудка или кишечника Осложненная аппендэктомия Кесарево сечение Ампутация матки Артериальная реконструкция Чреспузырная аденомэктомия Остеосинтез костей голени |
В. Имеются: Возраст старше 40 лет Варикозные вены Прием эстрогенов Недостаточность кровообращения Постельный режим более 4 дней Инфекции Ожирение Послеродовый период (6 недель) |
|
Высокий (IIС, IIIА, IIIВ, IIIС) |
III. Расширенные вмешательства: Гастроэктомия Панкреатэктомия Колэктомия Экстирпация матки Остеосинтез бедра Ампутация бедра Протезирование суставов |
С. Имеются: Онкологические заболевания Тромбоз глубоких вен и ТЭЛА в анамнезе Паралич нижних конечностей Тромбофилии |
Таблица 14.4
Частота венозных тромбоэмболических осложнений у различных групп больных (по E. Salzman и J. Hirsh, 1982)
|
Степень риска |
Частота осложнений (по данным объективных тестов) |
||
|
Тромбоз вен голени, % |
Тромбоз проксимальных вен, % |
Смертельная ТЭЛА, % |
|
|
Высокая |
40–80 |
10–30 |
1–5 |
|
Умеренная |
10–40 |
2–10 |
0,1–0,7 |
|
Низкая |
< 10 |
< 1 |
< 0,01 |
Таблица 14.5
Способы профилактики венозных тромбоэмболических осложнений
|
Степень риска |
Способы профилактики |
|
Низкая |
Ранняя активизация больных Эластическая компрессия нижних конечностей |
|
Умеренная |
Низкомолекулярные гепарины: клексан 20 мг 1 раз в день подкожно или Нефракционированный гепарин 5000 МЕ 2–3 раза в день подкожно или Длительная прерывистая пневмокомпрессия ног |
|
Высокая |
Низкомолекулярные гепарины: клексан 40 мг 1 раз в день подкожно или Нефракционированный гепарин 5000–7500 МЕ 3–4 раза в день подкожно + методы ускорения венозного кровотока |
|
Особые случаи |
Лечебные дозы низкомолекулярных или нефракционированного гепаринов + парциальная окклюзия нижней полой вены (имплантация фильтра) |
В табл. 14.5 приведены способы профилактики венозных тромбоэмболических осложнений. Из таблицы видно, что у больных с низким риском предусматривается в основном сокращение длительности постельного режима после различных хирургических вмешательств, а в некоторых случаях — активизация пациентов уже спустя несколько часов после завершения операции. У больных с умеренным риском необходимо профилактическое применение прямых антикоагулянтов (нефракционированного или низкомолекулярных гепаринов), а также прерывистая пневматическая компрессия ног, которая продолжается до исчезновения необходимости постельного режима. Наиболее эффективным считают комбинацию фармакологической профилактики и эластической компрессии. У больных с высоким риском показаны более высокие дозы гепаринов, а в отдаленном послеоперационном периоде — назначение непрямых антикоагулянтов (варфарин, фенилин, синкумар и др.).
Общая схема (план) расшифровки ЭКГ
I. Анализ сердечного ритма и проводимости:
-
оценка регулярности сердечных сокращений;
-
подсчет числа сердечных сокращений;
-
определение источника возбуждения;
-
оценка функции проводимости.
II. Определение поворотов сердца вокруг переднезадней, продольной и поперечной осей:
-
определение положения электрической оси сердца во фронтальной плоскости;
-
определение поворотов сердца вокруг продольной оси;
-
определение поворотов сердца вокруг поперечной оси.
III. Анализ предсердного зубца P.
IV. Анализ желудочкового комплекса QRS-T:
-
анализ комплекса QRS;
-
анализ сегмента RS-T;
-
анализ зубца Т;
-
анализ интервала Q-T.
V. Электрокардиографическое заключение.
Анализ сердечного ритма и проводимости
Регулярность сердечных сокращений оценивается при сравнении продолжительности интервалов R–R между последовательно зарегистрированными сердечными циклами. Регулярный, или правильный, ритм сердца диагностируется в том случае, если продолжительность измеренных интервалов R–R одинакова и разброс полученных величин не превышает ±10% от средней продолжительности интервалов R–R (рис. 3.42, а). В остальных случаях диагностируется неправильный (нерегулярный) сердечный ритм (рис. 3.42, б, в).
|
|
|
Рис. 3.42. Оценка регулярности сердечного ритма и частоты сердечных сокращений. а - правильный ритм, б, в - неправильные ритмы |
Число сердечных сокращений (ЧСС) При правильном ритме ЧСС определяют по таблицам (см. табл. 3.1) или подсчитывают по формуле:
ЧСС = 60/R - R.
Таблица 3.1
Число сердечных сокращений (ЧСС) в зависимости от длительности интервала R–R
|
Длительность интервала R-R, с |
ЧСС в мин |
Длительность интервала R-R, с |
ЧСС в мин |
|
1,50 |
40 |
0,85 |
70 |
|
1,40 |
43 |
0,80 |
75 |
|
1,30 |
46 |
0,75 |
80 |
|
1,25 |
48 |
0,70 |
86 |
|
1,20 |
50 |
0,65 |
82 |
|
1,15 |
52 |
0,60 |
100 |
|
1,10 |
54 |
0,55 |
109 |
|
1,05 |
57 |
0,50 |
120 |
|
1,00 |
60 |
0,45 |
133 |
|
0,95 |
63 |
0,40 |
150 |
|
0,90 |
66 |
0,35 |
172 |
При неправильном ритме подсчитывают число комплексов QRS, зарегистрированных за какой-то определенный отрезок времени (например за 3 с). Умножая этот результат в данном случае на 20 (60 с : 3 с = 20), подсчитывают ЧСС. При неправильном ритме можно ограничиться также определением минимального и максимального ЧСС. Минимальное ЧСС определяется по продолжительности наибольшего интервала R–R, а максимальное по наименьшему интервалу R–R.
Для определения источника возбуждения, или так называемого водителя ритма, необходимо оценить ход возбуждения по предсердиям и установить отношение зубцов R к желудочковым комплексам QRS (рис. 3.43).
|
|
|
Рис. 3.43. ЭКГ при синусовом и несинусовых ритмах. а - синусовый ритм, б - нижнепредсердный ритм, в, г - ритмы из АВ-соединения, д - желудочковый (идиовентрикулярный) ритм |
При этом следует ориентироваться на следующие признаки:
1. Синусовый ритм (рис. 3.43, а): а) зубцы РII положительны и предшествуют каждому желудочковому комплексу QRS; б) форма всех зубцов Р в одном и том же отведении одинакова.
2. Предсердные ритмы (из нижних отделов) (рис. 3.43, б):
а) зубцы PII и P III отрицательны;
б) за каждым зубцом Р следуют неизмененные комплексы QRS.
3. Ритмы из АВ-соединения (рис. 3.43, в, г):
а) если эктопический импульс одновременно достигает предсердий и желудочков, на ЭКГ отсутствуют зубцы Р, которые сливаются с обычными неизмененными комплексами QRS;
б) если эктопический импульс вначале достигает желудочков и только потом — предсердий, на ЭКГ регистрируются отрицательные РII и РIII, которые располагаются после обычных неизмененных комплексов QRS.
4. Желудочковый (идиовентрикулярный) ритм (рис. 3.43, д):
а) все комплексы QRS расширены и деформированы;
б) закономерная связь комплексов QRS и зубцов Р отсутствует;
в) число сердечных сокращений не превышает 40–60 уд. в мин.
Оценка функции проводимости. Для предварительной оценки функции проводимости (рис. 3.44) необходимо измерить:
1. длительность зубца Р, которая характеризует скорость проведения электрического импульса по предсердиям (в норме не более 0,1 с);
2. длительность интервалов P-Q(R) во II стандартном отведении, отражающую общую скорость проведения по предсердиям, АВ-соединению и системе Гиса (в норме от 0,12 до 0,2 с);
3. длительность желудочковых комплексов QRS (проведение возбуждения по желудочкам), которая в норме составляет от 0,08 до 0,09 с.
|
|
|
Рис. 3.44. Оценка функции проводимости по ЭКГ. P =< 0,1 c; P-Q (R) =< 0,2 c; QRS < 0,1 c Объяснения в тексте. |
Увеличение длительности указанных зубцов и интервалов указывает на замедление проведения в соответствующем отделе проводящей системы сердца.
После этого измеряют интервал внутреннего отклонения в грудных отведениях V1 и V6, косвенно характеризующий скорость распространения волны возбуждения от эндокарда до эпикарда соответственно правого (не более 0,03 с) и левого желудочков (не более 0,05 с). Интервал внутреннего отклонения измеряется от начала комплекса QRS в данном отведении до вершины зубца R.
Определение положения электрической оси сердца
Повороты сердца вокруг переднезадней оси сопровождаются отклонением электрической оси сердца (среднего результирующего вектора Α QRS) во фронтальной плоскости и существенным изменением конфигурации комплекса QRS в стандартных и усиленных однополюсных отведениях от конечностей.
Различают следующие варианты положения электрической оси сердца (3.45):
-
нормальное положение, когда угол α составляет от +30° до +69°;
-
вертикальное положение — угол α от +70° до +90°;
-
горизонтальное — угол α от 0° до +29°;
-
отклонение оси вправо — угол α от +91° до ± 180°;
-
отклонение оси влево — угол α от 0° до -90°.
|
|
|
Рис. 3.45. Различные варианты положения электрической оси сердца |
Для точного определения положения электрической оси сердца графическим методом достаточно вычислить алгебраическую сумму амплитуд зубцов комплекса QRS в любых двух отведениях от конечностей, оси которых расположены во фронтальной плоскости. Обычно для этой цели используют I и III стандартные отведения. Положительная или отрицательная величина алгебраической суммы зубцов комплекса QRS в произвольно выбранном масштабе откладывается на положительную или отрицательную часть оси соответствующего отведения в шестиосевой системе координат Bayley. Обычно для этой цели используют диаграммы и таблицы, приведенные в специальных руководствах по электрокардиографии.
Более простым, хотя и менее точным способом оценки положения электрической оси сердца является визуальное определение угла α. Метод основан на двух принципах:
Максимальное положительное (или отрицательное) значение алгебраической суммы зубцов комплекса QRS регистрируется в том электрокардиографическом отведении, ось которого приблизительно совпадает с расположением электрической оси сердца, и средний результирующий вектор QRS откладывается на положительную (или, соответственно, отрицательную) часть оси этого отведения.
Комплекс типа RS, где алгебраическая сумма зубцов равна нулю (R = S или R = Q + S), записывается в том отведении, ось которого перпендикулярна электрической оси сердца.
В табл. 3.2. приведены отведения, в которых в зависимости от положения электрической оси сердца имеется максимальная положительная, максимальная отрицательная алгебраическая сумма зубцов комплекса QRS и алгебраическая сумма зубцов, равная нулю.
Таблица 3.2
Конфигурация комплекса QRS в зависимости от положения электрической оси сердца
|
Угол α |
Алгебраическая сумма зубцов R и S(S+Q) |
Комплекс QRS типа RS |
|
|
Максимальная+ |
Максимальная- |
||
|
+30° |
I и II |
aVR |
III |
|
+60° |
II |
aVR |
aVL |
|
+90° |
aVF |
aVL и aVR |
I |
|
+120 ° |
III |
aVL |
aVR |
|
+150° |
III |
aVL |
II |
|
±180° |
aVR |
I |
aVF |
|
0° |
I |
aVR |
aVF |
|
–30° |
aVL |
III |
II |
|
–60° |
aVL |
III |
aVR |
|
–90° |
aVL и aVR |
aVF |
I |
На рис. 3.46–3.53 в качестве примера приведены ЭКГ при различном положении электрической оси сердца.
|
|
|
Рис. 3.46. Нормальное положение электрической оси сердца. Угол альфа + 60 град. |
|
|
|
Рис. 3.47. Нормальное положение электрической оси сердца. Угол альфа + 30 град. |
|
|
|
Рис. 3.48. Вертикальное положение электрической оси сердца. Угол альфа + 90 град. |
|
|
|
Рис. 3.49. Горизонтальное положение электрической оси сердца. Угол альфа = 0 град. |
|
|
|
Рис. 3.50. Горизонтальное положение электрической оси сердца. Угол альфа + 15 град. |
|
|
|
Рис. 3.51. Отклонение электрической оси сердца влево. Угол альфа - 30 град. |
|
|
|
Рис. 3.52. Резкое отклонение электрической оси сердца влево. Угол альфа - 60 град. |
|
|
|
Рис. 3.53. Отклонение электрической оси сердца вправо. Угол альфа + 120 град. |
Из таблицы и рисунков видно, что:
-
При нормальном положении электрической оси сердца (угол α от +30° до +69°) амплитуда RII >= RI > RIII, а в отведениях III или/и aVL зубцы R и S примерно равны друг другу.
-
При горизонтальном положении электрической оси сердца (угол α от 0° до +29°) амплитуда RI >= RII > RIII, а в отведениях aVF или/и III регистрируется комплекс типа RS.
-
При вертикальном положении электрической оси сердца (угол α от +70° до +90°) амплитуда RII >= RIII > RI, а в отведениях I или/и aVL записывается комплекс типа RS.
-
При отклонении электрической оси сердца влево (угол α от 0° до — 90°) максимальная положительная сумма зубцов регистрируется в отведениях I или/и aVL (или aVL и aVR), в отведениях aVF, aVR, I или II записывается комплекс типа RS, и имеется глубокий зубец S в отведениях III или/и aVF.
-
При отклонении электрической оси сердца вправо (угол α от 91° до ±180°) максимальный зубец R фиксируется в отведениях aVF или/и III (или aVR), комплекс типа RS — в отведениях I или/и II (или aVR), а глубокий зубец S — в отведениях aVL или/и I.
|
|
|
Рис. 3.55. Сочетание поворота сердца вокруг продольной оси по часовой стрелке с поворотом электрической оси сердца вправо (угол альфа + 120 град.) |
|
|
|
Рис. 3.56. Сочетание поворота сердца вокруг продольной оси против часовой стрелки с горизонтальным положением электрической оси сердца (угол альфа + 15 град.) |
Определение поворотов сердца вокруг поперечной оси
Повороты сердца вокруг поперечной оси принято связывать с отклонением верхушки сердца вперед или назад по отношению к ее обычному положению. При повороте сердца вокруг поперечной оси верхушкой вперед (рис. 3.57, б) желудочковый комплекс QRS в стандартных отведениях приобретает форму qRI, qRII, qRIII. Наоборот, при повороте сердца вокруг поперечной оси верхушкой назад желудочковый комплекс в стандартных отведениях имеет форму RSI, RSII, RSIII (рис. 3.57, в).
|
|
|
Рис. 3.57. Форма ЭКГ в трех стандартных отведениях а - в норме и при поворотах сердца вокруг поперечной оси, б - верхушкой вперед, в - верхушкой назад |
Анализ предсердного зубца Р
Анализ зубца Р включает: 1) измерение амплитуды зубца Р (в норме не более 2,5 мм); 2) измерение длительности зубца Р (в норме не более 0,1 с); 3) определение полярности зубца Р в отведениях I, II, III; 4) определение формы зубца Р.
При нормальном направлении движения волны возбуждения по предсердиям (сверху вниз и несколько влево) зубцы Р в отведениях I, II и III положительные.
При направлении движения волны возбуждения по предсердиям снизу вверх (если водитель ритма расположен в нижних отделах предсердий или в верхней части АВ-узла) зубцы Р в этих отведениях отрицательные;
Расщепленный с двумя вершинами зубец Р в отведениях I, aVL, V5, V6 характерен для выраженной гипертрофии левого предсердия, например у больных с митральными пороками сердца. Заостренные высокоамплитудные зубцы Р в отведениях II, III, aVF (P–рulmonale) появляются при гипертрофии правого предсердия, например у больных с легочным сердцем (см. ниже).
Анализ желудочкового комплекса QRST
Анализ комплекса QRS включает:
1. Оценку соотношения зубцов Q, R, S в 12 отведениях, которое позволяет определить повороты сердца вокруг трех осей.
2. Измерение амплитуды и продолжительности зубца Q. Для так называемого патологического зубца Q характерно увеличение его продолжительности более 0,03 с и амплитуды более 1/4 амплитуды зубца R в этом же отведении.
3. Оценку зубцов R с измерением их амплитуды, продолжительности интервала внутреннего отклонения (в отведениях V1 и V6), и определением возможного расщепления зубца R или появления второго дополнительного зубца R (r ) в том же отведении.
4. Оценку зубцов S с измерением их амплитуды, а также определением возможного уширения, зазубренности или расщепления зубца S.
Анализ сегмента RS-T. Анализируя состояние сегмента RS-T, необходимо:
1. измерить положительное (+) или отрицательное (–) отклонение точки соединения (j) от изоэлектрической линии;
2. измерить величину возможного смещения сегмента RS-T на расстоянии 0,08 с вправо от точки соединения j;
3. определить форму возможного смещения сегмента RS-T: горизонтальное, косонисходящее или косовосходящее смещение.
При анализе зубца Т следует: 1) определить полярность зубца Т; 2) оценить форму зубца Т; 3) измерить амплитуду зубца Т.
В норме в большинстве отведений, кроме V1, V2 и aVR, зубец Т положительный, асимметричный (имеет пологое восходящее и несколько более крутое нисходящее колено). В отведении aVR зубец Т всегда отрицательный, в отведениях V1 – V2, III и aVF может быть положительным, двухфазным или слабо отрицательным.
Анализ интервала Q-T. Включает его измерение от начала комплекса QRS (зубца Q или R) до конца зубца Т и сравнение с должной величиной этого показателя, рассчитанной по формуле Базетта:
|
|
где К — коэффициент, равный 0,37 для мужчин и 0,40 для женщин; R-R — длительность одного сердечного цикла.
Электрокардиографическое заключение
В электрокардиографическом заключении указывают:
1. основной водитель ритма: синусовый или несинусовый (какой именно) ритм;
2. регулярность ритма сердца: правильный или неправильный ритм;
3. число сердечных сокращений (ЧСС);
4. положение электрической оси сердца;
5. наличие четырех электрокардиографических синдромов:
а) нарушений ритма сердца;
б) нарушений проводимости;
в) гипертрофии миокарда желудочков или/и предсердий, а также острых их перегрузок;
г) повреждений миокарда (ишемии, дистрофии, некрозов, рубцов и т. п.).
Электрокардиограмма при нарушениях ритма сердца
Нарушениями ритма сердца, или аритмиями, называют:
1. изменение ЧСС выше 90 в мин (тахикардия) или ниже 60 в мин (брадикардия);
2. неправильный ритм сердца любого происхождения;
3. изменение локализации источника возбуждения (водителя ритма), т. е. любой несинусовый ритм;
4. нарушение проводимости электрического импульса по различным участкам проводящей системы сердца. В практической электрокардиологии чаще встречается сочетание двух, трех или четырех из этих признаков.
Все аритмии — это результат изменения основных функций сердца: автоматизма, возбудимости и проводимости. По современным представлениям, в большинстве случаев в основе аритмии лежит различное сочетание нарушений этих функций. Ниже приводится в несколько сокращенном виде простая и удобная в практическом отношении классификация нарушений ритма сердца по М. С. Кушаковскому и Н. Б. Журавлевой (1981) в модификации, которую мы используем в своей работе. Согласно этой классификации, все аритмии делятся на три большие группы:
1. аритмии, обусловленные нарушением образования электрического импульса;
2. аритмии, связанные с нарушением проводимости;
3. комбинированные аритмии, механизм которых состоит в нарушениях как проводимости, так и процесса образования электрического импульса.
Классификация аритмий сердца (по М. С. Кушаковскому и Н. Б. Журавлевой в нашей модификации)