
- •3 Строение атома
- •3.1 Открытие субатомных частиц. Первые модели строения атома
- •3.2 Теория строения атома по н.Бору
- •3.3 Представления о корпускулярно-волновом дуализме электрона
- •3.4 Уравнение э.Шредингера. Квантовые числа
- •3.5 Принципы заполнения атомных орбиталей
- •3.6 Современные представления о строении атома. Кварковая модель строения атома
- •3.7 Вопросы для самоконтроля
3 Строение атома
Изучая любые процессы, происходящие в живой природе, в конечном счете приходим к тому, что в их основе лежат химические реакции. Химические реакции, в свою очередь, состоят в том, что химические связи в исходных веществах рвутся и образуются новые химические связи, а следовательно, новые вещества. Иными словами, все химические реакции сводятся к преобразованиям химической связи. В таком случае, необходимо разобраться в сущности химической связи, в ее энергетике. Но химическая связь это взаимодействие электронов. Отсюда возникает необходимость изучения электронного строения атома, с чего и начнем.
3.1 Открытие субатомных частиц. Первые модели строения атома
В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». Некоторые из них утверждали, что вещество состоит из мельчайших частиц, называемых атомами. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
В XIX веке была разработана мистическая теория (Д. Дальтон, 1808), на основании которой в дальнейшем устанавливались массы и размеры атомов химических элементов:
Диаметр атомов ~2*10-10м или 0.2нм (нм=10-9м) или 2А (1А=10-10м)
Массы атомов 10-24-10-22г, 1ат.ед.массы = 1.661*10-24г.
Однако, до конца XIX века атом считался неделимым, и что заставляло атомы соединяться в те или другие молекулы было не понятно.
И наконец, в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
Первым указанием на сложную структуру атома - были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются "невидимые" катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света.
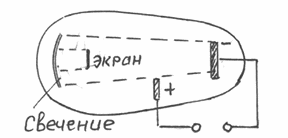
Рисунок 3.1 – Изучение катодных лучей
1897г. Дж.Дж.Томсон измерил соотношение между массой и зарядом электрона. Только в 1911 г. Малликен измерил величину заряда электрона - e=1.6*10-19 Кл - то, что мы теперь приняли за единицу заряда. Масса электрона составляет m=9.1*10-28г или 1/1837 массы атома водорода.
Если в атоме есть электроны в некотором количестве, то должен быть и равный положительный заряд, поскольку атом электронейтрален. Что же из себя представляет атом?
1898 г. Модель Томсона - атом -“кекс с изюмом” изюм - электроны, кекс - положительно заряженная субстанция.
Опыты Гейгера и Марсдена - обстреливали золотую фольгу a-частицами. Оказалось, что большая часть их проходит через фольгу не задерживаясь. На основании этих опытов Э. Резерфорд (1910) предложил ядерную модель атома.

3.2 - Резерфорд Эрнест (1871-1937)
Исходя из этих наблюдений, Резерфорд предложил свою схему строения атома: в центре атома находится положительное ядро, вокруг которого по разным орбиталям вращаются отрицательные электроны. Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения - частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома (атом имеет диаметр 1 А , то его ядро 10-5А.),, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство -частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда -частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние -частиц положило начало ядерной теории атома.
Однако теория строения атома Э.Резерфорда была бессильна объяснить не только закономерности в распределении линий спектра различных атомов, ни и само существование линейчатых спектров.
