
- •Химический состав и строение молекулы воды.
- •Водородные взаимодействия.
- •Агрегатные состояния воды.
- •Аномалии воды.
- •Химические свойства воды.
- •Свойства растворов
- •6. Физико-химические свойства растворов неэлектролитов и электролитов.
- •7. Свойства растворов слабых электролитов.
- •Ионные равновесия
- •8. Растворимость веществ в воде.
- •10. Диссоциация воды.
- •11. Ионное произведение воды
- •12. Буферные растворы и их свойства
- •13. Гидролиз солей
- •14. Количественные характеристики гидролиза
- •15. Понятие о системах, фазах, компонентах.
- •16. Диаграмма состояния воды
- •17. Окислители и восстановители
- •18. Типы окислительно-восстановительных реакций
- •19. Окислительно-восстановительные потенциалы
- •20. Окислительно-восстановительные свойства воды
- •Классификация дисперсных систем.
- •Методы получения дисперсных систем.
- •Строение коллоидной частицы.
- •Свойства коллоидных систем.
- •Электрокинетические явления.
- •26.Причины устойчивости коллоидных систем
- •27. Разрушение дисперсных систем
- •28. Поверхностное натяжение
- •29. Поверхностно активные вещества
- •Поверхностные явления
- •30. Адсорбция равновесия
- •34 Особенности химического состава природных вод
- •36. Понятие об обобщённых оценочных показателях качества воды.
- •37. Химические показатели качества воды
- •40. Отстаивание.
- •41. Осаждение
- •42. Фильтрование воды
- •43. Флотация и электрофлотация
- •44. Коагуляция
- •45. Зависимость выбора оптимальных условий обработки различными коагулянтами от качества воды
- •46. Электрокоагуляция, эффективность использования
- •47. Флокулянты (анионо- и катионоактивные) их природа, свойства и методы действия, выбор оптимальной дозы.
- •48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
- •56. Жесткость воды
- •57. Единицы измерения жесткости
- •58. Методы реагентного умягчения воды, их эффективность, контроль процессов реагентного умягчения.
- •59. Умягчения воды методом ионного обмена
- •60. Иониты (катиониты и аниониты), их природа, строение, свойства.
- •61. Термический метод умягчения воды.
- •62. Импфирование (подкисление)
- •63. Опреснение воды
- •64. Электрохимический метод.
- •66. Методы удаления из воды соединений железа и марганца
- •67.Удаление кремниевой кислоты
- •68.Обесфторирование и фторирование воды.
- •69. Не нашли этот вопрос
- •70. Углекислота и ее формы.
- •71. Вычисление содержания агрессивной углекислоты с помощью таблицы
- •72. Индекс насыщения воды карбонатом кальция
- •73. Особенности химического состава бытовых и производственных сточных вод
- •75Отстаивание, удаление масел и нефти
- •76.Коагулирование сточных вод.77.Выбор и подготовка коагулянтов.
- •78) Флотация сточных вод.
- •79) Сорбция.
- •80) Сорбция – область использования, факторы, влияющие на выбор сорбентов.
- •81) Экстракция, требования, предъявляемые к экстрагентам, экстракция в противотоке.
- •82.Эвапорация и аэрация.
- •83. Области использования аэрации и эвапорации, контроль процессов.
- •85. Нейтрализация сточных вод
- •84. Радиационнаяочистка сточных вод от органических загрязнений.
- •87.Химич очистка сточных вод
- •86.Дезинфекция сточных вод
- •88.Химическое окисление под давлением
- •89.Кристаллизация.
Вода, как химическое соединение
Химический состав и строение молекулы воды.
В 1783 году был открыт состав воды физиком Лавуазье.(Н2О);
1805г. – открыто строение воды.
Электронные
облака молекул воды расположены в форме
неправильного тетраэдра. Атом кислорода
оказывается при этом в центре, а два
атома водорода – в противоположных
углах одной из граней куба. У гол
между ними составляет 1040
31.
Два из восьми электронов расположены
около ядра, два других связаны с атомами
водорода, а две неподеленные пары
электронов образуют ветви, расположенные
в противоположном направлении по
отношению к электронным облакам
водородов.
гол
между ними составляет 1040
31.
Два из восьми электронов расположены
около ядра, два других связаны с атомами
водорода, а две неподеленные пары
электронов образуют ветви, расположенные
в противоположном направлении по
отношению к электронным облакам
водородов.
Вода – 2Н 16О;
Изотопы воды – 2Н 17О (0,04% в природе); 3Н 18О(0,2% в природе).
Если электроны движутся в одном направлении – это пара-вода.
2. Если электроны движутся в разных направлениях – это орто-вода.
Если бы молекулы воды не имели отрицательно заряженных ветвей электронного облака и дипольных моментов, они не могли бы взаимодействовать друг с другом.
Водородные взаимодействия.
Водородные связи – связи, которые образуются между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами другой молекулы.(кислород, азот, фтор, фосфор).
В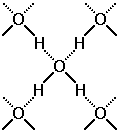 озникновение
водородной связи объясняется свойством
атома водорода взаимодействовать с
сильно электроотрицательным элементом(с
кислородом другой молекулы воды). Такая
особенность водородного атома
обусловливается тем, что, отдавая свой
единственный электрон на образование
ковалентной связи с кислородом, он
остается в виде ядра очень малого
размера, почти лишенного электронной
оболочки. Поэтому он не испытывает
отталкивания от электронной оболочки
кислорода другой молекулы воды, а,
наоборот, притягивается ею и может
вступить с нею во взаимодействие.
Наибольшая устойчивость у удвоенных
молекул (Н2О)2,
образование которых сопровождается
возникновением 2-х водородных связей.
озникновение
водородной связи объясняется свойством
атома водорода взаимодействовать с
сильно электроотрицательным элементом(с
кислородом другой молекулы воды). Такая
особенность водородного атома
обусловливается тем, что, отдавая свой
единственный электрон на образование
ковалентной связи с кислородом, он
остается в виде ядра очень малого
размера, почти лишенного электронной
оболочки. Поэтому он не испытывает
отталкивания от электронной оболочки
кислорода другой молекулы воды, а,
наоборот, притягивается ею и может
вступить с нею во взаимодействие.
Наибольшая устойчивость у удвоенных
молекул (Н2О)2,
образование которых сопровождается
возникновением 2-х водородных связей.
Согласно методу электронных орбиталей водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Агрегатные состояния воды.
1.Жидкая вода:
– в воде существуют элементы упорядоченности, между которыми расположены отдельные молекулы воды
– хаотичное расположение молекул
2.Лед(00 С) – кристаллическая структура, нет упорядоченного строения.
При образовании кристаллической структуры между молекулами воды образуются пустоты с размером больше молекулы воды. Плотность льда ниже плотности воды, вода при замерзании расширяется.
Модификации льда(14шт.):
– Если вода замерзает при повышенном давлении, образуется лед повышенной плотности, плотнее жидкой воды.
– При t=–1200C вода становится сверх вязкой и тягучей как вата.
– При охлаждении до -1300С вода теряет кристаллическую структуру и становится аморфной, превращается в стекловидную массу.
– абсолютно чистая вода при t=-380C. Ниже этой температуры вода кристаллизуется.
Горячая вода замерзает быстрее холодно – эффект Мкемба.
3. Газообразное состояние. Для перевода воды из жидкого в газообразное состояние необходимо преодолеть силы межмолекулярного взаимодействия. Работа испарения – работа по преодолению межмолекулярных взаимодействий, характеризующаяся теплотой испарения. У воды по сравнению с другими жидкостями максимальная теплота испаренияи максимальная теплота плавления.
