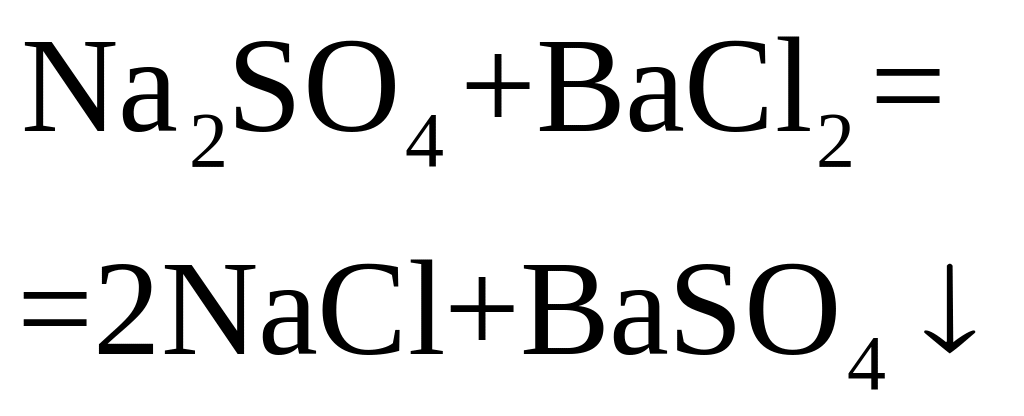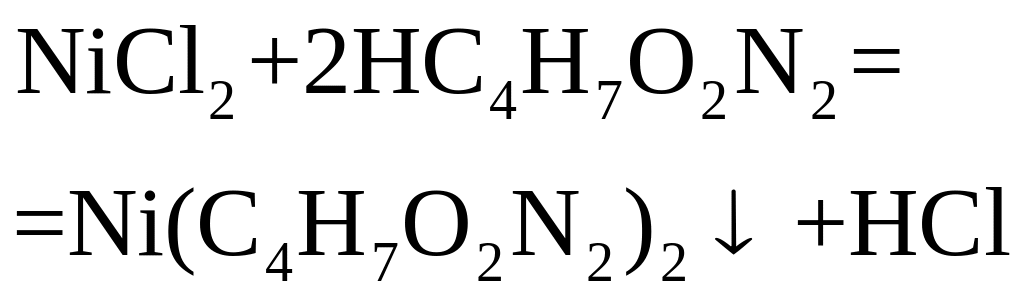- •6. Методы химического анализа. Классификации методов анализа_2011, осенний семестр
- •6.1 Метод химического анализа
- •6.2 Аналитический сигнал
- •6.3 Методика химического анализа
- •7. Химические методы химического анализа
- •7.1. Химические методы качественного химического анализа вещества
- •7.2. Химические методы количественного химического анализа
- •1) Методы гравиметрии (закон сохранения массы элемента):
- •2) Методы титриметрии (Закон эквивалентов):
7.2. Химические методы количественного химического анализа
Результат химического анализа пробы вещества геологического объекта:
- массовая доля w(А) компонента А – это отношение массы компонента А, m(А), к общей массе mвещ пробы вещества объекта анализа. В количественном анализе массовую долю компонента в пробе вещества измеряют в процентах. Она характеризует содержание компонента в пробе твердого или жидкого вещества:
w(А) = [ m(А)/ mвещ ]×100 (%)
- массовая концентрация компонента А.
Сm (A) = m(А)/V,
где V – объем жидкого вещества (раствора), м3 ; дм3; см3;
Массу пробы вещества mвещ можно измерить с необходимой точностью на аналитических весах, объем V можно измерить с необходимой точностью с помощью мерной посуды. Массу компонента А, m(А), в пробе вещества непосредственно измерить невозможно, её можно измерить только косвенно. Для этого разработаны различные методы количественного химического анализа.
Химические методы количественного химического анализа основаны на проведения химической реакции с определяемым компонентом анализируемой пробы в условиях выполнения законов постоянства химического состава, сохранения массы или количества частиц – эквивалентов в химических превращениях.
Химические методы количественного химического анализа подразделяют на гравиметрический и титриметрический методы.
1) Методы гравиметрии (закон сохранения массы элемента):
-- проводят химическую реакцию с реагентом, вступающим в химическую реакцию с определяемым компонентом в строго определенных соотношениях (стехиометрично), и имеется возможность точно измерить массу образующегося продукта реакции, выделенного либо в элементарном виде, либо в виде соединения строго определенного состава.
Расчеты в гравиметрическом анализе основаны на законе сохранения массы элементов при химических превращениях. Он наиболее точный из методов количественного анализа, правильность результата анализа – 0,2 отн.%.
В гравиметрии используют реакции обмена, замещения, разложения и комплексообразования, а также электрохимические процессы.
Гравиметрические методы подразделяют на две группы: 1) методы отгонки; 2) методы осаждения.
В методах осаждения навеску анализируемого вещества растворяют и прибавляют 1,5 - кратный избыток реагента-осадителя, соблюдая необходимые условия осаждения. Определяемый компонент вступает в химическую реакцию с реагентом, образуя малорастворимый продукт. Полученный осадок называют осаждаемой формой. Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают и прокаливают, получая гравиметрическую (весовую) форму. Твердый осадок известного химического состава взвешивают.
Например, содержание сульфатов в породе может быть определено после соответствующей пробоподготовки методом гравиметрии, где использовано свойство сульфатов образовывать малорастворимое соединение с ионами Ва2+
m(SO42-) m(ВаSO42-)
SO42- + ВаСl2 = ВаSO4↓ + 2Сl-
M(SO42-) M(ВаSO42-)
Расчеты содержания неизвестного компонента производят на основе закона сохранения массы (количества) элементов при химических взаимодействиях:
m(SO42-) =M(SO42-) m(ВаSO42-)/M(ВаSO42-)
Пример: Руды железные. Гравиметрический метод определения окиси кальция и окиси магния
В методах отгонки определяемый компонент выделяется из пробы в виде газа; в этом случае анализ основан либо на определении массы отогнанного компонента, либо на определении массы остатка. Методы отгонки применяют в нескольких модификациях: а) определяемый компонент отгоняют из смеси, и образовавшийся отгон взвешивают; б) определяемый компонент отгоняют, поглощают каким-либо поглотителем и взвешивают поглотитель, по прибавке в массе определяют количество отогнанного компонента; в) определяемый компонент отгоняют из точной навески анализируемого вещества, после окончания отгонки навеску снова взвешивают и по разнице в массе определяют количество отгона. Методами отгонки часто определяют содержание двуокиси углерода в карбонатных породах, количество кристаллизационной воды в солях, минералах и т. д. Методы отгонки могут применяться только в том случае, если проба содержит летучий компонент или когда определяемый компонент может превращаться в летучее соединение по какой-либо реакции.
Таблица1 Примеры гравиметрических определений
Определя-емый компонент |
Реагент |
Уравнение и тип реакции |
Измеряемая величина |
|
BaCl2 |
осаждение |
Масса BaSO4 после прокаливания осадка |
|
NH4OH |
осаждение
разложенние |
Масса Fe2O3, полученного прокаливанием осадка Fe(OH)3 |
|
HCl |
отгонка |
Масса поглотителя после улавливания выделившегося СО2 |
|
Диметил-глиоксим |
комплексообразование-осаждение |
Масса высушенного осадка Ni(C4H7O2N2)2 |
Объекты гравиметрического анализа - горные породы, руды, минералы;
Виды анализа – количественный элементный и функциональный (ионы разной степени окисления) анализ; определение главных и сопутствующих компонентов; однокомпонентный анализ; макроанализ; Определяемые элементы:– Be, C, Si, S, Cl, Ni, Ba, W, Th, сумма РЗЭ
Метрологические характеристики гравиметрических методов анализа: прецизионный анализ, предел определения до 0,2 %; диапазон определяемого содержания от n*10-2 до n*10 %; анализ жидкой фазы – поэтому используют подготовку проб: твердые пробы растворяют; не экспрессный анализ - несколько проб за смену.