
- •Оглавление
- •Глава 1. Литературный обзор
- •Глава 2. Элементарная теория ударных волн
- •Моделирование ударной волны
- •Уравнение энергии
- •Глава 3. Ударные волны в идеальном газе Энтальпия
- •Адиабата Гюгонио
- •Уравнение Гюгонио
- •Глава 4. Детонация
- •Численное моделирование детонационного процесса
- •Прямая Михельсона
- •Глава 5. Энергетическое использование детонации
- •Электрогенератор на идд
- •Численное моделирование цикла идгтд
- •Глава 6. Приложение идд
- •Список Литературы
Уравнение Гюгонио
Рассмотрим распространение ударных волн в идеальном газе с постоянной теплоёмкостью. В этом случае уравнение адиабаты Гюгонио получает простую форму и может быть записано в явном виде.
Известно,
что предположение о постоянстве
теплоёмкости газа справедливо только
в более или менее широком интервале
температуры. Одноатомные газы имеют
действительно постоянную теплоёмкость
 на
моль (
на
моль ( — газовая
постоянная, равная
— газовая
постоянная, равная

 ),
начиная от конденсации и вплоть до
температур порядка 10000º, при которых
наступает ионизация.
),
начиная от конденсации и вплоть до
температур порядка 10000º, при которых
наступает ионизация.
Двухатомные
газы имеют теплоёмкость
 только при таких низких температурах,
когда вращательные состояния ещё не
возбуждены. Но все газы, кроме водорода,
при атмосферном давлении конденсируются
при более высоких температурах. Поэтому
практически у двухатомных газов
теплоёмкость равна
только при таких низких температурах,
когда вращательные состояния ещё не
возбуждены. Но все газы, кроме водорода,
при атмосферном давлении конденсируются
при более высоких температурах. Поэтому
практически у двухатомных газов
теплоёмкость равна
 до тех температур, при которых возбуждаются
колебания. Для кислорода это составляет
2000º, для азота—около 3000º, для водорода
— около 5000º.
до тех температур, при которых возбуждаются
колебания. Для кислорода это составляет
2000º, для азота—около 3000º, для водорода
— около 5000º.
У
трёхатомных газов с линейной молекулой
теплоёмкость, обусловленная переносным
и вращательным движением молекул,
равна
 ,
как и у двухатомных молекул. У треугольных
молекул переносная и вращательная
теплоёмкость составляет
,
как и у двухатомных молекул. У треугольных
молекул переносная и вращательная
теплоёмкость составляет
 ,
так как треугольная молекула имеет три
вращательные степени свободы, а на
каждую степень свободы приходится
теплоёмкость
,
так как треугольная молекула имеет три
вращательные степени свободы, а на
каждую степень свободы приходится
теплоёмкость
 .
.
Итак, пусть теплоёмкость газа в ударной волне не изменяется, т, е. скачок температуры не превышает интервала постоянства теплоёмкости. Обозначим отношение
 .
Тогда у одноатомного газа
.
Тогда у одноатомного газа
 ,
у двухатомного
,
у двухатомного
 трёхатомного с линейной молекулой
трёхатомного с линейной молекулой
 ,
у газа с треугольной молекулой
,
у газа с треугольной молекулой
 .
Всюду колебания считаются невозбуждёнными.
.
Всюду колебания считаются невозбуждёнными.
Найдем уравнения для молярных теплоемкостей при изобарном и изохорном процессах.
При
изобарном процессе присутствуют и
 (внутренняя
энергия газа), и
(внутренняя
энергия газа), и
 (работа
газа над окружающими телами). Откуда:
(работа
газа над окружающими телами). Откуда:

При
изохорном процессе газ не изменяет
своего объема, т. е. не совершает работу
и
 :
:

Так
как
 ,
то для коэффициента Пуассона имеет
место уравнение:
,
то для коэффициента Пуассона имеет
место уравнение:

Подставим
полученное в выражение для внутренней
энергии идеального газа ( )
и получим:
)
и получим:

Энтальпия
же по формуле
 примет вид:
примет вид:

Теперь
вспомним об уравнении энергии из
элементарной теории ударных волн и,
проведя ряд несложных преобразований,
выразим υ
через
 .
.

Теперь рассмотрим следствия из полученного соотношения для волн разной силы:
Сначала
слабые волны, для которых
 .
Выразим изменение объёма через изменение
давления:
.
Выразим изменение объёма через изменение
давления:

Учитывая
уравнение Пуассона, согласно которому
 Данное соотношение отвечает изэнтропической
зависимости объёма от давления.
Данное соотношение отвечает изэнтропической
зависимости объёма от давления.
Для
сильных ударных волн, где
 (соответственно
(соответственно
 вполне можно пренебречь), получим
предельный закон:
вполне можно пренебречь), получим
предельный закон:

Другими
словами, сколь угодно сильная ударная
волна не может сжать газ более, чем в
 раз.
К примеру, предельное сжатие одноатомного
газа – четырёхкратное, двухатомного –
шестикратное, трёхатомного с нелинейной
молекулой – семикратное (без возбужденных
колебаний).
раз.
К примеру, предельное сжатие одноатомного
газа – четырёхкратное, двухатомного –
шестикратное, трёхатомного с нелинейной
молекулой – семикратное (без возбужденных
колебаний).
На
этом примере можно продемонстрировать
явные различия между адиабатой
Гюгонио и изентропой. Потому что на
изэнтропе давление устремляется в
бесконечность при
 ,
а на адиабате Гюгонио – при
,
а на адиабате Гюгонио – при
 ,
т. е. при конечном сжатии. Действительно,
изэнтропа находится ниже адиабаты
Гюгонио, если говорить о части кривой,
лежащей со стороны высоких давлений,
т. е.
,
т. е. при конечном сжатии. Действительно,
изэнтропа находится ниже адиабаты
Гюгонио, если говорить о части кривой,
лежащей со стороны высоких давлений,
т. е.
 .
.
Другим характерным различием между ударным сжатием и изэнтропическим является то, что в результате нескольких ударных сжатий объём зависит последовательности ударных волн и распределения полного давления по отдельным этапам сжатия. Изэнтропический же процесс дискретен и конечный объём зависит только от полного изменения давления. Проиллюстрируем это на примере идеального газа.
Пусть
конечное давление
 весьма велико. Ударная волна пущена по
газу один раз, соответственно газ сжат
в
весьма велико. Ударная волна пущена по
газу один раз, соответственно газ сжат
в
 раз.
Если же разделить сжатие на два этапа,
из которых каждый сжимает в отношении
раз.
Если же разделить сжатие на два этапа,
из которых каждый сжимает в отношении
 ,
результирующее сжатие получится в
,
результирующее сжатие получится в
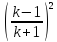 раз.
раз.
Вернемся к сильным ударным волнам, чтобы получить еще некоторые соотношения.
Выразим
формулы для скорости фронта волны и
для скорости вещества (мы пренебрежем
 по сравнению с
по сравнению с
 ):
):

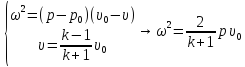
Еще можно эти формулы сопоставить с выражением для скорости звука в сжатом веществе и перейти к начальному объёму:

Теперь установим зависимость температуры при известной плотности. Относительное изменение давления выведем путем простых преобразований:

Это мы, кстати, получили уравнение Гюгонио.
Дальше (отсылка на Менделеева-Клапейрона):

Возьмем
предельный случай, когда
 ,
тогда температура повысится в
,
тогда температура повысится в
 раз, тогда как при изэнтропичестком
сжатии отношение температур равно как
известно:
раз, тогда как при изэнтропичестком
сжатии отношение температур равно как
известно:

Это
соответствует более медленному повышению
температуры. Например, если
 ,
то у двухатомного газа
,
то у двухатомного газа
 ,
,
 .
При
.
При
 ,
у того же двухатомного газа (
,
у того же двухатомного газа ( ,
,
 ,
а
,
а
 (безусловно, последний случай является
лишь числовой иллюстрации, так как
температура не может возрасти в 1660 раз
при постоянной теплоёмкости двухатомного
газа).
(безусловно, последний случай является
лишь числовой иллюстрации, так как
температура не может возрасти в 1660 раз
при постоянной теплоёмкости двухатомного
газа).
Благодаря
тому, что при ударном сжатии температура
пропорциональна
 ,
она повышается больше, нежели при
изэнтропическом сжатии.
При ударном
характере сжатия
,
она повышается больше, нежели при
изэнтропическом сжатии.
При ударном
характере сжатия
 возрастает, a
возрастает, a
 остаётся
конечным. При изэнтропическом сжатии
с ростом
остаётся
конечным. При изэнтропическом сжатии
с ростом
 стремится к
нулю,
хотя
и слабее, чем растёт
стремится к
нулю,
хотя
и слабее, чем растёт
 .
.
