
- •Раздел третий гетерогенные (фазовые) равновесия
- •3.1. Основные определения
- •3.2 Однокомпонентные системы
- •Диаграмма состояния воды
- •Ж Испарение Плавление
- •Энантиотропные и монотропные превращения
- •3.3. Двухкомпонентные системы
- •Диаграмма плавкости с простой эвтектикой.
- •Б. Химическое соединение плавится с разложением (инконгруэнтно)
- •Диаграмма состояния двухкомпонентной системы с ограниченной растворимостью компонентов в жидком состоянии. Явление ликвации.
- •Диаграммы плавкости веществ, образующих твердые растворы с неограниченной и ограниченной растворимостью
- •А. Компоненты а и в неограниченно растворимы друг в друге
- •Б. Компоненты а и в ограниченно растворимы друг в друге в твердом состоянии
- •3.4. Контрольные вопросы
Энантиотропные и монотропные превращения
Если твердое вещество может образовывать несколько кристаллических полиморфных модификаций, то на диаграмме Р-Т следует различать энантитропные и монотропные превращения.
Энантиотропные
превращения можно рассмотреть на
примере диаграммы состояния серы (рис.
3.2), где имеются четыре области: серы
ромбической (S![]() ),
моноклической
),
моноклической
![]() (S
(S![]() ),
жидкой и парообразной. Однако максимально
в однокомпонентной системе в равновесии
могут находиться только три фазы. Поэтому
на диаграмме четыре тройные точки О, В,
Д и метастабильная точка К.
),
жидкой и парообразной. Однако максимально
в однокомпонентной системе в равновесии
могут находиться только три фазы. Поэтому
на диаграмме четыре тройные точки О, В,
Д и метастабильная точка К.
В точке О (95,4![]() С)
сера ромбическая и моноклиническая
находятся в равновесии. При более низкой
температуре давление паров S
(кривая ОВ) выше S
(кривая АО),
С)
сера ромбическая и моноклиническая
находятся в равновесии. При более низкой
температуре давление паров S
(кривая ОВ) выше S
(кривая АО),
![]()
![]() >
>
![]() и поэтому более устойчивой модификацией
является S
.
и поэтому более устойчивой модификацией
является S
.
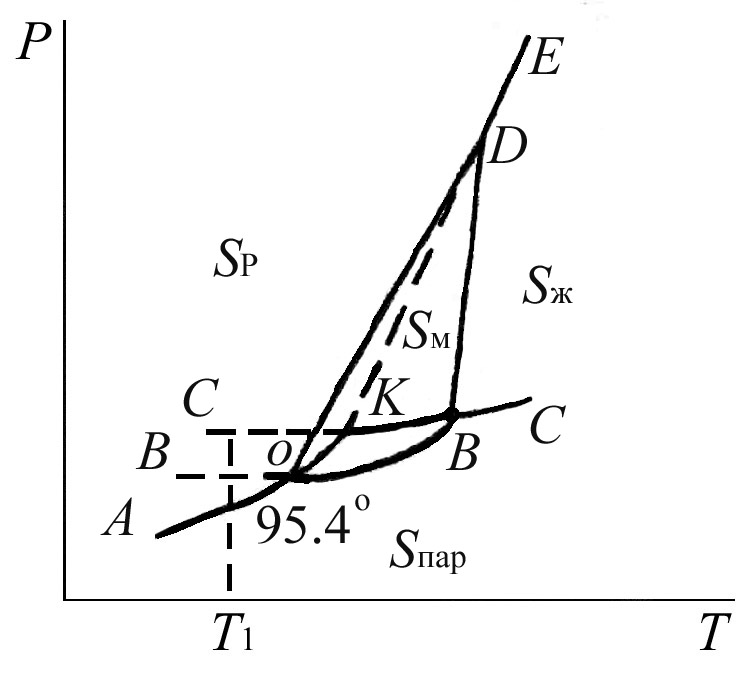
Р ис.
3.2. Диаграмма состояния серы
ис.
3.2. Диаграмма состояния серы
Если жидкую
серу переохладить до Т1 (кривая
С’К), то из неё в соответствии с правилом
Оствальда сначала образуется Sм,
менее устойчивая в данных условиях
модификация, а затем – более устойчивая
Sр. При температуре выше 95,4![]() С,
напротив, давление пара Sр (ОК)
выше давления паров Sм (ОВ),
>
,
поэтому сера ромбическая будет переходить
самопроизвольно в серу моноклиническую,
вплоть до температуры плавления (точка
К для Sp и точка В для Sм).
Такие взаимные превращения модификаций,
которые могут протекать самопроизвольно
в зависимости от условий и в прямом и в
обратном направлениях, называются
энантиотропными превращениями.
С,
напротив, давление пара Sр (ОК)
выше давления паров Sм (ОВ),
>
,
поэтому сера ромбическая будет переходить
самопроизвольно в серу моноклиническую,
вплоть до температуры плавления (точка
К для Sp и точка В для Sм).
Такие взаимные превращения модификаций,
которые могут протекать самопроизвольно
в зависимости от условий и в прямом и в
обратном направлениях, называются
энантиотропными превращениями.
Монотропные превращения.
Превращение модификаций, которое может протекать только в одном направлении, называется монотропным.
В этом случае давление паров одной твердой модификации всегда выше, чем другой, и поэтому вплоть до температуры плавления возможен самопроизвольный переход лишь в сторону одной более устойчивой модификации.
Рассмотрим в качестве примера диаграмму состояния бензофенона (рис.3.3.) Кривые возгонки двух модификаций бензофенона (I и II) должны пересечься выше их температур плавления. Поскольку кристаллы нельзя перегреть выше их точки плавления, обе модификации плавятся соответственно в точках А1 и В1. Диаграмма показывает, что кривая возгонки АА1 модификации I выше кривой возгонки ВВ1 модификации II, поэтому из переохлажденной жидкости (кривая А1С) при температуре Т образуются кристаллы модификации I, а затем модификации II.
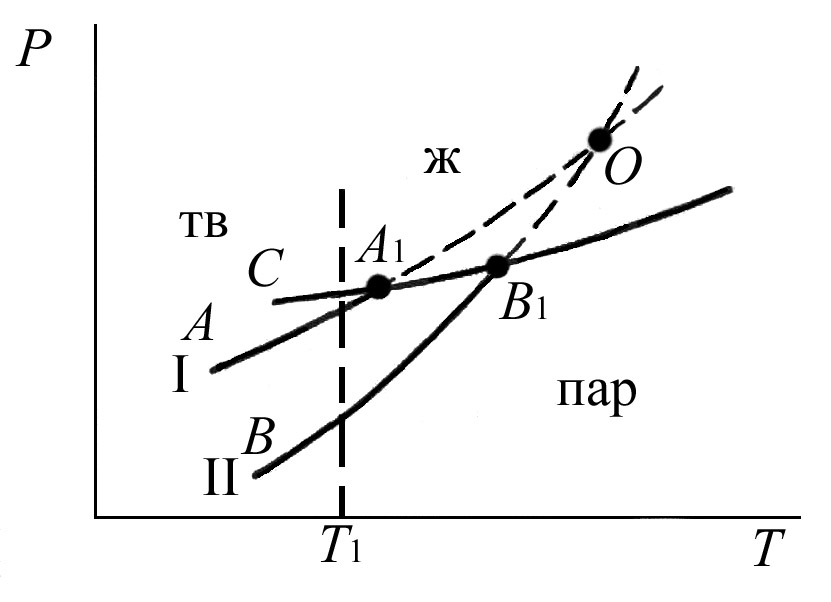
Рис.3.3. Диаграмма состояния бензофенона.
3.3. Двухкомпонентные системы
Для получения диаграмм состояния многокомпонентных систем используют физико-химический анализ, основы которого заложены Д.И. Менделеевым, Ле-Шателье, Г. Тамманом и всесторонне развиты Н.С. Курнаковым (1912-1914гг.). В его основе лежит изучение зависимости физических свойств (плотности, вязкости, электропроводности и др.) от состава. Для двухкомпонентных систем свойства откладываются на оси ординат, а на оси абсцисс - состав, выраженный в мольных или массовых процентах, поэтому диаграмма по оси абсцисс ограничивается с двух сторон. По геометрическим особенностям диаграмм можно судить не только о химической природе образующихся веществ, но и о числе, границах устойчивости, условиях совместного существования фаз в системе.
Н.С. Курнаков сформулировал два главных принципа, устанавливающих связь геометрических образов диаграммы с фазовым составом.
Принцип непрерывности устанавливает, что при непрерывном изменении давления, температуры, концентрации свойства отдельной системы изменяются непрерывно до тех пор, пока не изменится число или характер ее фаз. В последнем случае свойство изменяется скачком.
Принцип соответствия устанавливает, что каждой совокупности фаз, находящихся в равновесии, на диаграмме состояния отвечает определенный геометрический образ.
Одним из методов физико-химического анализа является метод термического анализа, в основе которого лежит определение температур фазовых превращений. Существует два варианта этого метода: визуальный метод и метод кривых охлаждения (нагревания). В первом случае визуально определяют температуры фазовых превращений. Второй метод состоит в том, что систему определенного состава сначала нагревают выше температуры плавления, а затем при самопроизвольном охлаждении фиксируют изменение температуры. Сущность метода заключается в том, что режим охлаждения системы зависит от фазовых превращений, происходящих в ней. Появление твердой фазы сопровождаемое выделением тепла, может либо предотвратить охлаждение, либо уменьшить его скорость. На кривой охлаждения в первом случае будет наблюдаться площадка, во втором - перегиб. По кривым охлаждения строят диаграммы зависимости температуры плавления от состава двухкомпонентных систем при p = const. Для них правило фаз, как было показано выше, имеет вид: С=К+I-Ф.
