
Билет № 1 Теплотехника и ее роль в народном хозяйстве. Основные понятия термодинамики.
Теплотехника- это наука о законах получения, распределения и преобразования тепловой энергии.
Теплотехника является общетехнической дисциплиной, которая занимает одно из центральных мест в инженерной подготовке специалистов. Это обусловлено тем, что процессы получения , использования и переноса теплоты имеют место практически во всех технических устройствах и технологических процессах современной техники. При расчете двигателей различных типов, холодильных и турбокомпрессорных установок, проектировании технологических процессов производства строительных материалов и дорожных одежд, восстановлении деталей и др. Современный специалист должен уметь правильно формулировать и решать разнообразные прикладные задачи с использованием основных законов термодинамики и тепломассообмена.
С РАЗВИТИЕМ электрификации и химизации в СССР роль теплотехники с каждым годом возрастает. Мощные паротурбинные установки на электростанциях с применением пара высоких параметров, внедрение комбинированных установок с одновременным использованием в качестве рабочих тел как водяного пара, так и продуктов сгорания различных топлив, теплофикация городов, развитие реактивных двигателей и газотурбинных установок, широкое внедрение в народное хозяйство двигателей внутреннего сгорания, отвод огромных тепловых потоков в ядерных реакторах для получения электроэнергии, большое строительство пищевых и химических предприятий, где продукты сгорания и водяной пар являются теплоносителями, переход к промышленному использованию магнитогидродинамического метода для непосредственного преобразования теплоты в электрическую энергию, широкое использование в народном хозяйстве холода и многие другие проблемы современной науки и техники необычайно расширили область теплотехники и все время ставят перед ней новые исключительно важные физические задачи.
ОСНОВУ термодинамики составляют фундаментальные законы природы. Сформулированные в термодинамических понятиях, они называются законами или началами термодинамики. На основе термодинамики разрабатывают новые и совершенствуют существующие тепловые машины и установки и создают высокоэффективные технологии, обеспечивающие экономное расходование энергетических и материальных ресурсов. Совокупность инженерных приложений
термодинамики образует ее раздел, называемый технической термодинамикой.
Билет № 2 Основные термодинамические параметры состояния рабочего тела. Термическое уравнение состояния.
ПАРАМЕТРЫ состояния
Абсолютное давление- интенсивная величина, характеризующая среднюю по времени силу, с которой частицы системы действуют на единицу площади стенки сосуда, в котором заключена система.
Давление- абсолютное, которое складывается из показаний прибора.
Pабс. = Ратм. + Ризб. Рабс. = Ратм. – Рвак.
Абсолютная температура- интенсивная величина, пропорциональная средней кинетической энергии частиц (молекул газа), из которых состоит система.
Термодинамическая температура: Т= t+273,15
Удельный объем- интенсивная величина, представляющая собой отношение объема системы V, к заключенной в нем массе М.
v=V/M V-объем системы М- масса
Плотность- величина, обратная удельному объему
р(ро)=1/v=M/V
УРАВНЕНИЕ состояния: F(p,v,T)=0
Билет №3
3) Термодинамический процесс. Обратимые и необратимые процессы. Термодинамическая система.
Определение: Если в термодинамической системе меняется хотя бы один из параметров любого входящего в систему тела, то в системе происходит термодинамический процесс.
Обратимые и необратимые процессы
Обратимый процесс — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Термодинамическая система
Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом.
Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы.
Примерами термодинамических величин являются:
температура
давление
объем
внутренняя энергия
энтропия
энтальпия
свободная энергия Гельмгольца
энергия Гиббса
Если термодинамическое состояние системы не меняется со временем, то говорят, что система находится в состоянии равновесия. Строго говоря, термодинамические величины, приведённые выше, могут быть определены только в состоянии термодинамического равновесия
Термодинамические системы подразделяются на однородные по составу (например, газ в сосуде) и неоднородные (вода и пар или смесь газов в сосуде).
Выделяют также изолированные системы, то есть системы, которые не обмениваются с окружающей средой ни энергией, ни веществом, и закрытые системы, которые обмениваются со средой только энергией, но не обмениваются веществом. Если же в системе происходят обменные процессы с окружающей средой, то её называют открытой.
Билет №4 Теплота и работа как формы передачи энергии. Аналитическое выражение и графическое изображение.
Тела, участвующие при протекании т/д процесса обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами.
1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел либо лучистым переносом внутренней энергии излучающих тел путем э/м волн. При этом энергия передается от более нагретого к менее нагретому.
Количество энергии, переданной 1-м способом от одного тела к другому, называется количеством теплоты – Q [Дж], а способ – передача энергии в форме теплоты.
2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передачи энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой – L [Дж], а способ передача энергии в форме работы.
Количество энергии, полученное телом в форме работы называется работой совершенной над телом, а отданную энергию – затраченной телом работой.
Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера т/д процесса.
Работа - есть фунцкия состояния вещества, т.е зависит от вида процесса.
Если поршень перемещается в цилиндре из т.А в т.В, то в процессе а-b происходит изменение состояния вещества.

Расширенное
элементарное перемещение
![]()
![]()
![]()
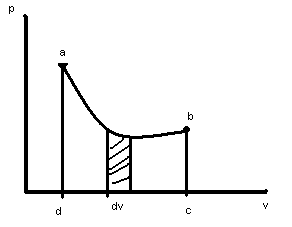
С математической точки зрения, этот интеграл равен площади фигуры лежащей под кривой.
Если v
в процессе увелич., то раб.
![]() ,
dv>0
,
dv>0
Если v
в процессе уменьш., то раб.![]() ,
dv<0
,
dv<0
Билет №5
1 закон термодинамики: 1)невозможно создать вечный двигатель первого рода, т.е. машину, работающую без затраты энергии.2)
Теплота q подведенная к системе расходуется на изменение вн.энегрии ɅU и совершения работы(L)
q=дельтаU+l
dq=dU+dl
1 закон через энтальпию: dq=dU+pDV
Dq=di-VdP
Билет №6
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q1 у нагревателя, отдав Q2 холодильнику и совершив при этом работу A = Q1 − Q2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
[ править]
править]
Ограничения
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала. Смотри также Демон Максвелла.
[править]
Второе начало термодинамики и «тепловая смерть Вселенной»
К лаузиус,
рассматривая второе начало термодинамики,
пришёл к выводу, что энтропия Вселенной
как замкнутой системы стремится к
максимуму, и в конце концов во Вселенной
закончатся все макроскопические
процессы. Это состояние Вселенной
получило название «тепловой смерти».
С другой стороны, Больцман высказал
мнение, что нынешнее состояние Вселенной
— это гигантская флуктуация, из чего
следует, что большую часть времени
Вселенная все равно пребывает в состоянии
термодинамического равновесия («тепловой
смерти»)[3].
лаузиус,
рассматривая второе начало термодинамики,
пришёл к выводу, что энтропия Вселенной
как замкнутой системы стремится к
максимуму, и в конце концов во Вселенной
закончатся все макроскопические
процессы. Это состояние Вселенной
получило название «тепловой смерти».
С другой стороны, Больцман высказал
мнение, что нынешнее состояние Вселенной
— это гигантская флуктуация, из чего
следует, что большую часть времени
Вселенная все равно пребывает в состоянии
термодинамического равновесия («тепловой
смерти»)[3].
Билет№7
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
объём частицы газа равен нулю (то есть, диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними, ) [1];
импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
![]()
где p — давление, n — концентрация частиц, k — постоянная Больцмана,T — абсолютная температура.
Для любого идеального газа справедливо соотношение Майера:
![]()
где R — универсальная газовая постоянная, Cp — молярная теплоемкость при постоянном давлении, Cv — молярная теплоемкость при постоянном объёме.
Билет№8
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
dQ— подведённая к телу теплота, измеренная в джоулях
[1] dA— работа, совершаемая телом против внешних сил, измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Энтальпия-чисто математическая величина хар-ая содержание системы
I=U+pV дельта i=i2-i1
Энтропия это отношение получен-ной или отданной теплоты к температу-ре, при которой происходил этот процесс.
![]()
Энтропия
 ,
,
 .
.
У дельная
энтропия
дельная
энтропия
 ,
.
,
.
Энтропия, как и время, всё время возрастает. Только в изолированной системе энтропия может оставаться постоянной.

При
давлении
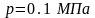 и температуре
и температуре
 удельная энтропия
удельная энтропия
 .
.
 ,
где
,
где
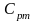 - вторая средняя теплоёмкость или
логарифмическая теплоёмкость.
- вторая средняя теплоёмкость или
логарифмическая теплоёмкость.
Так
как
 ,
то если энтропия растёт, то есть
,
то если энтропия растёт, то есть
 ,
то тепло подводится, то есть
,
то тепло подводится, то есть
 .
.
Уравнение, определяющее энтропию:
Билет№9
Теплоёмкость.
теплоёмкость –количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная
теплоемкость: ,
где
,
где
 - какой-то процесс.
- какой-то процесс.
 .
При изохорном процессе
.
При изохорном процессе
 ,
следовательно, получаем изохорную
теплоёмкость -
,
следовательно, получаем изохорную
теплоёмкость -
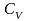 .
При изобарном процессе
.
При изобарном процессе
 ,
следовательно, получаем изобарную
теплоёмкость
,
следовательно, получаем изобарную
теплоёмкость
 .
.
Объёмная
теплоёмкость
 :
:
Объемная изобарная теплоёмкость -
 .
.Объёмная изохорная теплоёмкость -
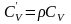 .
.
Молярная
теплоёмкость
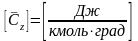 :
:
Молярная изобарная теплоёмкость -
 .
.Молярная изохорная теплоёмкость -
 .
.
С![]() редняя
теплоёмкость
редняя
теплоёмкость
 .
.
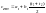 -первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
-первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
Билет 102 Изобарный процесс (Рис.4.2).
P = Const , P2 = P1
Уравнение состояния процесса:
n 2 /n 1 = T2 / T1 , (4.13)
Работа этого процесса:
l = P·(n 2 - n 1). (4.14)
Уравнение 1-го закона ТД имеет вид:

q = Du + l = ср·(t2 - t1); (4.15)
Билет11 Изохорный процесс (Рис.4.1).
n = Const , n 2 = n 1. (4.10)
Уравнение состояния процесса:
P2 / P1 = T2 / T1. (4.11)
Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона ТД имеет вид:
q = Du = сv·(t2 - t1); (4.12)

Билет 12 Изотермический процесс (Рис.4.3).
Т = Const , Т2 = Т1
Уравнение состояния:
P1 / P2 = n 2 / n 1 , (4.16)
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона ТД будет иметь вид:
q = l = R·T·ln(n 2/n 1), (4.17)
или q = l = R·T·ln(P1/P2), (4.18)

Билет 13 Адиабатный процесс (Рис.4.4).
В данном процессе не подводится и не отводится тепло,т.е. q =0.
Уравнение состояния:
P· n к =Const, (4.19)
где к = cp / cv – показатель адиабаты.
Уравнение 1-го закона ТД будет иметь вид:
l = -Du = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20)
или
l = R·(T1 – T2) / (l -1); (4.21)
l = R·T1·[1 – (n 1/ n 2) l -1] /(l – 1); (4.22)
l = R·T2·[1 – (P2/P1) (l -1)/ l] /(l – 1). (4.23)

Рис. 4.4. Взаимное расположение адиабаты 1 и изотермы 2 идеального
14 Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.

Для идеального
газа уравнение политропы может быть
записано в виде: pVn
= const где величина
![]() называется показателем политропы.
называется показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
4. Изохорный процесс:
![]() ,
так как
,
так как
![]() ,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n) , значит,
чтобы V2
/ V1
обратились в 1, n должна быть бесконечность.
,
значит P1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n) , значит,
чтобы V2
/ V1
обратились в 1, n должна быть бесконечность.
Вопрос № 15
Политропный процесс Уравнение политропного процесса имеет вид
г де
n - показатель политропы, который
изменяется для разных процессов от 0
до + бесконечности.
Рассмотренные
ранее процессы являются частными
случаями иолитроппых процессов:
де
n - показатель политропы, который
изменяется для разных процессов от 0
до + бесконечности.
Рассмотренные
ранее процессы являются частными
случаями иолитроппых процессов:
е![]()
![]() сли
n = к, то pvk = const — адиабатный процесс;
если
n = 1, то pv = const — изотермический
процесс;
если n = 0, то pv0 = p
= const — изобарный процесс;
если n ±
?, то представив pvn = const как рn v = const, имеем
v=const
— изохорный процесс.
Показатель
изотропы n
можно
определить, если известны два состояния
политропном процесс
сли
n = к, то pvk = const — адиабатный процесс;
если
n = 1, то pv = const — изотермический
процесс;
если n = 0, то pv0 = p
= const — изобарный процесс;
если n ±
?, то представив pvn = const как рn v = const, имеем
v=const
— изохорный процесс.
Показатель
изотропы n
можно
определить, если известны два состояния
политропном процесс
![]()
Г![]() рафическое
изображение политропного процесса в
р—v-диа-грамме
имеет вид кривой, которая называется
политропой.
Соотношение параметров данного
процесса можно получить, заменив в
уравнениях адиабатного процесса
показатель степени k
на показатель n:
Изменение
внутренней энергии в политропном
процессе
для произвольной массы
вещества определяется по формуле
рафическое
изображение политропного процесса в
р—v-диа-грамме
имеет вид кривой, которая называется
политропой.
Соотношение параметров данного
процесса можно получить, заменив в
уравнениях адиабатного процесса
показатель степени k
на показатель n:
Изменение
внутренней энергии в политропном
процессе
для произвольной массы
вещества определяется по формуле
Р![]() абота
изменения объема в политропном процессе
для
1 кг рабочего тела равна
абота
изменения объема в политропном процессе
для
1 кг рабочего тела равна
и![]() ли,
учитывая уравнение состояния Клапейрона,
ли,
учитывая уравнение состояния Клапейрона,
Для произвольной массы газа
![]()
Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики
![]()
![]()
Билет16
Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики
![]()
![]()
Робота политропного процесса определяется
аналогично как при адиабатном процессе:
l = R·(T1 – T2) / (n – 1); l = R·T1·[1 – ( 1/ 2) n-1] /(n – 1); l = R·T2·[1 – (P2/P1) (n-1)/ n] /(n – 1).
Теплота процесса: q = cn ·(T2 – T1),
где cn = cv ·(n - k)/(n – 1) – массовая теплоёмкость
политропного процесса. Характеристикой полит-
ропного процесса может быть доля удельной
теплоты, расходуемой на изменение удельной
внутренней энергии идеального газа, которая
в данном процессе постоянна.
