
- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
Фазой называется одно тело или группа тел, имеющих одинаковый состав и структуру в любой точке и отделенных границей раздела от других фаз.
Агрегатное (фазовое) превращение — переход вещества из одной фазы в другую.
Фазовые превращения:
Плавление (обратный - кристаллизация)
Испарение (конденсация)
Сублимация или возгонка (конденсация)
Переход из одной кристаллической модификации в другую (графит - алмаз)
Процессы фазовых превращений индивидуальных веществ являются изотермическими.
Основным уравнением, описывающим фазовые переходы, является уравнение Клапейрона-Клаузиуса:
*Из условия равновесия фаз можно получить зависимость давления в равновесной системе от температуры. Если говорить о равновесии жидкость — пар, то под давлением понимают давление насыщенных паров, а зависимость P = P(T) называется кривой испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:
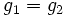 ,
где
,
где
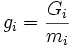 ,
Gi
— потенциал Гиббса i-й фазы, mi
— её масса.
,
Gi
— потенциал Гиббса i-й фазы, mi
— её масса.
Отсюда:
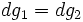 ,
а значит,
,
а значит,
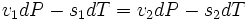 ,
где v1
и s1
— удельные объем и энтропия
фаз. Отсюда следует, что
,
где v1
и s1
— удельные объем и энтропия
фаз. Отсюда следует, что
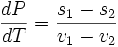 ,
и окончательно
,
и окончательно
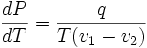 ,
,
где q — удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
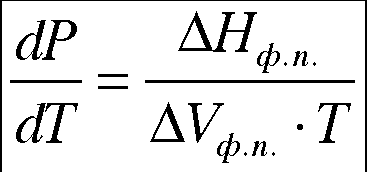
Фазовый переход, фазовое превращение, в широком смысле – переход вещества из одной фазы в другую при изменении внешних условий – температуры, давления, магнитного и электрического полей и т.д.; в узком смысле – скачкообразное изменение физических свойств при непрерывном изменении внешних параметров.
Различают Ф. п. двух родов. При Ф. п. первого рода скачком меняются такие термодинамические характеристики вещества, как плотность, концентрация компонент; в единице массы выделяется или поглощается вполне определённое количество теплоты, носящее название теплоты перехода. При Ф. п. второго рода некоторая физическая величина, равная нулю с одной стороны от точки перехода, постепенно растет (от нуля) при удалении от точки перехода в другую сторону. При этом плотность и концентрации изменяются непрерывно, теплота не выделяется и не поглощается.
Ф. п. – широко распространённое в природе явление. К Ф. п. 1 рода относятся: испарение и конденсация, плавление и затвердевание, сублимация и конденсация в твёрдую фазу, некоторые структурные переходы в твёрдых телах, например образование мартенсита в сплаве железо – углерод.
23. Уравнение Клапейрона — Клаузиуса
Уравнение Клапейрона-Клаузиуса — основное уравнение, описывающее фазовые превращения.
Рассмотрим G = H-TS - энергию Гиббса, так как процесс изотермический для индивидуального вещества.
Энтальпия есть H = U + PV, тогда
G = U + PV - TS. Продифференцируем:
dG = dU + PdV + VdP - TdS - SdT
Рассмотрим изолированную систему, находящуюся в равновесии (например, жидкость-пар). Равновесие заключается в том, что за единицу времени определенное число молекул переходит из жидкой фазы в газообразную. За это же самое время ровно такое же число молекул переходит из газообразной фазы в жидкую.
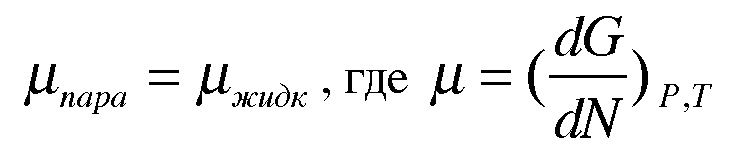
Это значит, что
- химический потенциал компонента системы.
В изолированной системе равновесие при dS = 0 .
Также учтем, что
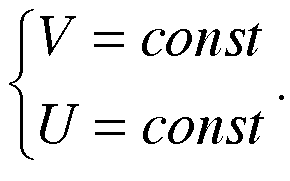
dG=dU+PdV+VdP-TdS-SdT (dU=0; dV=0; dS=0)
dG=VdP-SdT
dG1=V1dP-S1dT
dG2=V2dP-S2dT
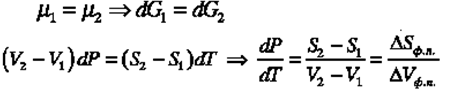
Перейдем к конечным разностям AG = VAP - SAT. Рассмотрим две фазы:
Вычтем из выражения (2) выражение (1):
![]()
- изменение энтропии при фазовом переходе;
![]()
- изменение объема при фазовом переходе;
![]()
Так как температура фазового перехода зависит от давления, то индекс ф.п. опускаем.
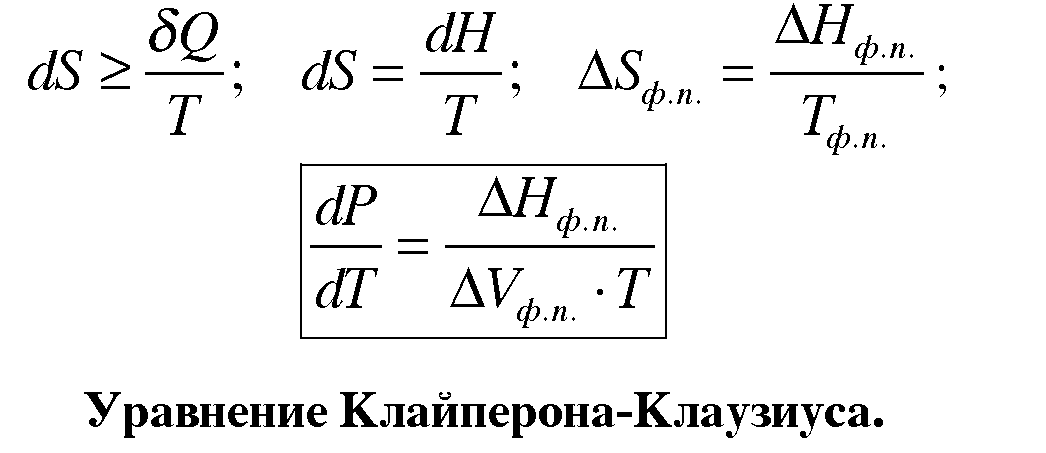
Клапейрона — Клаузиуса уравнение, термодинамическое уравнение, относящееся к процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно К. — К. у теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесно протекающем процессе определяется выражением
![]()
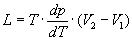 ,
(1)
,
(1)
где Т — температура перехода (процесс изотермический), dp/dT — значение производной от давления по температуре при данной температуре перехода, (V2—V1) — изменение объёма вещества при переходе его из первой фазы во вторую.
Первоначально уравнение было получено в 1834 Б. П. Э. Клапейроном из анализа Карно цикла для конденсирующегося пара, находящегося в тепловом равновесии с жидкостью. В 1850 P. Клаузиус усовершенствовал уравнение и распространил его на др. фазовые переходы. К. — К. у. применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т. н. фазовым переходом 1 рода), и является прямым следствием условий фазового равновесия, из которых оно и выводится.
К. — К. у. может служить для расчёта любой из величин, входящих в уравнение, если остальные известны. В частности, с его помощью рассчитывают теплоты испарения, экспериментальное определение которых сопряжено со значительными трудностями.
Часто К. — К. у. записывают относительно производных dp/dT или dT/dp:
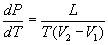 (2)
(2)
Для процессов испарения и сублимации dp/dT выражает изменение давления насыщенного пара р с температурой Т, а для процессов плавления и полиморфного превращения dT/dp определяет изменение температуры перехода с давлением. Иными словами, К. — К. у. является дифференциальным уравнением кривой фазового равновесия в переменных р, Т.
Для решения К. — К. у. необходимо знать, как изменяются с температурой и давлением величины L, V1 и V2, что представляет сложную задачу. Обычно эту зависимость устанавливают эмпирически и решают К. — К. у. численно.
К. — К. у. применимо как к чистым веществам, так и к растворам и отдельным компонентам растворов. В последнем случае К. — К. у. связывает парциальное давление насыщенного пара данного компонента с его парциальной теплотой испарения.
