
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Классификация неорганических веществ по составу
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •Диссоциация воды. Водородный и гидроксильный показатели
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •Основные понятия
- •Направление протекания окислительно-восстановительных реакций
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •Электрохимические процессы
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •Электрохимическая коррозия
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы
- •Библиографический список
- •Содержание
Электрохимические процессы
9.1. Основные понятия
Электрохимический процесс – окислительно-восстановительный процесс, протекающий на электродах с участием электрического тока.
Особенности электрохимических процессов
1) - пространственное разделение процессов окисления и восстановления;
2) - наличие внешней цепи (металлический проводник) и внутренней цепи (электролит) (рис. 6);
3) - первичные реакции идут на «электродах» – поверхности контакта металлического проводника и электролита;
катод – электрод, на котором идет процесс восстановления;
анод – электрод, на котором идет процесс окисления.


 внешняя цепь
(металлический проводник)
внешняя цепь
(металлический проводник)


электро-
лит

 внутренняя
цепь
внутренняя
цепь
электроды
Рис. 6. Схема электролитической ячейки
Электрохимические процессы подразделяются на две группы
а) процессы, происходящие в гальванических элементах и сопровождающиеся возникновением электрической энергии за счет химических процессов;
б) процессы, протекающие в элетролизерах под действием электрической энергии от внешнего источника тока, вызывающей химические реакции на электродах.
Сравнение процессов в гальванических элементах и электролиза
Электрохимический процесс |
с получением электрической энергии |
с потреблением электрической энергии |
Преобразование энергии |
Преобразование химической энергии в электрическую |
Преобразование электрической энергии в химическую энергию продуктов электролиза
|
Протекание процесса |
Самопроизвольное |
Принудительное |
Устройство |
Гальванический элемент |
Электролизер |
Знак заряда катода анода |
+ – |
– + |
Воздействие перенапряжения |
Напряжение снижается |
Напряжение повышается |
Наименование процессов |
|
|
9.2. Гальванический элемент
Гальванический элемент – устройство, в котором химическая энергия самопроизвольно протекающей окислительно-восстановительной реакции превращается в электрическую энергию. Гальванический элемент содержит два полуэлемента, между электродами которых возникает разность потенциалов.
Принцип работы гальванического элемента иллюстрирует гальванический элемент Даниэля-Якоби, состоящий из цинкового и медного полуэлементов (рис. 7).
В цинковом полуэлементе металлическая цинковая пластина погружена в водный раствор соли цинка, с концентрацией [Zn2+]=1 моль/л. В медном полуэлементе – металлическая медная пластина погружена в водный раствор соли меди (II) с концентрацией [Cu2+]=1 моль/л. Цинковая и медная пластины соединены металлическим проводником, растворы солей – «солевым мостиком» («электролитический ключ»).
Вольтметр
Cu-катод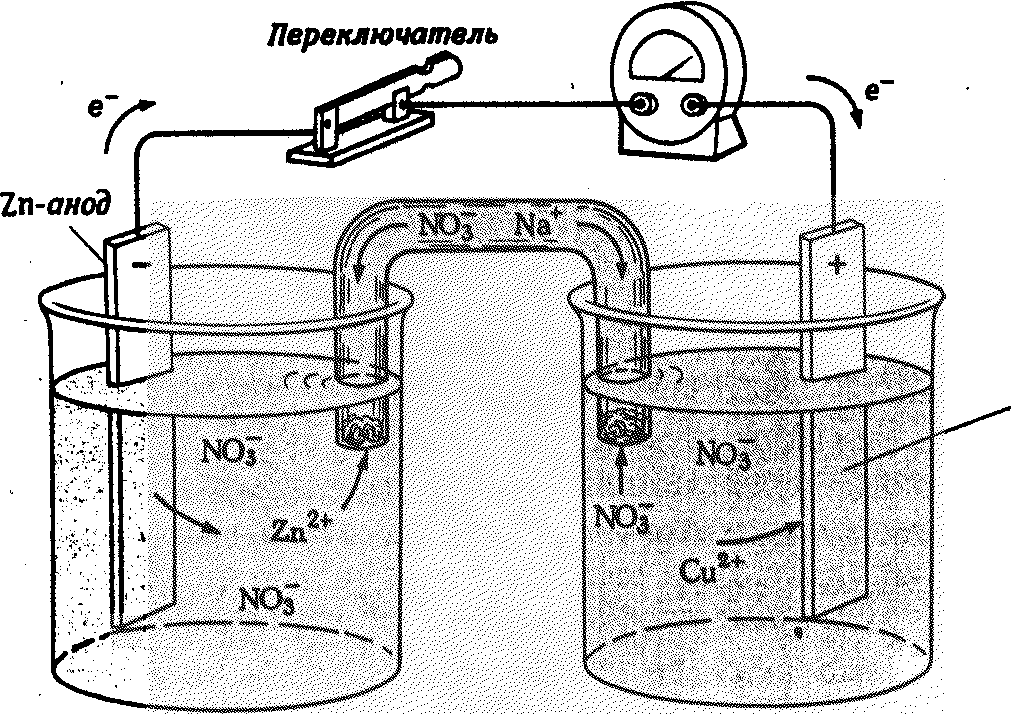
Рис. 7. Гальванический элемент Даниэля-Якоби
До замыкания цепи на каждой из металлических пластин на границе с
раствором устанавливаются равновесия:
Cuo(тв.)
Сu2+(р-р) +
2e(на мет.); ![]()
Zno(тв.)
Zn2+(р-р) + 2e(на
мет.); ![]()
Цинковая пластина заряжена более отрицательно, чем медная. Между ними возникает разность потенциалов. При замыкании системы в цепь равновесия на границе металл–раствор нарушаются. По внешней цепи – металлическому проводнику – избыток электронов с Zn–пластины переходит на Cu–пластину, где их концентрация меньше, так как < .
В результате, равновесие на Zn-пластине смещается вправо, идет окисление металлического цинка.
На Cu-пластине равновесие смещается влево, протекает восстановление ионов меди (II).
Анод Zn(тв.) – 2e → Zn2+(р-р) (процесс окисления)
Катод Cu2+(р-р) + 2e → Сuo(тв.) (процесс восстановления)

Ионное
уравнение Zn(тв.) + Cu2+(р-р) → Zn2+(р-р) + Cuo(тв.)
суммарной реакции
Молекулярное Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
уравнение суммарной реакции
Между растворами электролитов также возникает разность потенциалов. В цинковом полуэлементе в результате растворения цинка увеличивается концентрация ионов Zn2+, в растворе создается избыток положительно заряженных ионов. В медном полуэлементе в результате осаждения меди концентрация ионов Cu2+ уменьшается и в растворе создается избыток отрицательно заряженных ионов. По внутренней цепи – «солевому мостику» – катионы и анионы перемещаются навстречу друг другу. Таким образом, в системе возникает направленное перемещение заряженных частиц, т.е. возникает электрический ток.
Электродвижущая сила – ЭДС – гальванического элемента определяется разностью потенциалов катода и анода
![]() > 0
> 0
По мере работы гальванического элемента значения потенциалов катода и анода изменяются.
Поскольку молярная концентрация ионов Cu2+ – уменьшается, в соответствии с уравнением Нернста уменьшается потенциал катода
![]() .
.
Молярная концентрация ионов Zn2+– [Zn2+] – увеличивается, следовательно, увеличивается потенциал анода
![]() .
.
Таким образом, по мере работы гальванического элемента ЭДС уменьшается, так как происходящие на электродах процессы приводят к выравниванию потенциалов. Система приходит в равновесие и гальванический элемент прекращает работу при условии
![]()
Схема записи гальванического элемента
Для обозначения гальванического элемента используют символическую запись, упрощающую их описание.
Например, элемент Даниэля-Якоби, может быть описан следующей краткой схемой
ө
 Zn| ZnSO4
| | CuSO4 | Cu
Zn| ZnSO4
| | CuSO4 | Cu
![]()
 C1
C2
C1
C2
полуэлемент полуэлемент
анод катод
граница раздела обозначение «солевого мостика»,
металл-раствор т.е. полуэлементы пространственно
(реакция идет разделены, электролиты соединяются
на электроде) «солевым мостиком»
