
- •Рабочая тетрадь для записи лекций по дисциплине «Основы биоорганической химии»
- •Принцип жмко.
- •Принцип жмко (принцип Пирсона)
- •Классификация кислот и оснований по Пирсону
- •Факторы, определяющие реакционную способность органического вещества
- •Свободно-радикальные процессы
- •Электрофильные реакции.
- •1. Галогенирование алкенов:
- •Примеры реакций электрофильного замещения:
- •Региоселективность реакций электрофильного замещения
- •Факторы, влияющие на скорость реакции:
- •1. Структура субстрата
- •2. Нуклеофильная сила
- •3. Уходящая группа - должна быть хорошей
- •4. Стереохимия реакции
- •Элиминирование - побочный процесс нуклеофильному замещению
- •Замещение карбонильного кислорода на азотсодержащие группировки
- •Реакции sn для альдегидов и кетонов
- •Реакции с участием сн-кислотного центра
ГБОУ ВПО КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ МИНЗДРАВСОЦРАЗВИТИЯ РОССИИ
КОМИ ФИЛИАЛ
Кафедра химии, физики и биологии
Рабочая тетрадь для записи лекций по дисциплине «Основы биоорганической химии»
для студентов 1 курса лечебного факультета
Ф. И. О. _____________________
N группы ___________________
Сыктывкар 2012
Составители: доценты кафедры химии, физики и биологии Коми Филиала Кировской ГМА Е.И. Казакова и Н.И. Никитина.
Содержание
-
Классификация и номенклатура органических соединений…………........
Характеристика связей. Сопряжение. Ароматичность…………………….
Кислотность и основность органических соединений……………….........
Основные закономерности протекания органических реакций…………..
Механизмы органических реакций…………………………………….........
Реакции нуклеофильного замещения……………………………………….
Реакции нуклеофильного присоединения…………………………………..
3
11
14
19
22
30
36
Введение
Биоорганическая химия
изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций.
Объекты биоорганической химии
Биополимеры (и их структурные компоненты) - высокомолекулярные природные соединения, служащие структурной основой живых организмов (пептиды и белки, углеводы, нуклеиновые кислоты, липиды).
Биорегуляторы – соединения, регулирующие обмен веществ (витамины, гормоны, синтетические биологически активные вещества, в том числе и лекарственные вещества).
Тема: Классификация и номенклатура органических соединений
В основе классификации приняты два важнейших признака: строение углеродного скелета и наличие в молекуле функциональных групп.
В органических молекулах атомы углерода соединяются друг с другом, образуя «каркас» молекулы, называемый также углеродным скелетом или цепью. Цепи бывают открытыми и замкнутыми (циклическими); открытые цепи могут быть неразветвленными (нормальными) и разветвленными.
По строению углеродного скелета органические соединения делятся на три большие группы:
ациклические (алифатические) – имеют открытую углеродную цепь;
карбоциклические – имеют закрытую углеродную цепь (кольцо).
гетероциклические (от греч. heteros – другой) – содержат в цикле кроме атомов углерода атомы других элементов (чаще O, N, S).
Функциональная группа – это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному классу. Полифункциональные соединения содержат несколько функциональных групп.
Гетерофункциональные соединения содержат различные по природе функциональные группы.
Функциональная группа |
Название класса |
Общая формула класса |
|
||||
Формула |
Название |
|
|||||
-F,-Cl,-Br,-I -OH -OR -SH -SR -NH2 -NO2 -CO -COOH -SO3H -CN -COOR -CONH2 |
галогены гидроксильная алкоксильная тиольная алкилтиольная амино нитро карбонильная карбоксильная сульфо циано алкоксикарбонильная карбоксамидная |
галогенпроизводные спирты, фенолы простые эфиры тиолы (меркаптаны) тиоэфиры амины нитросоединения альдегиды, кетоны карбоновые кислоты сульфокислоты нитрилы сложные эфиры амиды |
R-Hal R-OH R-OR’ R-SH R-SR’ R-NH2 R-NO2 R-CHO, RCOR R-COOH R-SO3H R-CN R-COOR R-CONH2 |
|
|||
Структура |
Номенклатура
|
||||||
Заместительная (ИЮПАК) |
Тривиальная |
Рациональная |
|||||
С2Н5Сl
С2Н5OH
С2Н5OС2Н5
С2Н5-O-CH3
С2Н5SH
С2Н5SСН3
(СН5)2CH-NH2
СН3NO2
НСHO
С6Н5СHO
СН3-CO-СН3
НСOOH
СН3СOOH
С6Н5-SO3H
СН3-CN
СН3СOOС2Н5
Н-СO-NH2 |
|
|
|
||||
Органический радикал – остаток молекулы, из которой удалены 1, 2… или несколько атомов водорода, при этом остаются 1 или несколько валентностей:

Родоначальная структура – химическая структура, составляющая основу названия (главная углеродная цепь или цикл).
Характеристическая группа – функциональная группа, связанная с родоначальной или частично входящая в нее.
Заместитель – любой атом или группа атомов, замещающая в исходном соединении атом водорода (заместитель может быть и характеристической группой и углеводородным радикалом).
Порядок старшинств функциональных групп и их название
Характеристи-ческая группа |
Префикс |
Суффикс |
(C)OOH COOH SO3H -(C)HO -CHO -CO -OH -SH -NH2 -NO2 -OR -F, -Cl, -Br, -I |
- карбокси сульфо оксо формил оксо гидрокси меркапто амино нитро алкокси фтор, хлор, бром, иод |
овая кислота карбоновая кислота сульфоновая кислота аль карбальдегид он ол тиол амин - - - |


![]()
Тривиальные названия:

Пространственное строение
Конфигурация – различное расположение атомов в пространстве при одинаковом химическом строении.

Конформация – один из нескольких возможных способов расположения атомов в пространстве в молекуле данной конфигурации, обусловленный вращением вокруг простых (одинарных) связей.

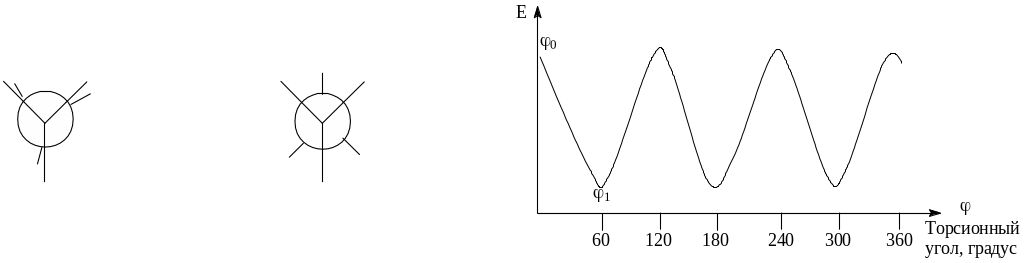
Номенклатура пространственных изомеров
1. Цис-транс- и Z, E- для геометрических изомеров


2. D, L- и R, S-номенклатура для оптических изомеров
Условие возникновения оптической изомерии -


D,L-номенклатуру используют при определении
R,S-номенклатуру используют при определении

Правила обращения с проекционными формулами Фишера
1. Нельзя выводить из плоскости.
2. Можно поворачивать всю проекцию на 1800, 3600 и т.п.
3. Можно делать четное число перестановок любых двух заместителей.
4. Можно вращать по или против часовой стрелки любые три заместителя одновременно.
Направление падения старшинства заместителей по часовой стрелке обозначается буквой R, а против часовой стрелки – буквой S.
(Старшинство заместителей определяется порядковым номером элемента).

Стереоизомерия циклогексана

a - аксиальные e – экваториальные Конверсия циклогексана:


Тема: Характеристика связей. Сопряжение. Ароматичность.
Энергия связей (кДж/моль) представляет собой энергию, выделяющуюся при ее образовании или необходимую для разъединения двух связанных атомов. Энергия служит мерой прочности связи: чем больше энергия, тем связь прочнее.
Длина связи – это расстояние (нм) между центрами связанных атомов. Двойная связь короче одинарной, а тройная - двойной.
Для связей между атомами углерода, находящихся в разном состоянии гибридизации, характерна общая закономерность – с увеличением доли S-орбитали в гибридной орбитали уменьшается длина связи:
sp3 sp3 sp3 sp2 sp3 sp
C-C C-C= C-C≡
Полярность связи обусловлена неравномерным распределением электронной плотности. Полярность молекулы количественно оценивают величиной ее дипольного момента, измеряемого в кулон-метрах или дебаях: 1Д = 3,4*10-30 Кл*м. Чем больше дипольный момент, тем связь полярнее. Причиной полярности связей служит различие в электроотрицательности связанных атомов.
Электроотрицательность характеризует способность атома в молекуле удерживать валентные электроны. Л. Полинг, основываясь на значениях энергии связей, предложил количественную характеристику электроотрицательности атомов:
Na Li H S C I Br Cl N O F
0.9 1.0 2.1 2.5 2.5 2.5 2.8 3.0 3.0 3.5 4.0
Электроотрицательность элемента не является константой, а зависит, например, от состояния гибридизации:
sp3 sp2 sp
C - C – C – и от влияния заместителей.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. По поляризуемости π-связь значительно превосходит σ-связь, т.к. максимум электронной плотности π-связи располагается дальше от связываемых ядер.
Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей с помощью так называемых электронных эффектов.
Смещение электронной плотности по цепи σ-связей в сторону более электроотрицательного атома называется индуктивным эффектом.
Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех σ-связей также обозначают прямыми стрелкам:
![]()
Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность σ-связи от атома углерода проявляют отрицательный индуктивный эффект (-I).
Электродонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность σ-связи к атому углерода проявляют положительный индуктивный эффект (+I).
+I R - алифатический углеводородный радикал
-I Hal, NH2, OH, CHO, COOH, NO2, SO3H, CN.
Смещение π-электронов или неподеленных электронных пар по сопряженной системе называется мезомерным эффектом (М):

При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная и другие группы), неподеленную пару электронов гетероатома (галогены, амино- и гидроксогруппы).
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М).
Ковалентная связь

локализованная делокализованная
электроны поделены между двумя электроны связи поделены более чем
ядрами связываемых атомов между двумя ядрами
Делокализованная связь – ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов. Делокализованные связи практически всегда являются π-связями. Они характерны для сопряженных систем – соединений, содержащих кратные связи, отделенные одной простой связью от соседнего атома, имеющего р-орбиталь.
Участвующие в сопряжении делокализованные р-орбитали могут принадлежать либо двум и более π-связям, либо π-связи и одному атому с р-орбиталью. В соответствии с этим различают π, π- и р, π-сопряжение.
π,π-сопряженные системы:
CH2=CH-CH=CH2 CH2=C(CH3)-CH=CH2 CH2=CH-COOH
C6H6 CH2=CH-C≡ N
p,π-сопряженные системы:
СH2=CH-COO- C6H5-OH CH3–CO-OR CH3–CO-NH2 CH2=CH-CH2+
Образование сопряженной системы – энергетически выгодный процесс, т.к. при этом увеличивается степень перекрывания орбиталей и происходит делокализации р-электронов. Поэтому сопряженные системы обладают повышенной термодинамической устойчивостью (Есопр для бутадиена-1,3 равна 15 кДж/моль). С увеличением длины сопряженной цепи энергия сопряжения, и соответственно, термодинамическая устойчивость соединения возрастают.



Соединение ароматично, если оно имеет плоский замкнутый цикл и сопряженную π-электронную систему, охватывающую все атомы цикла и содержащую (4n+2) π-электронов (правило Хюккеля), где n = 0,1,2,3…
Етеорет(бензол)=3ЕС-С+3ЕС=С+6ЕС-Н=3*339+3*616+6*415=5355 кДж/моль
Епракт(бензол) =
Есопряжения (бензол) = кДж/моль – энергия резонанса.
Условие сопряжения – параллельность орбиталей р-электронов, образующих π-связи.
Ароматические соединения могут состоять из нескольких циклов:
конденсированные бензоидные системы: - гетероциклические (бензоидные) системы:
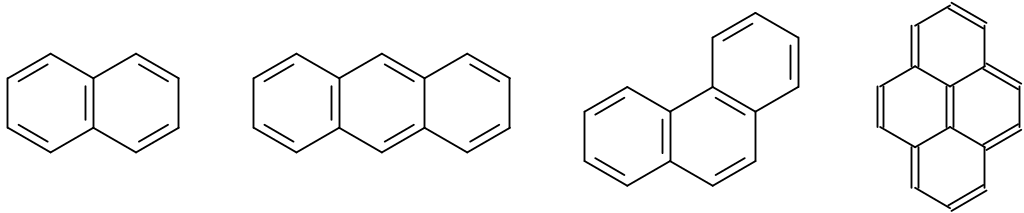

- гетероциклические небензоидные системы: - карбоциклические небензоидные системы:

![]()

Тема: Кислотность и основность органических соединений.
