
Лекция 8
6. Реальные газы
6.1. Силы межмолекулярного взаимодействия в газах
6.2. Газ Ван-дер-Ваальса
6.3. Изотермы реальных газов.
6.4. Внутренняя энергия реального газа.
6.5. Эффект Джоуля-Томсона
6.1. Силы межмолекулярного взаимодействия в газах
Модель идеального газа, используемая в молекулярно – кинетической теории газов, позволяет довольно хорошо описывать поведение разреженных реальных газов.
Свойства не сильно разреженных газов
отличаются от свойств идеальных газов,
подчиняющихся уравнению Клапейрона —
Менделеева.
![]()
Из этого уравнения следует, что отношение называемое фактором сжимаемости, для идеальных газов всегда равно единице.
Однако опыты показывают, что
факторы сжимаемости для всех газов зависят от давления и температуры. При достаточно высоких давлениях все реальные газы независимо от их температуры менее сжимаемы, чем идеальные.
экспериментальные исследования удельной теплоемкости, вязкости и других свойств газов показали, что эти свойства тоже более или менее значительно отличаются от соответствующих свойств идеальных газов. Более того, приближенная теория, основанная на законах идеальных газов, часто не в состоянии объяснить даже качественно характер зависимости свойств газов от их параметров состояния.
Причина этих трудностей кроется в том, что поведение молекул реальных газов отлично от того, какое приписывается частицам идеальных газов.
Во всех телах (твердых, жидких и газообразных) молекулы взаимодействуют друг с другом. Тот факт, что свойства разреженных газов близки к свойствам идеальных газов, свидетельствует о том, что силы взаимодействия между молекулами в сильной степени зависят от расстояния между ними. Эти силы имеют электромагнитную, а также особую квантовую природу.
Опыты показывают, что при расстояниях более 10-7 см межмолекулярным взаимодействием можно пренебречь.
Своеобразные свойства поверхностного слоя жидкостей, а также способность твердых тел сопротивляться растяжению приводят к выводу о том, что между молекулами вещества в любом агрегатном состоянии действуют силы взаимного притяжения.
Относительно малая сжимаемость сильно уплотненных газов, а также способность жидких и твердых тел сопротивляться сжатию указывают на то, что между молекулами действуют также и силы взаимного отталкивания.
Существенно, что
эти силы действуют одновременно. В противном случае тела не были бы устойчивы: образующие их частицы разлетались бы в разные стороны или «слипались» бы.
зависимость сил взаимного притяжения и отталкивания от расстояния r между молекулами должна быть различной:
- на очень близких расстояниях преобладают
силы отталкивания
![]() ,
,
- на более далеких — силы взаимного
притяжения
![]() ,
,
Причем
![]() ,
,
![]()
где —
![]() радиус-вектор,
проведенный в точку нахождения
рассматриваемой молекулы из той точки,
в которой находится другая молекула,
действующая на первую с силами
и
.
радиус-вектор,
проведенный в точку нахождения
рассматриваемой молекулы из той точки,
в которой находится другая молекула,
действующая на первую с силами
и
.
Проекции F1r и F2r сил и на направление вектора зависят от расстояния r между взаимодействующими молекулами.
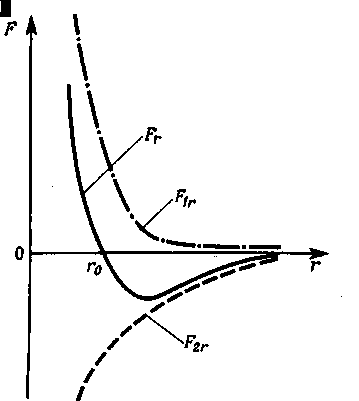 Примерный
характер этих зависимостей показан
на рис. 6.1.
Примерный
характер этих зависимостей показан
на рис. 6.1.
Результирующая сила
![]()
Причем
![]()
Характер зависимости Fr от r также показан на рис. 6.1.
При r = r0 силы и взаимно уравновешиваются и результирующая сила F = 0.
если r > r0 - преобладают силы взаимного притяжения (отрицательные)
если r < r0 — преобладают силы отталкивания (положительные).
Таким образом, r0— это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
Рассмотрим взаимную потенциальную энергию Wn двух молекул.
Подсчитаем элементарную работу
![]() ,
совершаемую результирующей потенциальной
силой
,
совершаемую результирующей потенциальной
силой
![]() межмолекулярного взаимодействия
при увеличении расстояния между
молекулами на dr:
межмолекулярного взаимодействия
при увеличении расстояния между
молекулами на dr:
![]() (6.1)
(6.1)
С другой стороны, эта работа совершается за счет уменьшения взаимной потенциальной энергии молекул:
![]() (6.1/)
(6.1/)
Из уравнений (6.1) и (6.1/) следует
![]()
![]() (6.3)
(6.3)
Интегрируя выражение (6.3) по r от r до ∞, получаем
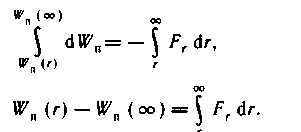
На бесконечно большом расстоянии друг от друга молекулы не взаимодействуют.
П![]() оэтому
взаимную потенциальную энергию
Wn
(∞) двух
бесконечно удаленных
друг от друга молекул удобно принять
равной нулю.
оэтому
взаимную потенциальную энергию
Wn
(∞) двух
бесконечно удаленных
друг от друга молекул удобно принять
равной нулю.
Окончательно, (6.4)
Интеграл, стоящий справа, можно найти графически, если задана зависимость силы Fr , от r (рис.6.1).
Он пропорционален площади, ограниченной кривой Fr = Fr(r), осью r и вертикалью (r = const) соответствующей тому значению r, для которого нужно найти Wn.
Из рис. 6.1 видно, что
r > r0 при взаимная потенциальная энергия отрицательна, так как Fr<0.
П
 ри
r = r0,
как видно из (6.3),
ри
r = r0,
как видно из (6.3),
![]() ,
(6.5)
,
(6.5)
т. е. Wn достигает минимума
Типичная кривая зависимости энергии взаимодействия Uвз от расстояния r между их центрами приведена на рисунке 6.2.
При сближении молекул до расстояния r0 их
- взаимная потенциальная энергия уменьшается,
- а кинетическая - увеличивается.
Это происходит за счет положительной работы, совершаемой результирующей силой взаимного притяжения молекул (при r > r0 Fr<0).
Дальнейшее уменьшение расстояния между молекулами сопряжено с совершением ими работы против результирующей силы F взаимного отталкивания молекул (при r<r0 Fr>0). Соответственно взаимная потенциальная энергия молекул начинает расти с уменьшением r.
Если молекулы находятся достаточно далеко друг от друга, то их взаимная потенциальная энергия равна нулю, а полная энергия W этой консервативной системы равна их кинетической энергии WK.
К моменту максимального сближения молекул (r = r0)
-
вся их кинетическая
энергия
оказывается полностью израсходованной
на совершение работы против сил
отталкивания
![]()
- а их взаимная потенциальная энергия Wn (rx) = W.
При прочих равных условиях расстояние r1 тем меньше, чем выше температура газа
зависимость Wn от r в области положительных значений Wn настолько «крутая», что даже значительные изменения температуры газа приводят к сравнительно небольшим изменениям величины r1. Поэтому в первом приближении можно считать, что r, зависит только от химической природы газа и представляет собой не что иное, как эффективный диаметр d молекул.
Из сказанного ясно, что возможность представления молекул газа в виде твердых шариков диаметра d связана с очень быстрым увеличением сил взаимного отталкивания молекул реального газа при уменьшении расстояния между ними.
Зависимость взаимной потенциальной энергии Wn двух молекул реального газа от расстояния г между ними неплохо описывается формулой Ленарда-Джонса (1924):
![]() (6.6)
(6.6)
где а1 и а2— постоянные положительные коэффициенты, зависящие от химической природы газа.
Дифференцируя выражение(6.6) по r, находим зависимость от r проекции Fr результирующей силы F взаимодействия двух молекул реального газа:
![]() ,
(6.7)
,
(6.7)
где
![]() и
и
![]()
Анализ формулы:
Первый член в правой части формулы (6.7) соответствует силам межмолекулярного притяжения, которые часто называют ван-дер-ваальсовыми силами по имени нидерландского физика Я. Д. Ван-дер-Ваальса, который впервые начал учитывать межмолекулярное взаимодействие в газах.
Различают три типа сил межмолекулярного притяжения:
Ориентационные - между полярными молекулами
индукционные — между полярной и неполярной молекулами
дисперсионные — между неполярными молекулами, а также между любыми другими парами молекул.
Все они имеют электрическую природу и зависят от расстояния r между молекулами по закону const/r7., ,
Второй член в правой части формулы (6.7) соответствует силам взаимного отталкивания молекул. Эти силы обратно пропорциональны r13, т. е. играют определяющую роль на малых расстояниях, соответствующих перекрытию электронных оболочек молекул. Существование сил взаимного отталкивания молекул при их очень сильном сближении удалось объяснить только в квантовой механике, основываясь на квантовом принципе запрета Паули.
6.2. Газ Ван-дер-Ваальса
Модели идеального газа, подчиняющегося уравнению Менделеева – Клапейрона .
Однако с ростом давления при постоянной
температуре оказывается, что
![]() .
.
При р = 1000 атм. величина
![]() становится вдвое больше, чем предписывает
модель идеального газа (газ не «сжимается»).
становится вдвое больше, чем предписывает
модель идеального газа (газ не «сжимается»).
Причин этому две:
1) собственный размер молекул; он и уменьшает объем, доступный для движения молекул, при нормальных условиях он составляет ~0,07 % объема сосуда с газом, а при 100 атм. уже ~70% ;
2) сложный характер взаимодействия между молекулами.
Эти причины можно учесть путем введения поправок в уравнение состояния идеальных газов, что и сделал Ван-дер-Ваальс.
B первом приближении молекулы реального газа можно уподобить абсолютно твердым шарикам с диаметром d, между которыми действуют только силы взаимного притяжения. Учитывая конечные размеры молекул, мы приближенно принимаем во внимание действие сил взаимного отталкивания между ними. Такая модель газа, принятая Ван-дер-Ваальсом, позволила ему получить уравнение состояния реального газа более совершенное, чем уравнение Клапейрона — Менделеева.
Поправка b.
- связана с собственным объемом молекул,
- ее размерность м![]() /моль.
/моль.
Каждая молекула реального газа имеет
объем
![]() .
.
Поэтому молекулы газа движутся в сосуде менее свободно, чем «точечные» молекулы идеального газа.
Ван-дер-Ваальс учел собственный
объем молекул газа путем замены в
уравнении Клапейрона — Менделеева
![]() полного
объема
полного
объема
![]() сосуда, занимаемого молем газа, на
«свободный» объем:
сосуда, занимаемого молем газа, на
«свободный» объем:
![]() ,
(6.8)
,
(6.8)
где b —
поправка Ван-дер-Ваальса, зависящая
от собственного объема
![]() молекулы – определяет ту часть
объема , которая недоступна для движения
молекул вследствие их конечных размеров.
молекулы – определяет ту часть
объема , которая недоступна для движения
молекул вследствие их конечных размеров.
Эта константа равна учетверенному объему молекул.
Докажем, что поправка b в 4 раза больше собственного объема всех NА молекул одного моля газа:
![]() (6.9)
(6.9)
Для доказательства рассмотрим сферу радиуса d, центр которой совпадает с центром произвольной молекулы.
Внутри этой сферы не могут находиться центры других молекул.
Объем этой сферы является «запрещенным» объемом
 для центров
всех молекул, соударяющихся с данной.
для центров
всех молекул, соударяющихся с данной.
Поскольку молекулы сталкиваются попарно (вероятность столкновений трех и более молекул мала), приведенное рассуждение справедливо для любой пары молекул. Таким образом, в расчете на каждую из молекул газа недоступным будет объем, равный четырем объёмам одной молекулы, а для всех молекул – объем равный учетверенному суммарному объему молекул. Он в восемь раз больше собственного объема молекулы.
![]()
Поправка Ван-дер-Ваальса b представляет собой «запрещенный» объем, приходящийся на все NA молекул, т.е.
,
что и требовалось доказать.
Из формулы (6.9) следует: значение b зависит от эффективного диаметра молекул, т. е. от химической природы газа.
