
- •1 . Основные понятия и законы химии.
- •2. Классификация и номенклатура неорганических соединений.
- •3. Периодический закон и периодическая система химических элементов. Строение атома. Химическая связь и строение вещества.
- •4. Типы химических реакций
- •5. Растворы. Электролитическая диссоциация. Гидролиз солей.
- •6. Общие свойства и способы получения оксидов, оснований, кислот, амфотерных гидроксидов и солей
- •7. Задачи.
4. Типы химических реакций
и закономерности их протекания.
1. Гомогенной экзотермической реакцией является:
а) N2 (г.) + 3Н2 (г.) = 2NH3(г.) +92 кДж
б) N2 (г.) + O2 (г.) = 2NО (г.) – 180 кДж
в) С(тв.) + О2 (г.) = СО2 (г.) + 402 кДж
г) NH3(г.) + HCl(р.) = NH4Cl (тв.) + 314 кДж
2. Тепловой эффект химической реакции не зависит от пути реакции, а определяется только природой и состоянием исходных веществ и продуктов реакции -
а) закон Гесса
б) закон Генри
в) закон Рауля
г) закон Оствальда
3. Химические реакции, которые идут практически до конца в одном направлении
а) необратимые реакции
б) простые реакции
в) обратимые реакции
г) реакции обмена
4. Химическое равновесие – это состояние системы, в котором
а) скорость прямой реакции равна скорости обратной реакции
б) скорость прямой реакции больше скорости обратной реакции
в) скорость прямой реакции меньше скорости обратной реакции
г) скорость прямой реакции равна нулю
5. Правило Вант-Гоффа – при повышении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в
а) 2 – 4 раза
б) 20 – 40 раза
в) 800 – 1000 раз
г) 0,2 – 0,4
6. Окислительно-восстановительной является реакция:
а) 2NaNO3 = 2NaNO2 + O2
б) NH4Cl = NH3 + HCl
в) Na2O + SO3 = Na2SO4
г) 2Cr(OH)3 = 2 Cr2O3 + 3H2O
7. Среди следующих процессов окислением является:
а) S2- + 4H2O - 8е = SO42- + 8H+
б) Сu2+ + 2е = Си0
в) Сl2 = 2Сl-- 2е
г) МnО4- + 8Н+ + 5е = Mn2+ + 4H2O
8. Коэффициент перед формулой вещества-восстановителя в уравнении реакции H2S + SO2 = S + H2O равен:
а) 2
б) 1
в) 3
г) 4
9. Скорость реакции при концентрациях реагирующих веществ равных 1 моль/л называется
а) константа скорости
б) мгновенная скорость
в) период полураспада
г) скорость обратной реакции
10. Вещество, которое изменяет скорость реакции, но само при этом не расходуется -
а) катализатор
б) ингибитор
в) реагент
г) продукт
11. Реакцией диспропорционирования является:
а) КСlO3 = КСlО4 + КСl
б) Аl(OН)3 = Аl2О3 + Н2О
в) H2S + SO2 = S + Н2О
г) AgNO3 = Ag + NO2 + О2
12. При повышении температуры на 30 градусов скорость реакции, температурный коэффициент которой равен 2, возрастает в:
а) 8 раза
б) 3 раза
в) 6 раз
г) 2 раз
13. Химическое равновесие — это состояние обратимой реакции, при котором;
а) скорости прямой и обратной реакций равны
б) концентрации реагентов и продуктов реакции равны
в) константы скоростей прямой и обратной реакций равны
г) скорость обратной реакции равна нулю
14. Катализатор:
а) уменьшает энергию активации реакции
б) увеличивает скорости движения молекул реагентов
в) увеличивает число столкновений молекул реагентов в единицу времени
г) увеличивает тепловой эффект реакции.
15. Равновесие какой из следующих обратимых реакций смещается влево при повышении давления?
a) СО2 (г.) + С (тв.) = 2СО (г.)
б) СО (г.) + Н2О (г.) = СО2 (г.) + Н2 (г.)
в) 2СО(г.) + О2(г.) = 2 СО2 (г.)
г) N2 (г.) + 3Н2 (г.) = 2NH3(г.)
16. Сумма коэффициентов в уравнении реакции
As2S3 + HNO3 + Н2О = Н3АsО4 + Н2SO4 + NO равна:
а) 78
б) 81
в) 66
г) 53
17. Как изменится концентрация, если увеличить объём в 2 раза
а) уменьшится в 2 раза
б) увеличится в 4 раза
в) уменьшится в 4 раза
г) уменьшится в 3 раза
18. Укажите формулу Вант-Гоффа
а)
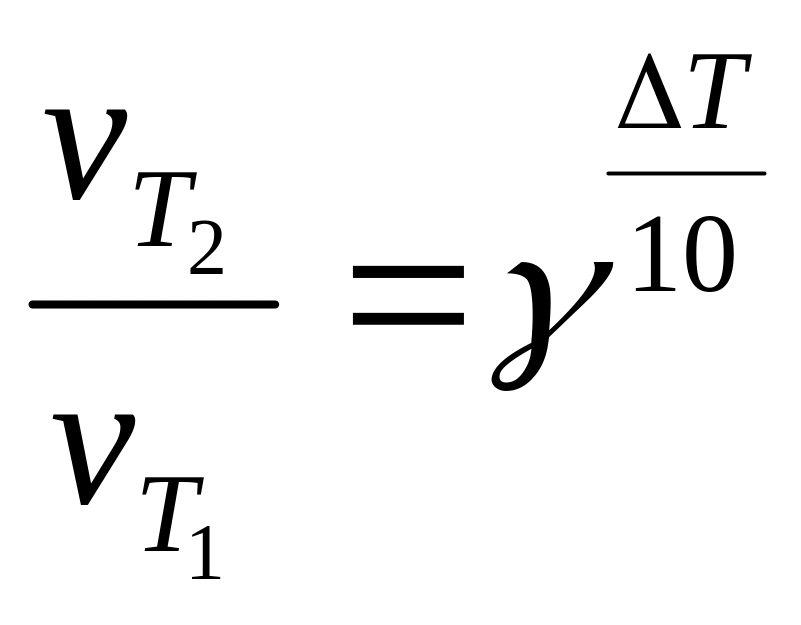
б)
![]()
в)
![]()
г)

19. Как называется вещество, которое изменяет скорость химической реакции, но само не расходуется
а) катализатор
б) электролит
в) стабилизатор
г) катод
20.
К какому типу реакций можно отнести
реакцию H2+Cl2![]() 2HCl
2HCl
а) бимолекулярная реакция
б) мономолекулярная реакция
в) тримолекулярная реакция
г) многомолекулярная реакция
21.
Сумма степеней в законе действующих
масс
![]() -
-
а) порядок реакции
б) скорость реакции
в) энергия реакции
г) коэффициент реакции
22. Какая из реакций является параллельной?
а)
![]()
б)
![]()
в)
![]()
г)
![]()
23.
К какому типу реакций можно отнести
реакцию вида
![]() ?
?
а) последовательная реакция
б) реакция сопряжения
в) обратимая реакция
г) параллельная реакция
24. Как называется избыточная энергия необходимая, для того чтобы частицы столкнувшись, прореагировали друг с другом, а не разлетелись как упругие шары
а) энергия активации
б) кинетическая энергия
в) потенциальная энергия
г) энергия взаимодействия
25. Уравнение Аррениуса – описывает зависимость константы скорости от
а) температуры
б) массы
в) давления
г) объема
26. Универсальная газовая постоянная R=
а)
8,31
![]()
б) 83,14
в)
9*![]()
г) 8,14
27. В каком направлении сместится химическое равновесие при увеличении концентрации NO в системе 2NO + O2 = 2NO2:
а) в сторону продуктов реакции
б) в сторону исходных веществ
в) не изменится
г) изменится в 2 раза
28. Выход аммиака в процессе его синтеза из азота и водорода увеличивается при:
а) повышении давления
б) введении катализатора
в) повышении температуры
г) понижении давления
29. Реакцией замещения является образование воды в результате:
а) восстановления оксида меди (II) водородом
б) горения водорода в кислороде
в) взаимодействия растворов гидроксида калия и серной кислоты
г) термической дегидратации гидроксида меди (П)
30. Высшая степень окисления висмута равна
а) 5
б) 3
в) 2
г) 4
31. В реакции
KMnO4 + K2SO3 + КОН = K2MnO4 + K2SO4 + H2O элементом-востановителем является:
а) сера
б) марганец
в) серная кислота
г) кислород
32. Сумма коэффициентов в левой части уравнения реакции
Си + HNO3 = Cu(NO3)2 + NO + Н2О равна:
а) 11
б) 16
в) 12
г) 4
33. Явление изменения скорости реакции в присутствии некоторого вещества, которое не расходуется в результате реакции, называется:
а) катализом
б) гидролизом
в) окислением
г) восстановлением
34. Во сколько раз увеличивается скорость синтеза аммиака при повышении концентраций азота и водорода в 3 раза
а) 81
б) 3
в) 100
г) 4
35. При повышении температуры от 20 до 60°С скорость некоторой реакции увеличилась в 81 раз. Температурный коэффициент скорости этой реакции равен:
а) 3
б) 5
в) 2
г) 4
36. Обратимая реакция, равновесие которой смещается в одном направлении и при повышении температуры и при повышении давления, — это:
а) 2NO2(г.) = N2O4 (г.) — 9,6 кДж
б) 2NO (г.) + О2 (г.) = 2NO2 (г.) + 113 кДж
в) СО (г.) + Н2О (г.) = СО2 (г.) + Н2 (г.) + 42,6 кДж
г) 2NO + O2 = 2NO2 + 14 кДж
37. Что изучает химическая кинетика?
а) скорость и механизмы химических превращений
б) тепловые эффекты химических реакций и фазовых превращений
в) окислительно-восстановительные реакции
г) строение атома
38. Реакция нейтрализации раствора сильной кислоты раствором сильного основания является:
а) гомогенной
б) окислительно-восстановительной
в) реакцией разложения
г) реакцией соединения
39. Как формулируется правило Вант-Гоффа
а) при увеличении температуры на каждые 10 градусов скорость реакции увеличивается в 2-4 раза
б) теплота образования химического соединения равна теплоте разложения, но противоположна по знаку
в) теплота, подведенная к системе, расходуется на изменение внутренней энергии и на совершение работы против действия внешних сил
г) скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях соответствующих их коэффициентам
