
- •Оглавление
- •Предисловие
- •Лекция 1 предмет и значение химии
- •Лекция 2 Основные законы химии
- •§ 2. Стехиометрические законы. Химический эквивалент. Основу атомно-молекулярного учения составляет основные законы химии, открытые на рубеже XVIII и XIX вв.
- •Лекция 3 Строение атома
- •Электронные конфигурации атомов
- •Лекция 4, 5 Химическая связь
- •Лекция 6 Периодический закон д.И. Менделеева
- •§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
- •Лекция 7, 8 Химическая термодинамика
- •Классификация термодинамических систем
- •Классификация термодинамических процессов
- •Лекция 9 Химическая кинетика и катализ. Химическое равновесие
- •Лекция 10 Растворы
- •Лекция 11, 12 растворы электролитов. ЭлектролитическАя диссоциациЯ
- •Лекция 13 Окислительно-восстановительные реакции
- •§ 1. Степень окисления. Одним из основных понятий в химии, широко использующимся при составлении уравнений овр, является степень окисления (с.О.) атомов.
- •Лекция 14 Электрохимические процессы и системы
- •Лекция 15 коррозия металлов и защита от коррозии
- •§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
- •Лекция 16 координационные соединения
- •Лекция 17 Обзор химических свойств элементов
- •Дополнение к лекции 12 о структуре воды и растворов
- •Лекция 18 Основы кристаллохимии
- •Рисунки к лекции 3.
- •Литература
- •Курс лекций по общей химии: Учеб. Пособие для вузов.
Лекция 3 Строение атома
§ 1. Развитие представлений о строении атома. Если бы в результате какой-то мировой катастрофы все накопленные человечеством научные знания оказались бы уничтоженными и к грядущим поколениям перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Этот вопрос поставил знаменитый американский физик, нобелевский лауреат Ричард Фейнман и сам дал на него такой ответ: это атомная гипотеза. Все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. Однако с этим утверждением, по существу, мог бы согласиться уже древнегреческий философ Демокрит, живший за 400 лет до н.э. По-видимому, мы знаем об атомах кое-что еще, если, в отличие от древних греков, смогли создать на основе своих знаний атомные бомбы и атомные электростанции.
До конца XIX в. полагали атом неделимой и не изменяющейся частицей. Но затем были открыты ряд явлений, которые были не объяснимы с этой точки зрения. Электрохимические исследования Дэви, Фарадея показали, что атом может нести положительный и отрицательный заряд, поскольку они выделяются на катоде или на аноде электролизера. Отсюда вытекала корпускулярность электрического заряда.
Совершенствуя методы возбуждения газов для получения их спектров, Крукс открыл так называемые катодные лучи (явление, реализуемое в современных телевизорах). При прохождении электрического тока через заключенный в трубку разреженный газ от отрицательного полюса (катода) исходит поток слабого света – катодный луч. Катодный луч сообщает отрицательный заряд телам, на которые он падает, и отклоняется в сторону приближенных к трубке положительно заряженных тел. Следовательно, катодный луч представляет собой поток отрицательно заряженных частиц.
Были также открыты явления термоэмиссии и фотоэмиссии (Столетов), состоящие в выбивании отрицательно заряженных частиц под влиянием температуры и квантов света, подтвердившие тот факт, что в составе атома есть отрицательно заряженные частицы. Беккерель открыл явление радиоактивности. Супруги Кюри показали, что поток радиоактивного излучения неоднороден, и его можно разделить электрическим и магнитным полем. Общее излучение при попадании в конденсатор разделяется на три части: -лучи (Не2+) немного отклоняются к отрицательной пластине конденсатора, -лучи (поток электронов) сильно отклоняются к положительной пластине конденсатора, -лучи (электромагнитные волны) не отклоняются ни электрическим, ни магнитным полем.
И, наконец, открытие рентгеновских лучей Конрадом Рентгеном показало, что атом сложен и состоит из положительных и отрицательных частиц, наименьшую из которых Томсон назвал электроном. Более того, Малликен измерил её заряд е = -1,610-19 Кл (минимально возможный, т.е. элементарный) и нашел массу электрона m = 9,1110-31 кг.
Нейтральность атома при наличии в нем электронов приводила к выводу о существовании в атоме области, несущей положительный заряд. Остался открытым вопрос о местонахождении или размещении в атомах электронов и предполагаемых положительных зарядов, то есть вопрос о строении атома. На основании вышеприведенных исследований в 1903 г. Томсон предложил модель атома, которая была названа «пудинг с изюмом», положительный заряд в атоме распределен равномерно с вкрапленным в него отрицательным зарядом. Но дальнейшие исследования показали несостоятельность этой модели.
Резерфорд (1910 г.) пропускал через слой вещества (фольга) поток -лучей и измеряя отклонение отдельных частиц после прохождения через фольгу. Обобщая результаты наблюдений Резерфордом было установлено, что тонкий металлический экран отчасти прозрачен для -частиц, которые, проходя через листок, либо не изменяли своего пути, либо отклонялись на малые углы. Отдельные же -частицы отбрасывались назад, как мячик от стены, будто встречали на своем пути непреодолимое препятствие. Так как отбрасывалось назад весьма небольшое число проходящих через фольгу -частиц, то это препятствие должно занимать в атоме объем, неизмеримо малый даже по сравнению с самим атомом, при этом оно должно обладать большой массой, так как в противном случае -частицы от него не рикошетировали бы. Таким образом, появилась гипотеза о ядре атома, в котором сосредоточена практически вся масса атома и весь положительный заряд. При этом становятся понятными отклонения пути большинства -частиц на небольшие углы, под влиянием сил электростатического отталкивания со стороны атомного ядра. В дальнейшем было установлено, что диаметр ядра порядка 10–5 нм, а диаметр атома – 10–1 нм, т.е. объем ядра в 1012 раз меньше объема атома.
В модели атома, предложенной Резерфордом, в центре атома расположено положительно заряженное ядро, а вокруг него движутся электроны, число которых равно величине заряда ядра или порядковому номеру элемента, подобно планетам вокруг Солнца (планетарная модель атома). Развитая Резерфордом ядерная модель была крупным шагом вперед в познании строения атома. Она была подтверждена большим числом экспериментов. Однако в некоторых отношениях модель противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, планетарная модель атома Резерфорда не могла объяснить устойчивости атома. По законам классической электродинамики электрон, двигаясь вокруг ядра, неизбежно теряет энергию. С уменьшением запаса энергии у электрона радиус его орбиты должен непрерывно уменьшаться и в результате упасть на ядро и прекратить свое существование. Физически же атом представляет собой устойчивую систему и может существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Спектры щелочных металлов оказываются сходными со спектром атомарного водорода, и анализ их приводил к заключению о наличие в составе атомов каждого щелочного металла одного электрона, слабо связанного с ядром по сравнению с остальными электронами. Т.е. в атоме электроны размещаются на не одинаковом расстоянии от ядра, а слоями.
В рентгеновских
спектрах для различных элементов Мозли
обнаружил, что
![]() ,
где A
– коэффициент пропорциональности, Z
– порядковый
номер (число электронов в атоме),
– длина волны, s
– постоянная
экранирования.
,
где A
– коэффициент пропорциональности, Z
– порядковый
номер (число электронов в атоме),
– длина волны, s
– постоянная
экранирования.
Таким образом, Мозли показал взаимосвязь положительного заряда ядра и номера элемента в Периодической системе. Чедвик измерил заряды ядер с помощью рассеивания -частиц тонкими частицами серебра и платины и подтвердил, что положение элементов в периодической таблице определяется порядковым номером – зарядом ядра в атоме.
Атомные спектры получают, пропуская излучение возбужденных атомов (в пламени с высокой температурой или другими способами) через специальное оптическое устройство (призму, систему призм или дифракционных решеток), которое разлагает сложное излучение на монохроматические составляющие с определенной длиной волны () и, соответственно, с определенной частотой колебаний электромагнитного излучения: =с/, где c – скорость света. Каждый монохроматический луч регистрируется в определенном месте принимающего устройства (фотопластинки или др.). В результате получается спектр данного излучения. Атомные спектры состоят из отдельных линий – это линейчатые спектры.
Каждый вид атомов характеризуется строго определенным расположением линий в спектре, не повторяющихся у других видов атомов. Именно на этом основан метод спектрального анализа, с помощью которого были открыты многие элементы. Линейчатость атомных спектров противоречила законам классической электродинамики, согласно которой спектр атомов должен быть непрерывным в результате непрерывного излучения электроном энергии.
§ 2. Модель строения атома водорода Бора. Так как законы классической электродинамики оказались не применимы для описания поведения электрона в атоме, Нильс Бор впервые сформулировал постулаты, основанные на законах квантовой механики.
1) В атоме водорода существуют орбиты, двигаясь по которым, электрон не излучает. Они называются стационарными.
2) Излучение или поглощение энергии происходит в результате перехода электрона с одной стационарной орбиты на другую. Удаленные от ядра орбиты характеризуются большим запасом энергии. При переходе от низших к высшим орбитам атом переходит в возбужденное состояние. Но в этом состоянии он может находиться недолго. Он излучает энергию и возвращается на исходное основное состояние.
При этом энергия кванта излучения равна:
h = En – Ek,
где n и k – целые числа.
3) Стационарными являются орбиты, для
которых выполняется условие
![]() ,
где me
– масса электрона,
– скорость вращения, r
– радиус орбиты, h –
постоянная Планка, n
= 1,2,3,…,.
,
где me
– масса электрона,
– скорость вращения, r
– радиус орбиты, h –
постоянная Планка, n
= 1,2,3,…,.
Пользуясь постулатами Бора и законами
классической физики, можно рассчитать
энергии орбит и частоты энергетических
переходов:
![]() ,
где
,
где
![]() – константа Ридберга, а n
и k целые числа,
характеризующие номера (энергию) орбит.
И как выяснилось дальше – квантовые
числа.
– константа Ридберга, а n
и k целые числа,
характеризующие номера (энергию) орбит.
И как выяснилось дальше – квантовые
числа.
Таким образом, модель Бора хорошо объясняла происхождение спектров. Спектры бывают излучения и поглощения (рис. 3.1). В результате переходов атомов образуются группы спектральных линий. 1 – Лаймана, 2 – Бальмера, 3 – Пашена и т.д. Но расщепление спектральных линий не объясняется постулатами Бора и теорией Резерфорда. Эта теория хорошо объясняла свойства атома водорода (см. Приложение), но оказалась малопригодной для объяснения строения сложных атомов, начиная с гелия.
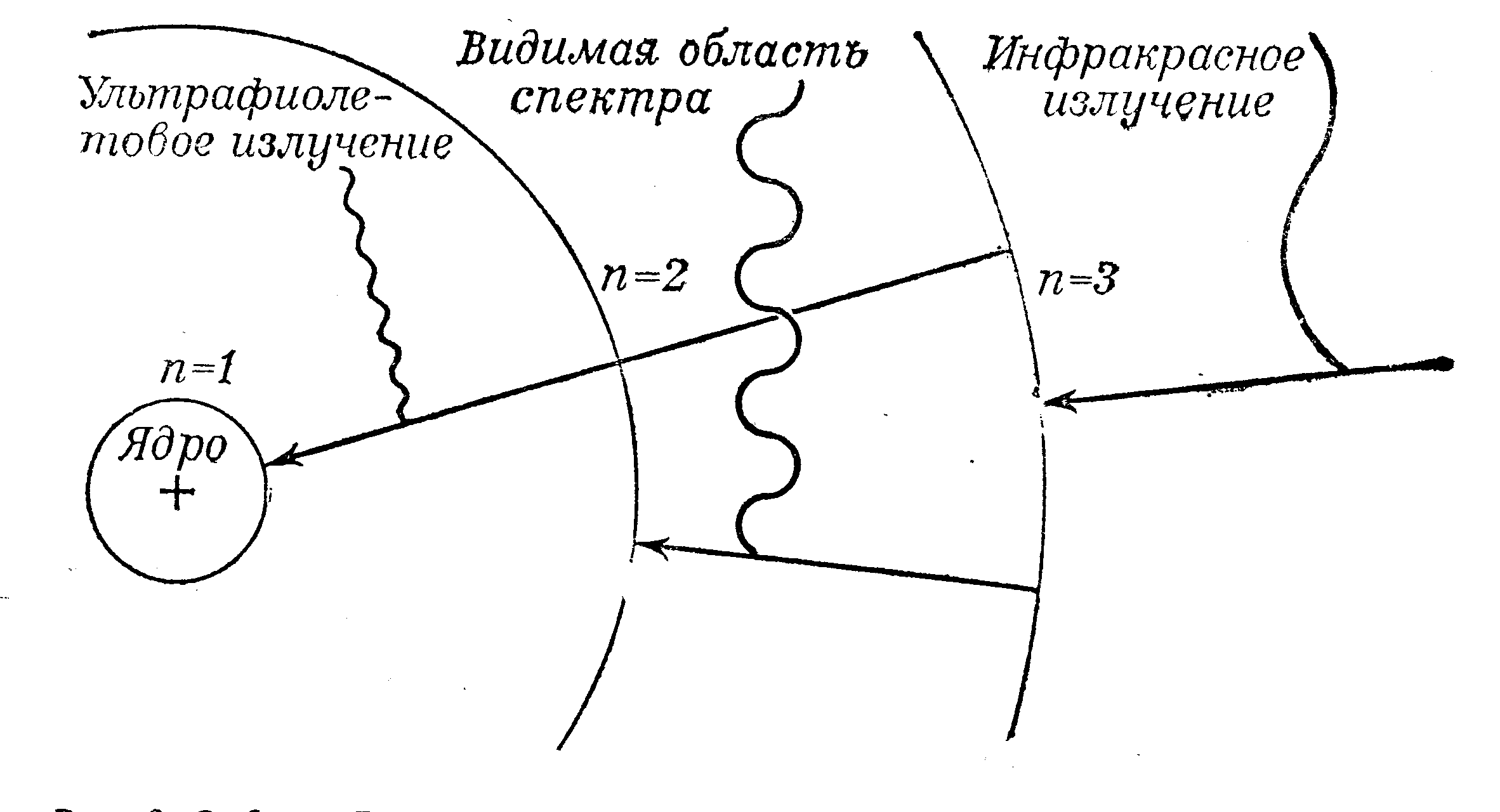
Рис. 3.1. Орбиты Бора для атома водорода.
§ 3. Основные положения волновой (квантовой) механики. Объяснение волновых (спектральных) свойств возникло одновременно с квантово-механическими представлениями в теории строения атома. Предпосылкой являлась теория Планка излучения тел. Он показал, что изменение энергии происходит не непрерывно (согласно законам классической механики), а скачкообразно, порциями, которые были названы – квантами. Энергия кванта определяется уравнением Планка: E = h, где h – постоянная Планка равная 6,6310–34 Джс, – частота излучения. Получается, что электрон обладает корпускулярными свойствами (масса, заряд) и волновыми – частота, длина волны.
В связи с этим Луи
де Бройль
выдвинул идею о
дуализме
частиц и волн.
Причем корпускулярно-волновой дуализм
характерен для всех объектов микро- и
макромира, только для макроскопических
объектов преобладает один из наборов
свойств, и мы говорим о них, как о частицах
или волнах, а для элементарных частиц
и те, и другие свойства проявляются
совместно. Уравнение де Бройля показывает
связь между импульсом частицы и длиной
волны:
![]() .
Таким образом, электрону, вращающемуся
вокруг ядра, можно приписать некоторую
длину волны. Парадокс! Применение теории
де
Бройля к постулатам Бора позволяет
предположить, что состояние атома
устойчиво в том случае, если на его
орбите укладывается целое число длин
волн (стоячих, как на гитаре, с той лишь
разностью, что концы струн как бы
соединены в замкнутом пространстве).
.
Таким образом, электрону, вращающемуся
вокруг ядра, можно приписать некоторую
длину волны. Парадокс! Применение теории
де
Бройля к постулатам Бора позволяет
предположить, что состояние атома
устойчиво в том случае, если на его
орбите укладывается целое число длин
волн (стоячих, как на гитаре, с той лишь
разностью, что концы струн как бы
соединены в замкнутом пространстве).
Принцип неопределенности Гейзенберга. Если электрон обладает двойственной природой, то нельзя одновременно определить его координату и импульс: xp h или E h, иными словами, для того чтобы электрон, перешел с одного энергетического уровня на другой, необходим квант энергии E h.
Согласно этим представлениям электрон – облако, размазанное в объеме атома, имеющее разную плотность. Следовательно, для описания положения электрона в атоме требуется ввести вероятностное описание электронной плотности в атоме, учитывающее его энергию и пространственную геометрию. Это и было сделано Э. Шрёдингером. Он ввел знаменитое уравнение, описывающее поведение электрона в атоме волновой функцией (пси-функция ). Квадрат ее модуля 2, вычисленный для определенного момента времени и определенной точки пространства, дает плотность вероятности обнаружения частицы в этой точке в данное время. Функцию (предложенную Шрёдингером) можно определить путем решения квантово-механического уравнения Шрёдингера. Это уравнение в простейшем случае частицы, движущейся в потенциальном поле, может быть записано в виде:
![]() (3.1)
(3.1)
где m – масса частицы, U – потенциальная энергия, E – полная энергия, x, y, z – декартовы координаты. Решение этого уравнения возможно лишь при определенных значениях полной энергии E=T+U, (T, U –кинетическая, потенциальная энергии соответственно), причем T = m2/2. Уравнение – феноменологическое, настолько интересно, что его целесообразно вывести, взяв за основу уравнение синусоиды: (x) = sin(2x/), проведя двойное дифференцирование, получим
![]() , (3.2)
, (3.2)
зная, что = h/m, подставив в уравнение (3.2) получим
![]() ,
,
![]() .
.
Введя, оператор
Лапласа, учитывающего распределение
волны в трехмерном пространстве:
![]() ,
получим уравнение Шрёдингера:
,
получим уравнение Шрёдингера:
![]() .
Значение функции
не имеет строгого физического смысла
(уравнение убывающей экспоненты). А вот,
произведение ||2dV
– характеризуют вероятность нахождения
электрода в объеме пространства dV.
Обычно записывают для электронной
плотности
= 4r2||2dr
– вероятность того, что электрон
находится на расстоянии r
от ядра. Для атома водорода, путем решения
этого уравнения получена зависимость
электронной плотности от расстояния
(рис. 3.2), имеющей вероятностный характер
и достигает максимального значения на
некотором конечном расстоянии от ядра,
соответствующего
Боровскому радиусу. Различная плотность
вероятности дает представление об
электроне, как бы «размазанном» вокруг
ядра в виде так называемого электронного
облака, или орбитали. Чем больше величина,
тем больше вероятность нахождения
электрона в данной области атомного
пространства. Величина и форма части
пространства, в которой вероятность
пребывания электрона максимальна (95%
или 99%), называется орбиталью.
Максимум плотности вероятности отвечает
Боровским орбитам (рис. 3.2).
.
Значение функции
не имеет строгого физического смысла
(уравнение убывающей экспоненты). А вот,
произведение ||2dV
– характеризуют вероятность нахождения
электрода в объеме пространства dV.
Обычно записывают для электронной
плотности
= 4r2||2dr
– вероятность того, что электрон
находится на расстоянии r
от ядра. Для атома водорода, путем решения
этого уравнения получена зависимость
электронной плотности от расстояния
(рис. 3.2), имеющей вероятностный характер
и достигает максимального значения на
некотором конечном расстоянии от ядра,
соответствующего
Боровскому радиусу. Различная плотность
вероятности дает представление об
электроне, как бы «размазанном» вокруг
ядра в виде так называемого электронного
облака, или орбитали. Чем больше величина,
тем больше вероятность нахождения
электрона в данной области атомного
пространства. Величина и форма части
пространства, в которой вероятность
пребывания электрона максимальна (95%
или 99%), называется орбиталью.
Максимум плотности вероятности отвечает
Боровским орбитам (рис. 3.2).
|
Рис. 3.2. Функция радиального распределения для 1s- и 2s-электронов. |
Формы, размеры и число орбиталей будут подробнее рассмотрены при изучении теории химической связи. В общем, существуют s-, p-, d-орбитали имеющие форму соответственно сферы, гантели (объемной восьмерок) и пропеллера (объемного четырехлистника) соответственно (рис. 3.3).
Важной особенностью электронного строения атома является взаимодействие различных s-, p-, d-, f-орбиталей с близкой энергией (n) и геометрией (l), приводящих к образованию гибридных орбиталей. Явление гибридизации мы рассмотрим в теме «химическая связь».
Рис. 3.3. Формы s-, p- и d-орбиталей. Показаны знаки волновой функции.
§ 4. Квантовые числа. Орбитали. Для объяснения электронного строения атома водорода предложены четыре квантовых числа n, l, ml, s характеризующие энергетическое состояние и поведение электрона в атоме. Эти числа однозначно характеризуют состояние электрона любого атома периодической системы элементов. Для каждого электрона они в совокупности имеют различные значения.
Главное квантовое число п – характеризует энергию и размеры электронных облаков. Оно принимает значения для основных состояний атомов 1-8 и в принципе до бесконечности. Его физический смысл, как номера энергетического уровня – значение энергии электрона в атоме и как следствие, размер атома. При п=1 электрон находится на первом энергетическом уровне с полной минимальной энергией и так далее. При увеличении п полная энергия увеличивается. Энергию каждого энергетического уровня можно оценить по формуле: Е=-1/13,6n2. Энергетические уровни обозначают обычно буквами следующим образом:
Значение (n) |
1 |
2 |
3 |
4 |
5 |
Обозначения |
K |
L |
M |
N |
Q |
Побочное, орбитальное (или азимутальное) квантовое число l характеризует форму электронных орбиталей (облаков) вокруг атома и определяет изменение энергии в пределах энергетического уровня, то есть характеризует энергию подуровня. Каждой форме электронного облака соответствует определенное значение механического момента движения электрона, определяемого побочным квантовым числом l, которые изменяется в пределах от 0 до п–1: п=1, l=0; п=2, l=0, l=1; п=3, l=0, l=1, l=2 и т.д. Энергетические подуровни в зависимости от l обозначают буквами:
Значения (l) |
0 |
1 |
2 |
3 |
4 |
5 |
Обозначения (V) |
s |
p |
d |
f |
g |
h |
Те электроны, которые находятся на s уровне называются s-электронами, на p уровне p-электронами, на d уровне d-электронами.
Энергия электронов зависит от внешнего магнитного поля. Эта зависимость описывается магнитным квантовым числом. Магнитное квантовое число ml указывает на ориентацию в пространстве электронной орбитали (облако). Внешнее электрическое или магнитное поле изменяет пространственную ориентацию электронных облаков, при этом происходит расщепление энергетических подуровней. Число ml изменяется в пределах от –l, 0, +l и может иметь (2l+1) значений:
Электроны |
s |
p |
d |
Уровни |
n=1, l=0, m=0 |
n=2, l=1, m=-1, 0, +1 |
n=3, l=2, m=-2,–1,0,+1,+2 |
Совокупность трех квантовых чисел однозначно описывает орбиталь. Она обозначается как «квадратик» – . Электрон, как частица, испытывает вращение вокруг собственной оси – по часовой и против часовой стрелки. Оно описывается спиновым квантовым числом s (ms), которое принимает значения 1/2. Наличие в атоме электронов с противоположно направленными спинами обозначается как «стрелки». И так четверка наборов квантовых чисел описывает энергию электронов.
§ 5. Многоэлектронные атомы. Определение числа электронов на уровнях и подуровнях. В многоэлектронных атомах электронное построение в соответствие с набором квантовых чисел регулируется двумя постулатами.
Принцип Паули: В атоме не может быть двух электронов, обладающих 4 одинаковыми квантовыми числами (иначе они не различимы, минимальное энергическое различие в спинах). Следствие, в одной электронной ячейке, орбитали может быть не более двух электронов с разнонаправленными спинами.
Заполнение электронами ячеек осуществляется в соответствии с правилом Гунда. Электроны заполняют s-, p-, d-, f-орбитали таким образом, чтобы суммарный спин был максимальным или, иными словами, электроны стремятся заполнить вакантные (пустые) орбитали, а уж потом спариваться (по Паули):
|
|
|
|
|
|
|
|
|
|
|
Так, что с учетом принципов квантовой химии можно построить электронную конфигурацию любого атома, как это следует из табл. 3.1. Из табл. 3.1 выводим формулы для определения числа электронов на уровне 2n2, на подуровне 2(2l+1). Число орбиталей равно числу значений m (m=1, m=2, m=3).
Заполнение электронами подуровней осуществляется в соответствии с правилом Клечковского. Заполнение энергетических уровней происходит в порядке возрастания суммы главного и побочного квантовых чисел n+l.
Если эта сумма имеет одинаковые значения, то заполнение осуществляется в порядке возрастания n. Подуровни заполняются в порядке возрастания энергии:
1s << 2s << 2p << 3s << 3p << 4s 3d << 4p << 5s 4d << 5p << 6s 4f 5d…
Таблица 3.1

