
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Активные катионы, перешедшие в раствор электролита.
Средний уровень энергии сольватированных катионов в электролите – от е до е1, т.е. будет уменьшаться энергия активации для обратного процесса, когда катионы из электролита, обладающие повышенной энергией, смогут переходить обратно, восстанавливаться до металла и встраиваться в кристаллическую решетку.
Энергия катионов на поверхности металла и в растворе электролита на расстоянии d0 будут выравниваться. На диаграмме это будет соответствовать точке а1 и е1.
По мере предпочтительного выхода ионов из металла в электролит плотность отрицательного заряда на поверхности металла будет увеличиваться, плотность положительного заряда плотной части ДЭС также будет возрастать, поэтому каждому следующему катиону будет всё труднее ионизироваться, т.е. энергия активации для анодной реакции будет увеличиваться, а для катодной – уменьшаться.
В системе установится динамическое равновесие. Скорость анодной реакции ионизации металла и скорость обратной реакции будут одинаковыми и будут равны плотности тока обмена.
При установившемся равновесии не происходит изменения количества отрицательных зарядов на поверхности металла и количество положительных катионов в ДЭС, но электрохимические катодные и анодные реакции в прямом и обратном направлении всё равно протекают, но с равными скоростями, равными плотности тока обмена j0.
Обратимый потенциал может устанавливаться на металле, если на его поверхности протекают обратимые анодные и катодные реакции, в которых участвуют одни и те же катионы металла.
Значение обратимого потенциала не может быть экспериментально определено, но может быть рассчитано по уравнению Нернста для известной электрохимической реакции.
Необратимые потенциалы металлы.
Необратимый (компромиссный) потенциал. В большинстве случаев металлы термодинамически неустойчивы в растворах электролитов, т.е. на их поверхности могут одновременно протекать несколько электрохимических реакций.


Если электроотрицательный металл (цинк) опустить в раствор электролита, то, кроме реакции обмена катионов цинка из металла и раствора (реакция 1), будет протекать и второй электрохимический процесс – восстановление иона H+ - окислителя из электролита.
Оба процесса могут протекать обратимо, но в данном случае равновесие будет устанавливаться только тогда, когда сумма плотностей тока анодных реакций будет равна сумме плотностей катодных реакций, протекающих на поверхности данного металла.

Процесс ассимиляции электронов (их забирание) будет протекать и по реакции 1, и по реакции 2.

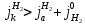
Данное
равновесие приведёт к установлению в
системе единого по значению потенциала
поверхности
 ,
который принято называть стационарным
(установившимся во времени) или
компромиссным, т.к. его значение лежит
между обратимыми потенциалами протекающих
электрохимических процессов. Такие
потенциалы металлов чаще всего реализуются
на практике.
,
который принято называть стационарным
(установившимся во времени) или
компромиссным, т.к. его значение лежит
между обратимыми потенциалами протекающих
электрохимических процессов. Такие
потенциалы металлов чаще всего реализуются
на практике.
Наоборот, величина данного потенциала не может быть рассчитана по уравнению Нернста, но может быть точно измерена относительно стандартного электрода сравнения.
Например, необходимо рассчитать ЭДС коррозионного элемента Zn – водный р-р NaCl.
В данном случае NaCl образован сильным основанием и сильной кислотой, поэтому электролит будет нейтральным, pH~7. В системе могут реализоваться несколько анодных и катодных процессов.
A:
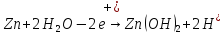
В качестве обратимого потенциала для анодного процесса мы используем обратимый потенциал реакции окисления металла. В общем виде, обратимый потенциал самой электроотрицательной реакции. И наоборот, в качестве обратимого потенциала катодной электрохимической реакции самого положительного из возможных катодных процессов.
Лекция 6.
Диаграмма Пурбэ – фазового равновесия в системе металл-вода.
Данная диаграмма описывает зависимости потенциалов от pH. В качестве примера возьмём диаграмму равновесия Zn-H2O, потому что во всех работах у нас цинковый электрод сравнения.



Прямые параллельные линии a, b – это зависимости обратимых потенциалов водородного и кислородного электродов от pH.
В присутствии металла (Zn) в системе устанавливается несколько различных видов равновесий.
-
Равновесие, не связанное с переносом электронов.

При
активности ионов

Данному
равновесию соответствует линия 1,
параллельная оси потенциалов. При
 цинк находится в системе в виде ионов,
цинк находится в системе в виде ионов,
 –
–

При
 ;
соответствует линия 2, параллельная оси
потенциалов.
;
соответствует линия 2, параллельная оси
потенциалов.
-
Равновесие, связанное с переносом электронов


Обратимый потенциал цинка в данном случае будет зависеть только от активности ионов цинка в электролите (не зависит от pH среды).
Этому равновесию соответствует прямая линия 3, параллельная оси pH.
-
при pH от 5 до 10,5 единиц,




В данной области обратимый потенциал цинка будет зависеть только от кислотности среды. Этому равновесию соответствует прямая линия 4, которая параллельна линии обратимого потенциала водородного электрода (а) и расположена на 0,4 В более отрицательно.
-
При pH>10



В щелочных средах обратимый потенциал Zn будет зависеть и от активности его ионов в растворе, и от кислотности среды. Данному равновесию соответствует линия 5.
