
- •Московский технологический университет Институт тонких химических технологий имени М.В. Ломоносова
- •Лекция 3
- •Амперометрия и амперометрическое титрование
- •Прямая амперометрия. Датчик
- •Леланд Клар (1918-2005)
- •Амперометрический ферментный электрод
- •Амперометрическое титрование
- •Практические аспекты
- •Рабочие электроды
- •Вращающийся дисковый электрод
- •Кривые амперометрического
- •Кривые амперометрического
- •Кривые амперометрического
- •Кривые амперометрического
- •Кривые амперометрического
- •Кривые амперометрического
- •Кривые амперометрического
- •Преимущества амперометрического титрования
- •Области применения амперометрического титрования
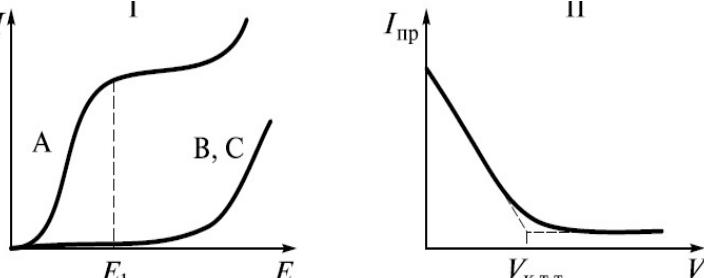
Кривые амперометрического
титрования
Пусть протекает химическая реакция
А + В ↔ С
где А — определяемое (титруемое) вещество; В — титрант; С — продукт реакции.
В зависимости от того, какое из веществ титриметрической реакции является электроактивным – различают следующие виды кривых титрования:
(1) Титрование по току определяемого вещества: вещество А является при выбранном потенциале E1 электроактивным (восстанавливается), вещества B и
С – не электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция: Ag+ + Cl- = AgCl↓ Электродная реакция: К(-) Ag+ + e- = Ag0
A(+) 2H2O - 4e- = O2 + 4H+

Кривые амперометрического
титрования
(2) Титрование по току титранта: вещество B является при выбранном потенциале E1 электроактивным (восстанавливается), вещества A и С – не
электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция: Ba2+ + CrO42- = BaCrO4↓ Электродная реакция: К(-) CrO42- + 3e- + 8H+ = Cr3+ + 4H2O
A(+) 2H2O - 4e- = O2 + 4H+
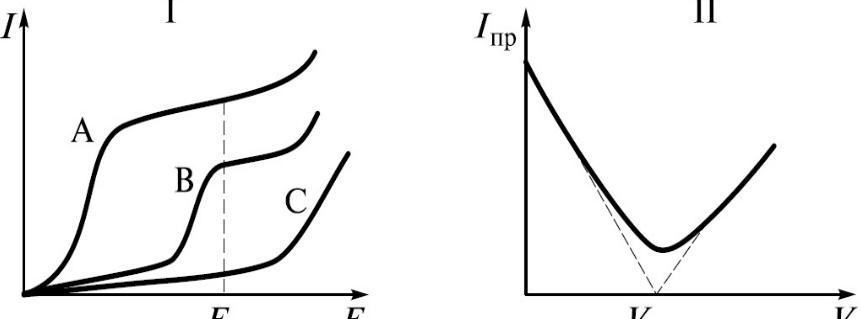
Кривые амперометрического
титрования
(3) Титрование по току определяемого вещества и титранта: вещества A и B является при выбранном потенциале E1 электроактивными
(восстанавливаются), а вещество |
С – не электроактивным при |
соответствующем потенциале. |
|
Пример: Титриметрическая реакция: Pb2+ + CrO42- = PbCrO4↓ Электродная реакция: до т.э. К(-) Pb2+ + 2e- = Pb0
после т.э. К(-) CrO42- + 3e- + 8H+ = Cr3+ + 4H2O A(+) 2H2O - 4e- = O2 + 4H+
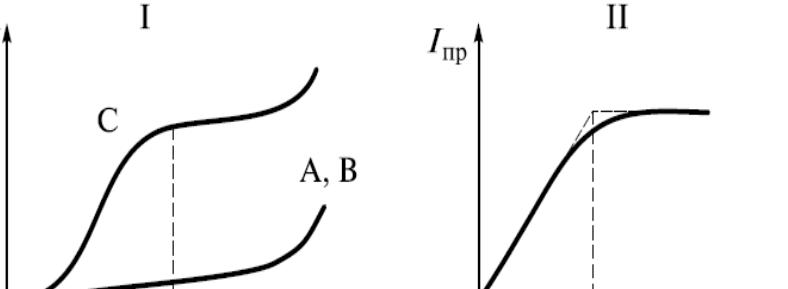
Кривые амперометрического
титрования
(4) Титрование по току продукта реакции: вещество С является при выбранном потенциале E1 электроактивным, вещества A и B – не
электроактивные при соответствующем потенциале.
Пример: Титриметрическая реакция: HAsVO42- + 2I- + 2H+ = HAsIIIO32- + I2 + H2O
Электродная реакция: K(-) I2 + 2e- = 2I- A(+) 2H2O - 4e- = O2 + 4H+
Кривые амперометрического
титрования
(5) Титрование по току определяемого вещества и титранта с разнородными электродными реакциями: вещества A и B является при выбранном потенциале E1 электроактивными, но участвуют в электродных реакциях
разного типа, т. е. одно из них на электроде окисляется, а другое восстанавливается, вещество С – не электроактивное при соответствующем потенциале.
Пример: Титриметрическая реакция: Fe2+ + VO3+ = Fe3+ + VO2+ Электродная реакция: до т.э. A(+) Fe2+ - 1e- = Fe3+
после т.э. К(-) VO3+ + 1e- = VO2+

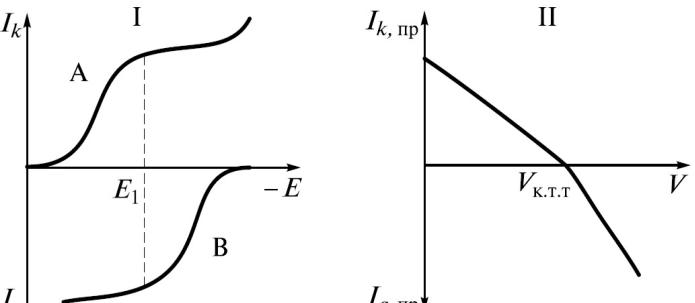
Кривые амперометрического
титрования
(6) Титрование c амперометрическим индикатором: ни один из компонентом титриметрической системы – A, B и С при выбранном потенциале E1 не электроактивные. В таком случае в титриметрическую
реакцию добавляют небольшое количество вещества D, которое является электроактивным и, т.о., выступает в роли индикатора.
D |
Al3+ |
|
|
|
|
|
|
|
|
|
|
A, B, С |
|
Fe3+ |
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
Пример: Титриметрическая реакция: |
|
|
|
||
Определяемое вещество: Al3+ + 6F- = [AlF6]3- |
(lgβ([AlF6]3-) = 20,67) |
||||
Индикаторное вещество: Fe3+ + 6F- = [FeF6]3- |
(lgβ([FeF6]3-) = 16,10) |
||||
Электродная реакция: К(-) Fe3+ + 1e- = Fe2+ |
|
||||
A(+) 2H |
2 |
O - 4e- = O |
2 |
+ 4H+ |
|
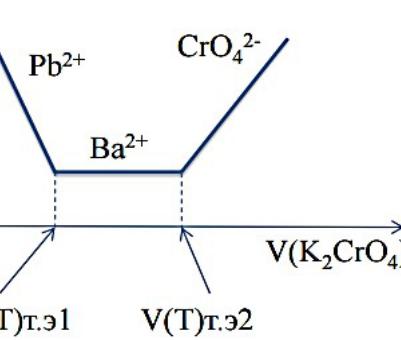
Кривые амперометрического
титрования
(7) Титрование cмеси двух веществ (одно из которых электроактивное):
осуществляют дифференциальное (ступенчатое) титрование смеси двух веществ A и D, одно из которых является при выбранном потенциале E1
электроактивным, а другое - не электроактивным при соответствующем потенциале; наряду с этим титрант при выбранном потенциале – электроактивный.
Например, ионы Pb2+ и Ва2+ титруют К2CrO4; при Е(Hg) = –1,0 В активны Pb2+ и
CrO42–
Титриметрическая реакция:
Pb2+ + CrO42- = PbCrO4↓ Ks(PbCrO4) = 1,18∙10–14
Ba2+ + CrO42- = BaCrO4↓ Ks(BaCrO4) = 1,18∙10–10
Электродная реакция: К(-) Pb2+ + 2e- = Pb0
A(+) 2H2O - 4e- = O2 + 4H+
Преимущества амперометрического титрования
•экспрессность и простота – для построения кривой достаточно нескольких точек
•титрование можно проводить в окрашенных и мутных средах, и даже в присутствии большого количества примесей
•можно анализировать электрохимически неактивные вещества
•возможно определение нескольких веществ в смеси
•применяют при анализе разбавленных растворов (10-5 –
10-6 моль/л)
•ошибка метода (Sr) при количествах определяемого вещества 1-0,1 мг - не превышает обычно ± 2%.

Области применения амперометрического титрования
Амперометрическое титрование применяют в анализе:
•минерального сырья и продуктов его переработки
•природных вод и промышленных растворов
•фармацевтических препаратов
•продуктов и полупродуктов органического синтеза
•полимеров
