
Расчеты в титриметрическом анале
.docРаздел III
РАСЧЕТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
1. ВЫЧИСЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА ВЕЩЕСТВА
Эквивалентом называют реальную или условную частицу вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления-восстановления – одному электрону.
Фактор эквивалентности fэкв.(А)=1/z – число, показывающее, какую долю эквивалент составляет от реальной частицы вещества А, рассчитывается на основании стехиометрии данной реакции.
Молярная масса эквивалента вещества А, M(1/zA) – масса одного моля эквивалента вещества А
M(1/zA) = 1/zM(A).
В кислотно-основных реакциях у одной молекулы HCl в реакции участвует один атом водорода, поэтому эквивалент HCl равен молекуле HCl, а fэкв.(HCl) = 1; у одной молекулы NaOH в реакции участвует один ион ОН-, поэтому эквивалент NaOH равен молекуле NaOH, а fэкв.(NaOH) = 1.
В реакции H3PO4 + 2NaOH → Na2НРО4 + 2Н2О
одна молекула Н3РО4 реагирует с двумя молекулами, или с двумя эквивалентами, NaOH, поэтому fэкв.(Н3РО4) = ½ и М(½Н3РО4) = ½М(Н3РО4) = 49,00 г/моль.
В реакции NH4Cl + NaOH → NH3 + NaCl + H2O
одна молекула хлорида аммония реагирует с одной молекулой, или одним эквивалентом, NаОН, поэтому fэкв.(NН4Сl) = 1 и молярная масса эквивалента NH4Cl равна его молярной массе 53,49 г/моль.
В окислительно-восстановительной реакции:
K2Cr2O7 + 3K2SO3 + 4H2SO4 → 4K2SO4 + Cr2(SO4)3 + 4H2O
в соответствии с уравнением полуреакции восстановления:
Cr2O72– + 14H+ + 6ē → 2Cr3+ + 7H2O
один ион Cr2O72– принимает 6 электронов, поэтому fэкв.(К2Сr2О7) = fэкв.( Cr2O72–) =1/6 и М(1/6К2Сr2О7) = 1/6 М(К2Сr2О7) = 49,03 г/моль.
В соответствии с уравнением полуреакции окисления:
SO32– + H2O – 2ē → SO42– + 2H+
один ион SO32– отдает два электрона, поэтому fэкв.(Nа2SО3) = fэкв.(SO32–) = ½ и М(½Nа2SО3) = ½М(Nа2SО3) = 63,02 г/моль.
2. ХАРАКТЕРИСТИКИ РАСТВОРОВ, ПРИМЕНЯЕМЫЕ ПРИ РАСЧЕТАХ В ТИТРИМЕТРИИ
Молярная концентрация вещества А в растворе С(А), моль/дм3 (моль/л) показывает число молей вещества А, содержащегося в 1 дм3 (л) раствора:
![]() (3.1)
(3.1)
где n(А) – количество вещества A, моль;
m(А) – масса вещества A, г;
М(А) – молярная масса вещества A, г/моль;
Vр-ра – объем раствора вещества A, дм3 (л).
Молярная концентрация эквивалента вещества А С(1/zА), моль/дм3 (моль/л) – число молей эквивалента вещества A, содержащегося в 1 дм3 (л) раствора:
![]() (3.2)
(3.2)
где n(1/z A) – количество вещества эквивалента А, моль, растворенное в V дм3 (л) раствора;
М(1/z A) – молярная масса эквивалента вещества А, г/моль;
1/z – фактор эквивалентности.
Титр вещества Т(А), г/см3 (г/мл) - массовая концентрация, показывающая, сколько граммов растворенного вещества А содержится в 1 см3 (мл) раствора:
![]() (3.3)
(3.3)
Титриметрический фактор пересчета (титр по определяемому веществу) t(Т/Х), г/см3 (г/мл) – число, показывающее, какая масса определяемого вещества X в граммах взаимодействует (соответствует) с 1 см3 (мл) титранта Т:
![]() , (3.4)
, (3.4)
где Т(Т) – титр титранта, г/см3 (г/мл);
М(1/z X) – молярная масса эквивалента определяемого вещества, г/моль;
М(1/z Т) – молярная масса эквивалента титранта, г/моль;
С(1/z Т) – молярная концентрация эквивалента титранта, моль/дм3 (моль/л).
Поправочный коэффициент F – величина, показывающая во сколько раз практические молярная концентрация эквивалента титранта С(1/zТ)пр., его титр Т(Т)пр. или титриметрический фактор пересчета t(Т/Х)пр. отличаются от соответствующих «теоретических» значений С(1/zТ)теор., Т(Т)теор. и t(Т/Х)теор., заданных в методике.
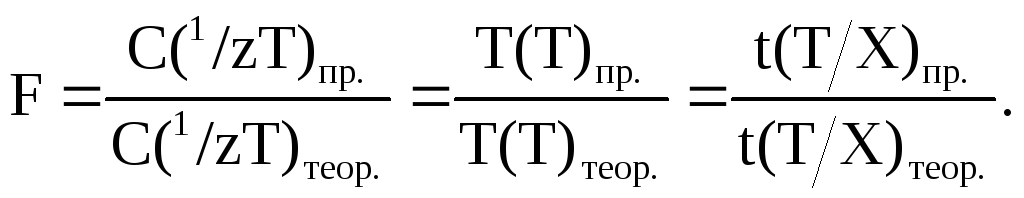 (3.5)
(3.5)
3. РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ
Для выполнения титриметрического анализа необходимы растворы определяемого вещества, титранты и другие растворы.
Титранты (растворы с точно известной концентрацией) делятся на первичные и вторичные стандарты.
Первичный стандарт – раствор, приготовленный из стандарта (стандартного или установочного вещества). Необходимая навеска стандарта взвешивается на аналитических весах и растворяется в мерной колбе заданного объема. Первичные стандарты применяют как для обычных титриметрических определений, так и для установления точной концентрации растворов вторичных стандартов.
Вторичные стандарты (стандартизированные растворы) – растворы веществ, не являющихся стандартами. Из таких веществ готовят растворы примерно известной концентрации, а затем устанавливают их точную концентрацию (стандартизируют), оттитровывая раствором первичного стандарта.
3.1. Расчет массы навески для приготовления раствора
Масса навески вещества А, необходимой для приготовления заданного объема раствора с известной концентрацией, равна:
![]() ,
,
если используется молярная концентрация вещества;
![]()
если используется молярная концентрация эквивалента вещества;
m(A) = T(A) ·V(A) ·103,
если используется титр вещества, и
![]()
если используется титриметрический фактор пересчета (титр по определяемому веществу).
3.2. Расчет концентрации приготовленного раствора
Значения концентраций приготовленных из навесок растворов рассчитывают по формулам (3.1 – 3.3).
3.3. Приготовление растворов путем разбавления более концентрированных растворов
При разбавлении раствора водой (или другим растворителем) количество вещества А и количество вещества эквивалента А не меняются, поэтому
n1(А) = n2(А), и
n1(1/zА) = n2(1/zА),
следовательно, можно записать:
С1(А)·V1(А) = С2(А)·V2(А)
С1(1/zА)·V1(А) = С2(1/zА)·V2(А),
где индексы 1 и 2 относятся к растворам до и после разбавления, соответственно.
4. СТАНДАРТИЗАЦИЯ ТИТРАНТА
4.1. Вычисление молярной концентрации эквивалента титранта
4.1.1. Метод отдельных навесок
Навеска стандартного вещества массой m(А) растворяется в воде и полученный раствор титруется раствором титранта объемом V(Т). В этом случае закон эквивалентов имеет вид:
n(1/z A) = n(1/z T)
![]()
откуда
![]() .
.
4.1.2. Метод пипетирования (аликвот)
Известный объем стандартного раствора V(А) с концентрацией С(1/z А) титруется раствором титранта объемом V(Т). В этом случае закон эквивалентов имеет вид:
![]()
откуда
![]()
4.2. Вычисление титриметрического фактора пересчета, титра и поправочного коэффициента титранта
Титр титранта Т(Т) (г/мл) рассчитывают по формуле
![]()
где М(1/z Т) – молярная масса эквивалента титранта, г/моль,
а а титриметрический фактор пересчета по определяемому веществу t(Т/Х) и поправочный коэффициент F – из выражений (3.4) и (3.5).
5. РАСЧЕТЫ ПО РЕЗУЛЬТАТАМ ТИТРОВАНИЯ
5.1. Расчет массы определяемого вещества в анализируемом растворе или образце
5.1.1. Прямое титрование
В методе отдельных навесок навеска анализируемого образца массой m*, содержащая определяемое вещество, растворяется в воде (или другом растворителе) и полученный раствор титруется раствором титранта объемом V(T) с концентрацией C(1/zT). Закон эквивалентов в этом случае имеет вид:
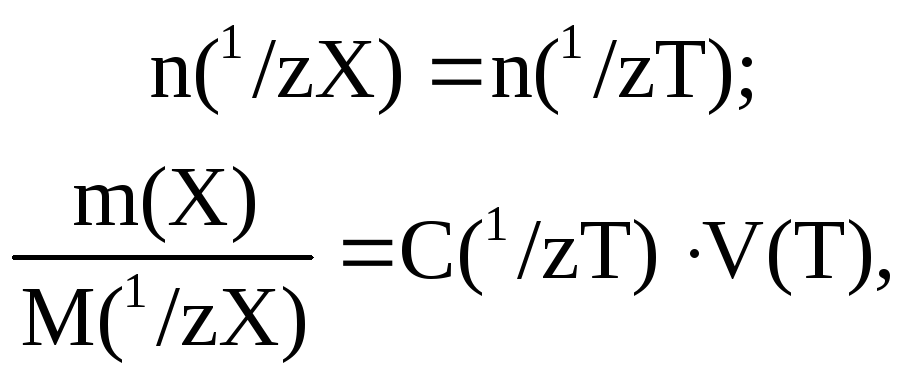
где m(Х) – масса определяемого вещества X в навеске.
Отсюда масса определяемого вещества X в навеске равна:
m(Х) = С(1/zТ)∙V(Т)∙М(1/zХ).
При выполнении массовых анализов удобно рассчитывать массу определяемого вещества, используя титриметрический фактор пересчета (титр по определяемому веществу) t(Т/Х).
Если при титровании навески анализируемого образца израсходован объем титранта V(Т), л с титром по определяемому веществу t(Т/Х), то масса определяемого вещества равна:
m(X) = t(T/X)∙V(T)∙103.
При титровании аликвотной доли раствора определяемого вещества объемом V(Х) закон эквивалентов имеет вид:
![]()
Молярная концентрация эквивалента определяемого вещества равна:
![]()
а масса определяемого вещества в колбе объемом Vk:
![]()
При использовании титриметрического фактора пересчета
![]() .
.
5.1.2. Заместительное титрование
К определяемому веществу X добавляется заведомый избыток реагента А и выделяется заместитель В в количестве, эквивалентном определяемому веществу:
X + A → B + …
Заместитель В титруется титрантом Т:
B + T → C + …
Закон эквивалентов для заместительного титрования имеет вид:
![]()
Поэтому формулы для расчета массы определяемого вещества имеют такой же вид, как и в случае прямого титрования.
5.1.3. Обратное титрование
К определяемому веществу добавляют известный избыток титранта Т1:
X + T1 A + B.
Затем избыток непрореагировавшего Т1 оттитровывают титрантом Т2:
T1 + T2 C + D.
Закон эквивалентов для обратного титрования имеет вид:
![]()
При титровании навески образца массой m(Х) закон эквивалентов принимает вид:
![]()
Масса определяемого вещества в навеске равна:
![]()
При титровании аликвотной доли раствора определяемого вещества V(Х) закон эквивалентов имеет вид:
![]()
откуда рассчитывают молярную концентрацию эквивалента X:
![]()
![]()
Масса определяемого вещества в объеме колбы равна:
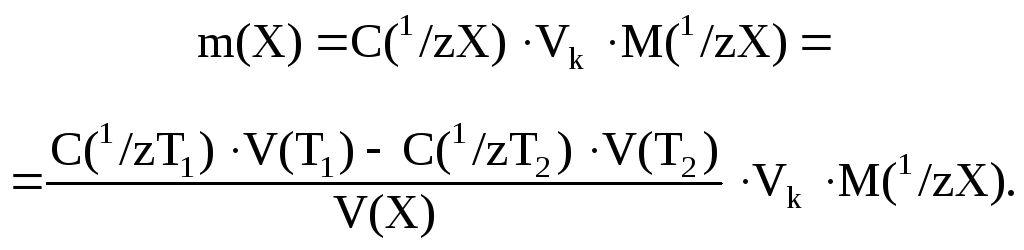
5.2. Вычисление массовой доли определяемого
вещества в анализируемом образце
Массовая доля вещества X в анализируемом образце массой m* рассчитывается в долях:
или в
процентах 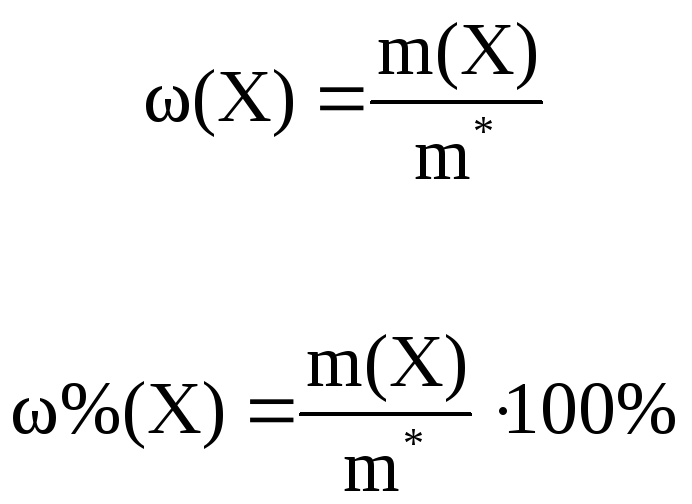
где (X) – массовая доля вещества X в образце,
%(X) – массовая доля вещества X в образце, %,
m(X) – масса вещества X в образце.
