
- •12. Процессы алкилирования в химической технологии бав
- •1. Алкилирование по атому углерода (с-алкилирование) Механизм с-алкилирования
- •2. Катализаторы в процессах алкилирования
- •3. Условия проведения и практические примеры использования с-алкилирования в синтезе лекарственных веществ
- •2. Алкилирование по атому азота (n-алкилирование)
- •3. Алкилирование по атому кислорода (о-алкилирование)
2. Алкилирование по атому азота (n-алкилирование)
Алкилирование по атому азота является наиболее распространенным случаем алкилирования в технологии синтетических лекарственных веществ. Помимо большого значения для промышленного и лабораторного синтеза эти реакции играют большую роль в жизнедеятельности организма. Реакции N-алкилирования проходят через стадию присоединения электрофильной частицы к атому азота аминогруппы с образованием в качестве промежуточного продукта аммониевого иона. Чем основнее амин, тем активнее он вступает в реакции алкилирования. Поскольку ароматические амины менее основны, чем алифатические, то и алкилирование их протекает медленнее. Для алкилирования по атому азота используют алкил- и арилгалогениды, непредельные соединения, эфиры, спирты, диалкилсульфаты.
При нагревании аммиака или аминов с галогеналкенами получается смесь соединений, состоящая из солей первичных, вторичных и третичных аминов, а также четвертичных солей аммония:


Используя различные амины и алкилирующие средства, можно получать смешанные аминосоединения с различными заместителями:

Разделение смеси аминов обычно проводят фракционированной перегонкой.
Поскольку при реакции алкилирования галогеналкилами выделяется хлористый водород:
![]()
то добавление веществ, связывающих кислоту, ускоряет процесс.
Связывающим кислоту агентом может быть сам амин или такие вещества как сода, известь, карбонат кальция или едкий натр.
Температура реакции обычно не превышает 100°С. Поэтому в большинстве случаев процесс можно вести при атмосферном давлении в аппарате с обратным холодильником. Однако при работе с низкокипящими веществами (CH3Cl, C2H5Cl) алкилирование ведут в автоклавах. Реагенты обычно берут в стехиометрическом соотношении.
При получении антиаритмического препарата орнид алкилирование проводят дважды:

Многие лекарственные препараты выпускаются в виде четвертичных аммонийных солей:
При наличии в молекуле нескольких атомов галогена можно избирательно заместить один из них:


Большое значение в синтезе лекарственных веществ имеет алкилирование по атому азота гетероциклических соединений. Алкилгалогениды легко реагируют с пиридинами, образуя N-алкилированные четвертичные соли:

Введение этанольного остатка может быть достигнуто действием водного раствора этиленхлоргидрина на ароматический амин:
![]()

Чаще гидроксиэтильные производные получают не через этиленхлоргидрин, а действием на амин окиси этилена:


Для получения монозамещенного производного реакцию ведут в большом избытке амина при температуре ниже 100°С в присутствии воды.
Для введения двух гидроксиэтильных остатков берут небольшой избыток окиси этилена и реакцию проводят при температуре 120-140°С и давлении 0,5 МПа. Соединения этого типа имеют большое значение в синтезе противораковых препаратов, так как образующаяся ди-бетагидроксиэтиламинная группа при действии тионилхлорида легко превращается в ди-бетахлорэтиламинную группу, обладающую противоопухолевым действием.
Так как смесь окиси этилена с воздухом взрывчата, реакцию следует вести при полном отсутствии воздуха, что достигается продувкой аппарата азотом.


В производстве целого ряда препаратов (азафена, триметина, теофиллина, кофеина, теобромина, прозерина, анальгина и др.) в качестве метилирующего средства используют диметилсульфат. При применении диметилсульфата в мягких условиях (водный раствор, низкая температура) используется лишь одна метильная группа. Для полного использования диметилсульфата необходимо проводить алкилирование при температуре около 100°С в щелочной среде.

Диметилсульфат обладает достаточно высокой реакционной способностью, относительно дешев и позволяет работать при повышенных температурах при атмосферном давлении. Серьезным недостатком является его высокая токсичность.
Алкилирование простыми эфирами осуществляют пропусканием смеси паров амина и эфира при температуре 250-350°С через катализатор (Al2O3, ThO2, TiO2, ZrO2).
Алкилирование ароматических аминов спиртами обычно проводят в присутствии минеральных кислот, из которых чаще всего используют серную и соляную. Серную кислоту обычно загружают из расчета 0,05-0,3 моль на 1 моль амина. Соляную кислоту добавляют в большем количестве, доходящем до 1 моль на моль амина.
Каталитическая роль кислоты заключается в том, что она протонирует спирт, в результате чего образуется активный алкоксониевый ион AlkOH2, который легко дегидратируется, давая карбониевый катион, вступающий в реакцию с ароматическим амином:
![]()
![]()
![]()
Спирт для алкилирования берется в избытке. При получении третичных аминов этот избыток больше (до 160% от теоретического), при получении вторичных – меньше.
Алкилирование спиртами проводят в автоклавах под давлением выше 3 МПа и температуре 180-220°С.
Например, диметиланилин получают при нагревании 3,2 моль метилового спирта и 0,1 моль серной кислоты на каждый моль анилина при температуре 205-215°С и давлении около 3 МПа в течение 6 часов.
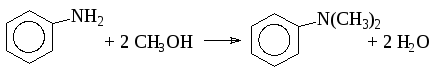
В качестве побочного продукта образуется некоторое количество соли четвертичного аммониевого основания, для разложения которого реакционную массу нагревают в автоклаве с раствором едкого натра:

Алкилирование ароматических аминов спиртами может протекать также и в паровой фазе при температуре 300-400°С при использовании в качестве катализатора окиси алюминия.
Метилирование первичных и вторичных аминов действием формальдегида и муравьиной кислоты является общей реакцией (метилирование по Эшвайлеру-Кларку):

Выходы часто достигают количественных. В реакцию вступают также аминокислоты и гетероциклические амины:


Ароматические амины метилируются лишь при наличии орто- или пара-заместителей, препятствующих конденсации формальдегида по углеродному атому ароматического ядра.
С помощью формальдегида можно связать две молекулы субстрата через метиленовую группу:

Амины и азотистые гетероциклы легко алкилируются непредельными соединениями, и эта реакция широко используется в синтезе лекарственных соединений. Так, фталимидпропионитрил в синтезе пантотената кальция получают алкилированием фталимида акрилонитрилом в присутствии катализатора:
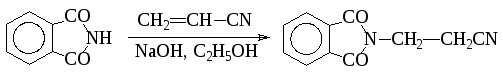
В качестве катализаторов используют этилат натрия или 1%-ный спиртовой раствор едкого натра.
