
Лф, фиу, пф. Занятие № 23
23А. Основные положения
Раздел будет добавлен сегодня, но позже.
23Б. Лекционный курс






















































































































22В. Теоретический материал
АКТИНОМИЦЕТЫ И АКТИНОМИКОЗ
Актиномицеты относятся к порядку Actinomycetales, включающему с себя семейства Actinomycetaceae, Nocardiaceae и Streptomycetaceae.
Патогенные актиномицеты представляют собой слабо ветвящиеся палочки с колбовидными утолщениями на концах. В пораженных тканях и в гное они беспорядочно переплетаются, образуя друзы (особые морфологические структуры – зерна диаметром 5 мк и более, могут кальцифицироваться).
В природе актиномицеты обитают в почве. Являются нормальным обитателями полости рта человека, реже встречаются в кишечнике, влагалище.
Актиномикоз вызывают виды рода Actinomyces (одноименного семейства): в подавляющем большинстве случаев – A.israelii, реже – A.bovis и др.
Внедрение актиномицетов во внутреннюю среду человеческого организма возможно или из внешней среды (экзогенная инфекция) или из мест их обитания, как представителей нормальной микрофлоры (эндогенная инфекция). Заболевание развивается лишь на фоне иммунодефицитного состояния. Первичный очаг формируют актиномикомы, включающие в себя друзы. Локализация актиномиком определяет клиническую картину заболевания. В дальнейшим возможна генерализация инфекции (происходящая в форме метастазирования актиномиком).
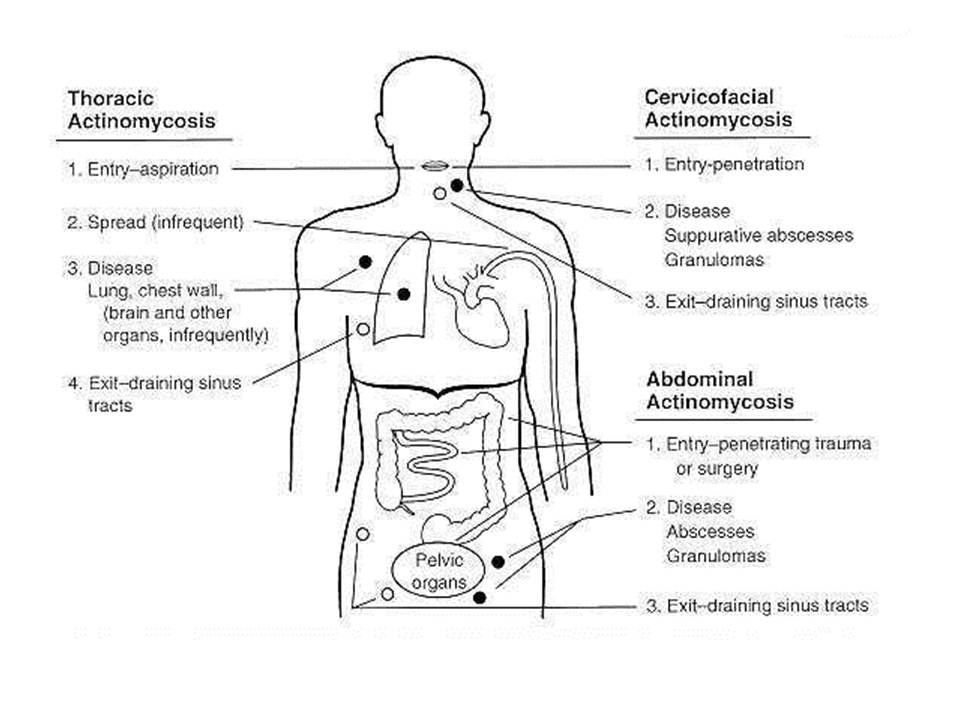
Для актиномикоза характерно хроническое гнойное воспаление с образованием гранулем и свищей. Больше половины всех случаев актиномикоза человека составляет актиномикоз лица, точнее – шейно-лицевой актиномикоз. Кроме него, может развиваться торакальный актиномикоз, абдоминальный актиномикоз. Поражения других органов относятся к редким формам актиномикоза. При метастазировании актиномицетов в средостение, головной мозг и другие внутренние органы, заболевание может закончиться смертью.
Постинфекционный иммунитет при актиномикозе не формируется (образующиеся антитела не обладают защитным действием). Формируется гиперчувствительность замедленного типа.
Микробиологическая диагностика актиномикоза проводится с помощью микроскопического метода. Мазок из патологического материала окрашивается по Граму, по Цилю-Нильсену или по Романовскому-Гимзе; все эти методы позволяют выявить друзы, центр которых окрашивается в синий цвет, периферия – в красный. Для подтверждения диагноза можно использовать культуральный, серологический и аллергический методы диагностики. Культуру выделяют на сложных средах (лучшая – кровяной агар с экстрактом сердечной мышцы), идентифицируют с помощью РИФ и по биохимическим признакам. Специфические антитела выявляют в сыворотке крови наиболее часто с помощью РСК с актинолизатом в качестве антигена. Актинолизат используют и в качестве аллергена для выявления у пациента специфической сенсибилизации кожно-аллергической пробой.
Неспецифическая профилактика актиномикоза заключается в соблюдении правил общей гигиены, специфическая – не разработана.
Для этиотропной терапии актиномикоза используют антибиотики (преимущественно пенициллины) и иммунопрепараты (актинолизат, поливалентную вакцину).
МИКОБАКТЕРИИ
Микобактерии относятся к порядку Actinomycetales, где в рамках семейства Mycobacteriaceae формируют род Mycobacteria.
Культивируемые на искусственных питательных средах микобактерии делятся на две основные подгруппы: быстрорастущие (формирующие видимый рост за неделю) и медленнорастущие (которым для формирования видимого роста нужно времени больше, чем неделя). По способности образовывать пигмент быстрорастущие микобактерии делятся на нехромогенные, лишенные такой способности (например, M.smegmatis), и обладающие способностью к пигментообразованию (например, M.phlei). Медленнорастущие микобактерии также делятся на нехромогенные (например, комплекс M.avium-intracellulare) и хромогенные (например, M.kansasii). Все они определяются как условно-патогенные, или атипичные, микобактерии. К патогенным микобактериям относится третья подгруппа медленнорастущих микобактерий, в которую выделены возбудители туберкулеза, а также отдельная (наравне с культивируемыми микобактериями) группа – некультивируемые микобактерии, включающая в себя единственный вид: M.leprae.
Микобактерии – особая группа прокариот, отличающаяся от остальных бактерий своей кислото-, спирто- и щелочеустойчивостью, высоким содержанием липидов в клеточной стенке (более половины её массы), очень медленных ростом.
Высокое содержание липидов в клеточной стенке обусловливает окрашивание микобактерий по Цилю-Нильсену в красный цвет. Вместе с тем необходимо иметь в виду, что встречаются и кислотоподатливые (окрашивающиеся по Цилю-Нильсену в синий цвет) микобактерии.
ВОЗБУДИТЕЛИ ТУБЕРУЛЕЗА
Возбудителями туберкулеза являются три вида: M.tuberculosis (вызывает примерно 92% случаев туберкулеза у человека), M.bovis (этиологический фактор примерно 5% случаев туберкулеза у человека) и M.africanum (на который приходится отсавшиеся 3% случаев туберкулеза в человеческой популяции).
«Палочка Коха» (собирательный термин, часто используемый для обозначения возбудителя туберкулеза) – это тонкая и стройная, похожая на швейную иглу, прямая или слегка изогнутая палочка, обладающая большим полиморфизмом (в том числе и по своим тинкториальным свойствам), особенно – в организме больных под влиянием лечебных препаратов.
Палочка Коха имеет сложные питательные потребности. На жидких средах вырастает за неделю в виде морщинистой пленки, на плотных – в течение 2-4 недель, формируя R-формы колоний (похожие на бородавки или цветную капусту) с желтым пигментом. Лучшей средой для ее выделения считается свернутая среда Левенштейна-Иенсена в разных модификациях (включает в себя малахитовый зеленый как агент, ингибирующий рост контаминирующей патологический материал сопутствующей микрофлоры).
Единственный тест, используемый для идентификации возбудителей туберкулеза и основанный на их биохимических свойствах – ниациновая проба (о ней будет сказано ниже).
Антигенами палочки Коха являются туберкулопротеин, полисахариды, фосфатиды, корд-фактор. Но антигенный состав всех видов микобактерий сходен, вследствие чего серологический метод их идентификации практически не используется.
К факторам патогенности палочки Коха относятся сульфатиды (серосодержащие гликопротеиды), корд-фактор (гликолипид, располагающийся на поверхности и в толще клеточной стенки), липиды и белки.
Сульфатиды снижают активность фагоцитов, ингибируя в них фагосомо-лизосомальное слияние, а также усиливают действие корд-фактора.
Корд-фактор – главный фактор патогенности возбудителей туберкулеза, лишенные его туберкулезные палочки являются невирулентными или слабовирулентными для человека. Корд-фактор поражает мембраны митохондрий, блокируя в них процессы окислительного фосфорилирования. Кроме того, он тормозит миграцию фагоцитов.
Липиды туберкулезной палочки оказывают повреждающее действие на ткани макроорганизма.
Токсические липиды палочки Коха состоят из нейтральных жиров, восков, стеринов, фосфатидов, жирных кислот (фтиоидной, миколовой, туберкулостеариновой, пальмитиновой), корд-фактора.
Выделяют три фракции токсических липидов туберкулезной палочки. Наиболее активная из них – фосфатидная фракция (содержит фтиоидную кислоту), которая вызывает специфическую тканевую реакцию с образованием эпителиоидных клеток. Жировая (нейтральные жиры) фракция, также содержащая фтиоидную кислоту, вызывает образование туберкулоидной ткани. Восковая фракция (содержит миколовую кислоту) вызывает реакции с образованием многочисленных гигантских клеток.
Белки палочки Коха (составляют основу туберкулина) вызывают сенсибилизацию организма, но, наряду с этим, оказывают еще и повреждающее действие на ткани.
Возбудители туберкулеза устойчивы во внешней среде. При кипячении погибают через 5 минут, прямой солнечный свет убивает их в течение часа. Химические дезинфектанты по отношению к микобактериям малоэффективны (например, 5% раствор фенола убивает их только через 5-6 часов). Туберкулезная палочка способна вырабатывать устойчивость ко многим антибактериальным средствам.
ТУБЕРКУЛЕЗ
Источником инфекции при туберкулезе является больной человек, реже – животное. Основной механизм передачи аэрозольный (чаще – воздушно-пылевой). Дополнительный путем заражения служит алиментарный, в частности, заражение M.bovis часто происходит от крупного рогатого скота через молоко и молочные продукты.
Туберкулез – это инфекционное заболевание человека и животных, характеризующееся наклонностью к хроническому течению и образованием специфических воспалительных изменений (туберкулом). Туберкулезная палочка может поражать любой орган и любую ткань.
Входными воротами инфекции служат дыхательные пути (чаще всего), любые слизистые оболочки и любой поврежденный участок кожи. Из ворот инфекции фагоцитами туберкулезные палочки доставляются в региональные лимфатические узлы. При этом у инфицированного человека формируется так называемый первичный туберкулезный комплекс: гранулема в месте внедрения возбудителя + воспалительный процесс в региональных лимфатических узлах + сенсибилизация организма. При доброкачественном течении гранулема кальцифицируется и рубцуется, а у человека формируется противотуберкулезный иммунитет (но возбудитель в гранулеме сохраняется). При действии неблагоприятных факторов, снижающих антиинфекционную резистентность организма человека, происходит гематогенная генерализация процесса с образованием множественных очагов, склонных к распаду.
Инфекционная гранулема (бугорок) при туберкулезе является следствием защитной реакции организма, направленной на локализацию возбудителя в месте внедрения.
В центре ее находятся гигантские клетки Пирогова-Лангганса с множеством ядер, именно в этих клетках и находятся туберкулезные палочки. Центр гранулемы окружен эпителиоидными клетками, составляющими главную ее массу. По периферии располагаются лимфоидные клетки.
При неблагоприятном течении процесса инфекционная гранулема может увеличиваться и подвергаться творожистому (казеозному) распаду под влиянием токсических продуктов туберкулезной палочки.
При благоприятном течении процесса инфекционная гранулема окружается соединительнотканной капсулой, сморщивается и пропитывается солями кальция. Так как туберкулезная палочка в ней сохраняется, туберкулез является примером заболевания, при котором вырабатывается так называемый нестерильный иммунитет.
Ведущую роль в иммунитете при туберкулезе играют Т-клетки. Антитела к корд-фактору и другим факторам вирулентности палочки Коха играют вспомогательную роль. Локализация возбудителя путем образования гранулем происходит вследствие реакции гиперчувствительности замедленного типа (ГЗТ), очень выраженной при этой инфекции.
Инфекционная аллергия всегда сопутствует инфицированию туберкулезной палочкой. Выявляется туберкулиновыми пробами (в большинстве стран предпочтение отдается внутрикожному тесту – реакции Манту). Реакция Манту становится положительной через 6-10 недель после инфицирования. Туберкулин, используемый в качестве аллергена, представляет собой фильтрат автоклавированной бульонной кльтуры M.tuberculosis. Для реакции Манту используется очищенный белковый препарат туберкулина (ППД).
У детей туберкулиновая проба может иметь диагностическую ценность (а именно, у детей, не вакцинированных БЦЖ). У взрослых туберкулиновые пробы ставятся с целью определения инфицированности, отбора контингента для ревакцинации, контроля эффективности вакцинации, а также для оценки течения туберкулезного процесса.
Сенсибилизированный организм (т.е. инфицированный туберкулезной палочкой) приобретает способность быстро связывать новую дозу возбудителя и удалять ее (в этом процессе ведущую роль играют Т-лимфоциты) из организма. Поэтому заболевание туберкулезом у взрослых, уже инфицированных туберкулезной палочкой, в большинстве случаев протекают относительно доброкачественно, в виде местного процесса в легких, а не в виде генерализованного процесса, как у детей при первичном заражении.
Патологическим материал при микробиологической диагностике туберкулеза забирается из пораженного органа (при туберкулезе легких, наиболее часто встречающейся форме этой инфекции, берется мокрота). Патологический материал микроскопируется (используется окраска по Цилю-Нильсену и окраска флуорисцентным красителем аурамином) и, после обработки (для избавления от сопутствующей микрофлоры) кислотой и последующей нейтрализацией щелочью используется для выделения чистой культуры и для заражения морской свинки. Выделенная чистая культура идентифицируется до вида и тестируется на предмет чувствительности к лечебным препаратам. Морская свинка в положительном случае заболевает и погибает. Наличие в патологическом материале возбудителей туберкулеза можно выявить и с помощью ПЦР.
Таким образом, при микробиологической диагностике туберкулеза используются микроскопический, культуральный, биологический, молекулярно-генетический методы. Серологический метод (выявление в сыворотке крови специфических антител) используется редко.
Туберкулез – одна из немногих инфекций, диагноз которой можно поставить, используя микроскопический метод. Однако, концентрация туберкулезных палочек в патологическом материале невелика, поэтому прямая микроскопия может дать ложноотрицательный результат. Предпочтительней пользоваться методами обогащения (гомогенизацией, флотацией) – для повышения концентрации в полях зрения туберкулезных палочек. Еще более эффективна флуоресцентная микроскопия с обработкой мазка флуоресцентной краской, чаще всего – аурамином.
Метод гомогенизации заключается в том, что суточная доза мокроты разбавляется равным объемом 1% раствора едкого натра, энергично встряхивается 10-15 минут, нейтрализуется кислотой, центрифугируется и осадок используется для приготовления мазка. Метод флотации служит для еще более сильного обогащения микроскопируемого материала: гомогенизированная мокрота прогревается на водяной бане при 550С в течение 30 минут, после чего к ней добавляют 1-2 мл ксилола, 10 минут встряхивают и отстаивают при комнатной температуре 20 минут – мазок делается из формируемого в результате отстаивания пенообразного слоя. Во всех случаях при микроскопической диагностике туберкулеза готовят так называемый «толстый мазок»: мокроту наносят на предметное стекло в несколько слоев, каждый раз дожидаясь, пока предыдущий слой подсохнет.
При использовании в диагностике туберкулеза культурального, а также биологического методов диагностики, патологический материал предварительно (т.е. перед засевом на питательную среду или перед введением лабораторному животному) обрабатывают кислотой, затем нейтрализуют щелочью и тщательно промывают водой. Эта процедура позволяет избавиться от посторонней, кислотоподатливой, микрофлоры, но замедляют и без того отнюдь не быстрый рост возбудителей туберкулеза, поэтому не применяется в тех случаях, когда патологический материал берется из закрытых полостей (т.е. он в норме должен быть стерилен).
При культурльном методе диагностики туберкулеза патологический материал засевается на среду Левенштейна-Йенсена и культивируется на протяжении от 2 до 12 недель. Выросшая культура идентифицируется с помощью ниациновой пробы (с этой целью может использоваться и биопроба). Обязательно определяют чувствительность выделенной культуры к туберкулостатическим препаратам.
При биологическом методе диагностики туберкулеза 0,1 мл патологического материала вводится морской свинке или подкожно в паховую область или внутрибрюшинно. На 5-10 сутки у животного развивается лимфаденит, а через 3-4 недели – положительная реакция на туберкулин. Погибает морская свинка через 1-2 месяца после начала эксперимента. Бывший раньше «золотым стандартом» в диагностике туберкулеза, биологический метод в настоящее время менее информативен, поскольку изониазидустойчивые штаммы туберкулезной палочки снижают свою вирулентность для морской свинки.
Существует ускоренный метод выделения туберкулезной палочки (метод микрокультур, метод Прайса), осуществляемый следующим образом. Готовятся «толстые мазки» из патологического материала на узких предметных стеклах. Мазки обрабатываются 6% серной кислотой, нейтрализуются щелочным раствором, промываются водой. Затем помещают во флаконы с гемолизированной цитратной кровью в разведении 1:4 (средой Школьникова). Через несколько дней культивирования (обычно каждый два дня по одному стеклу) мазки достают, окрашивают по Цилю-Нильсену и микроскопируют. Этот метод позволяет не только выявить в мокроте микобактерии, но и определить их вирулентность: вирулентные располагаются в виде «лисьих хвостов» (вследствие наличия в них корд-фактора), невирулентные микобактерии располагаются беспорядочно.
Выделенная культура туберкулезной палочки идентифицируется до вида. Как правило, M.africanum в европейских лабораториях не идентифицируется, для отличия же M.tuberculosis (человеческого типа возбудителя туберкулеза) от M.bovis (бычьего типа возбудителя туберкулеза) используют ниациновую пробу Конно и биопробу. Нациновая проба осуществляется следующим образом: к культуре микобактерий в жидкой питательной среде добавляется 1 мл раствора KCN и 1 мл раствора хлорамина, появляющаяся через несколько минут ярко-желтая окраска свидетельствует о том, что культура принадлежит к M.tuberculosis, если цвет не меняется – культура принадлежит M.bovis. Для дифференциации этих двух видов с помощью биопробы культурой (или, для экономии времени, мокротой больного) заражают одновременно морскую свинку и кролика. Морская свинка заболеет в любом случае – она служит индикатором наличия в патологическом материале туберкулезной палочки любого вида, а кролик заболеет лишь в случае заражения его M.bovis.
Отдельную проблему представляет собой выявление L-форм туберкулезной палочки. Для этого используют три подхода. Во-первых, существуют специальные флюоресцирующие диагностические сыворотки против специфических антигенов L-форм палочки Коха (т.е. их можно выявить с помощью РИФ). Во-вторых, проводят засев патологического материала в специальную полужидкую среду с последующей микроскопией образовавшегося через полтора-два месяца мутного облачка с включениями (похожего на манную крупу) с помощью фазово-контрастного микроскопа. В третьих, используют многократные пассажи на морских свинках: при этом L-формы повышают свою вирулентность и, в конце концов, вызывают у лабораторного животного инфекцию.
Для специфической профилактики туберкулеза используется вакцина БЦЖ (вводится внутрикожно) – живой ослабленный штамм, полученный Кальметтом и Гереном из M.bovis. Эта вакцина в нашей стране входит в календарь обязательных прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой. У новорожденных со сниженной резистентностью применяют менее реактогенную вакцину BCG-M (с меньшим содержанием антигена).
Для этиотропной терапии используют так называемые туберкулостатические препараты, которые классифицируются на препараты первого ряда (например, изониазид) и альтернативные средства (например, ПАСК – парааминосалициловая кислота). Курс лечения не должен продолжаться менее года.
УСЛОВНО-ПАТОГЕННЫЕ МИКОБАКТЕРИИ
Классификация условно-патогенных («атипичных») микобактерий предложена еще в 1959 г. Раньоном. Он разделил их на четыре группы. Первые три группы включают в себя медленнорастущие виды, в свою очередь классифицируемые в зависимости от их способности образовывать пигмент. В первую группу входят фотохомогенные микобактерии, которые образуют пигменты (желтые каратиноиды) только при культивировании на свету. Во вторую группу входят скотохромогенные микобактерии, образующие пигменты и на свету и в темноте. В третью группу входят нехромогенные, т.е. не образующие пигмента, микобактерии. В четвертую группу входят быстрорастущие микобактерии (вне зависимости от их способности к пигментации).
Условно-патогенные микобактерии в ослабленном организме вызывают туберкулезоподобные поражения. Их возрастающая роль в патологии человека обусловлена, в том числе, и беспорядочным применением антибиотиков, к которым они обладают широким спектром резистентности. У детей атипичные микобактерии чаще вызывают лимфаденит, а также кожные поражения и легочную инфекцию.
MYCOBACTERIUM LEPRAE И ПРОКАЗА (ЛЕПРА)
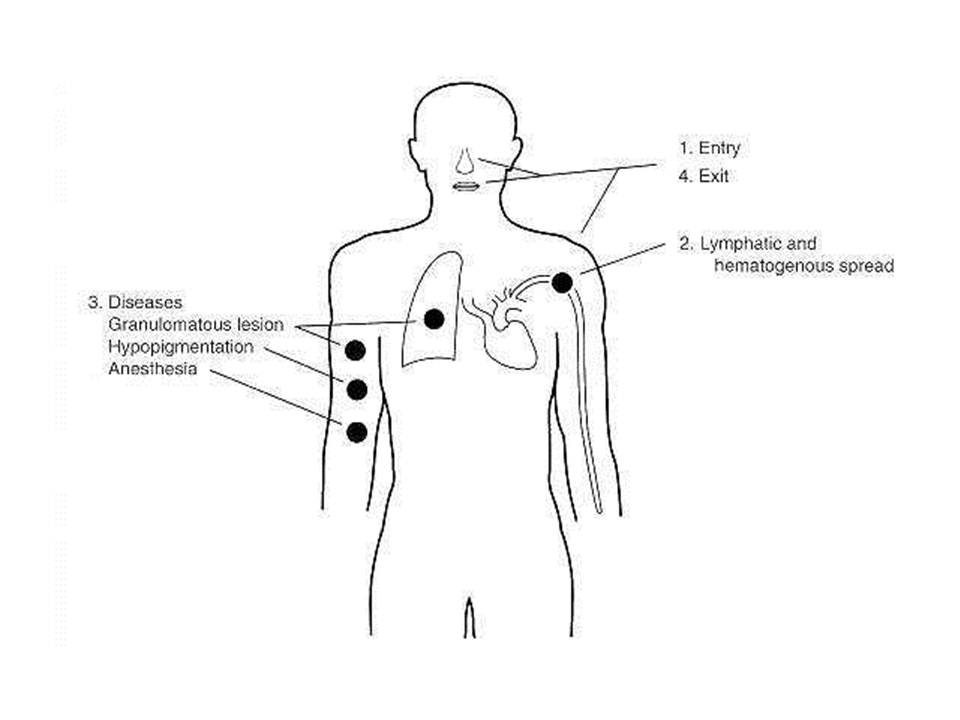
По своим морфологическим свойствам возбудитель лепры схож с туберкулезной палочкой. M.leprae – облигатный внутриклеточный паразит. Культивирование его на искусственных питательных средах крайне затруднено, лучший способ культивирования – заражение большими дозами (108 клеток) броненосцев амадриллов, у которых этот вид вызывает диссеминированный процесс и в огромных количествах накапливается в пораженных тканях. В мазках палочка лепры располагается в виде параллельных групп («пачек сигар») или шаровидными скоплениями.
Лепра (проказа) – хроническое заболевание людей, характеризующееся образованием гранулем двух возможных типов, лепроматозного или туберкулоидного. Инкубационный период варьирует от 3 до 30 лет. Развитие заболевания также происходит медленно, в течение многих лет.
Заражение лепрой происходит при длительном и тесном контакте с больным. Преимущественный путь заражения – воздушно-капельный, чем обусловлен тот факт, что возбудитель всегда содержится на слизистой оболочке носа. Возможно проникновение возбудителя и через поврежденную кожу.
Далее палочки лепры гематогенным и лимфогенным путями, а также по нервным окончаниям разносятся по организму, не вызывая в воротах инфекции видимых изменений.
Антитела при лепре вырабатываются в большом количестве, но не играют защитной роли. Т-система иммунитета при лепре угнетается, особенно резко – при лепроматозной форме.
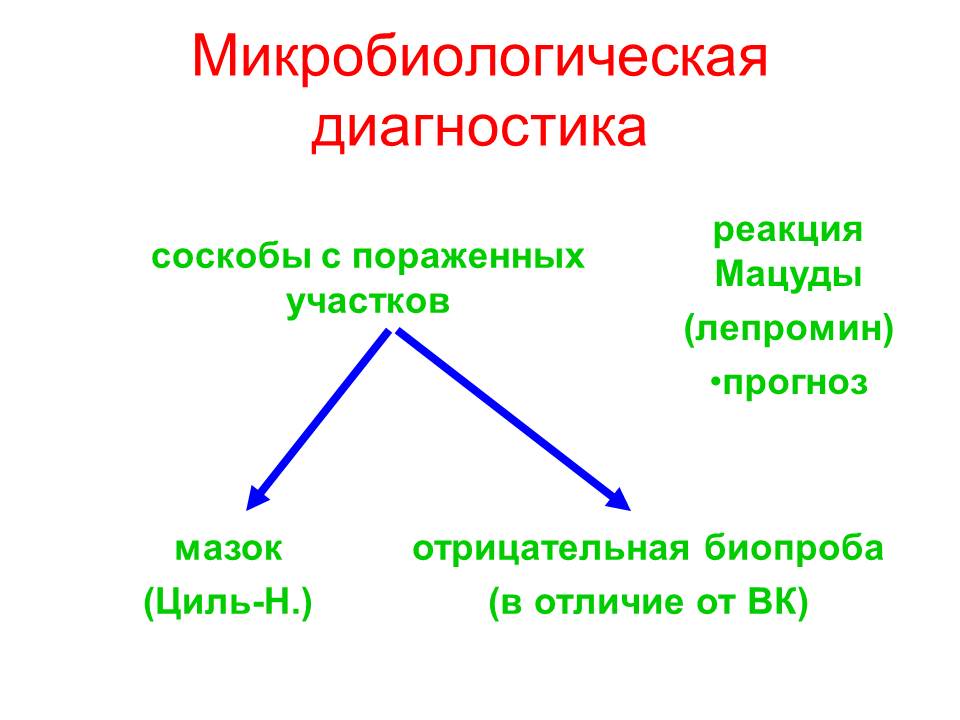
Для микробиологической диагностики лепры используют соскобы с пораженных участков. Из них готовят мазок, который окрашивают по Цилю-Нильсену, в котором обнаруживают микобактерии с преимущественно внутриклеточной локализацией. Одновременно патологическим материалом заражают морскую свинку, для которой палочка лепры, в отличие от туберкулезной палочки, абсолютно непатогенная. Аллергическая проба с лепромином (реакция Мацуды) положительна при более легкой, туберкулоидной, форме заболевания и отрицательна при более тяжелой, лепроматозной, в связи с чем используется с прогностической целью.
ЛИСТЕРИИ И ЛИСТЕРИОЗ
Листерии относятся к роду Listeria. Патогенный для человека вид – L.monocytogenes.
Это грамположительные полиморфные коккобактерии. Перитрихи. В мазке располагаются поодиночке, палочковидные формы могут располагаться попарно, под углом друг к другу (напоминая букву V).
Выращиваются преимущественно на сложных питательных средах, хотя особой требовательности к питательному субстрату не отличаются. Вырастают через 1-2 дня при 370С в любых условиях аэрации. Образуют на жидких средах муть, а на плотных – мелкие S- и R-формы колоний с голубовато-сероватым оттенком, на кровяных средах – с узкой зоной β-гемолиза. Для культур листерий характерен запах творога или молочной сыворотки.
В качестве селективных сред для выделения листерий используются кровяной агар с трипафлавином и налидиксовой кислотой и глюкозо-глицерино-сывороточный агар (или бульон) с теллуритом калия; последняя среда используется для выделения листерий чаще всего.
Ферментативная активность листерий невысокая.
Листерии обладают О- и Н-антигенами, которые, однако, мало специфичны и схожи с другими бактериями, что затрудняет серологическую диагностику заболевания.
К факторам патогенности листерий относятся токсин, гемолизин (листериолизин), вызывающий разрушение мембраны фагосомы, мембранный белок интерналин, обуславливающий проникновение листерий внутрь клеток, и фосфолипазы, разрушающие мембраны клеток. Свое название патогенный для человека вид листерий получил благодаря своему моноцитозстимулирующему действию.
Листерии чувствительны к дезинфектантам, а вот при 100оС погибают лишь через 3-5 минут, поэтому сохраняются в пастеризованном молоке. Хорошо переносят низкие температуры; при 4оС на мясе и в молоке не только не гибнут, но и размножаются.
Источником инфекции при листериозе могут быть животные, хотя для листерий внешняя среда является главным местом обитания, в силу чего листериоз можно рассматривать как сапроноз. Передача инфекции происходит через желудочно-кишечный тракт, дыхательные пути, поврежденную кожу.
Листериоз – полиморфное заболевание с преобладающим поражением нервной ткани или с развитием ангиозно-септических форм. Если не поражается ЦНС (смертность от листериозного менингоэнцефалита без лечения достигает 50%), то исход заболевания благоприятный. Следует иметь в виду, что инфицирование беременных, как правило, приводит к гибели плода.
В результате бактериемии листерии обсеменяют паренхиматозные органы и ЦНС. В пораженных органах формируются листериомы (узелки, состоящие из измененных клеток органов и мононуклеарных фагоцитов, а также скоплений возбудителя). Некротизирование листериом обуславливает формирование в соответствующей ткани дистрофических изменений. При гибели листерий высвобождается токсин и развивается интоксикация.
Постинфекционный иммунитет при листериозе непрочный, обусловлен в основном клеточными факторами. Известную роль в противолистериозном иммунитете играют фагоциты (внутри которых листерии теряют способность к размножению) и состояние аллергии.
Микробиологическая диагностика основана на идентификации выделенной из патологического материала (или на питательной среде или посредством биопробы) чистой культуры возбудителя. Обнаружение листерий в патологическом материале возможно также и с помощью ПЦР. В сыворотке крови определяют нарастание титра специфических антител. При низком титре последних ставят аллергическую пробу для выявления ГЗТ.
В качестве патологического материала при микробиологической диагностике листериоза используют кровь, ликвор, слизь из зева, пунктат увеличенных лимфатических узлов, околоплодные воды; у новорожденных – меконий, пупочную кровь, секционный материал. Идентификацию чистой культуры проводят по следующим признакам: состоит из маленьких грамположительных палочек, подвижных, ферментирует углеводы только до кислоты (без образования газа), каталазоположительна, при заражении морской свинки в конъюнктивальный мешок у лабораторного животного развивается конъюнктивит, агглютинируются специфической сывороткой. Из материала, сильно загрязненного посторонней микрофлорой, выделяют культуру биологическим методом: заражаются белые мыши, иммуносупрессированные кортизоном, или морские свинки, для выделения культуры берут печень и селезенку павших животных.
Антитела в сыворотке крови обнаруживают в РА, РНГА, РСК с использованием метода парных сывороток. У лиц со слабоположительными серологическими реакциями подтвердить диагноз помогает положительная кожно-аллергическая проба.
Специфическая профилактика листериоза не разработана. Профилактические меры заключаются в соблюдении правил личной гигиены при контакте с животными, раннее выявление, изоляция и лечение больных листериозом домашних животных. Антимикробная терапия листериоза (хороший эффект дает применение антибиотиков пенициллинового ряда) при беременности может предотвратить заражение плода или перинатальное заболевание и его последствия.
Для этиотропной терапии листериоза используют антибиотики и сульфаниламиды.
