
- •4) Существует функция состояния термодинамической системы – энтропия. При обратимых процессах в изолированной системе её энтропия не изменяется, а при необратимых (самопроизвольных) – увеличивается.
- •Растворы
- •Водородная и кислородная коррозия
- •Конструкционный Активный Пассивный
- •Характеристика электронов квантовыми числами
Характеристика электронов квантовыми числами
а) Главное квантовое число (n) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ¥. В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число (l). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l. Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n–1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s (l=0), p (l=1), d (l=2), f (l=3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
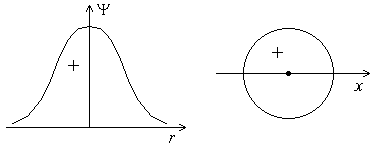
График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
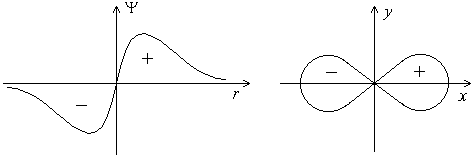
График волновой функции p-электрона. Форма p-электронного облака
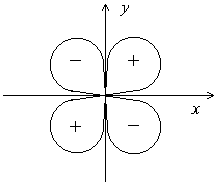 Электронные
облака d- и f-электронов
Электронные
облака d- и f-электронов
38
Магнитное квантовое число (ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поля объясняются различием в характере расположения электронных облаков в пространстве и, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном l оно имеет (2l+1) различных значений. Например, для s-подуровня (l=0) имеется только одно значение ml, равное нулю. Поэтому s-подуровень содержит единственную орбиталь. Для p-подуровня (l=1) возможны три значения: mlÎ{–1,0,1}. В соответствии 1 с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px, py, pz. Легко определить, что на d-подуровне (l=2) содержится 2l+1=5 орбиталей, а на f-подуровне (l=3) – 7 орбиталей.
39
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s-подуровень (состоит из одной s-орбитали)
p-подуровень (состоит из трех p-орбиталей)
d-подуровень (состоит из пяти d-орбиталей)
f-подуровень (состоит из семи f-орбиталей), условное обозначение
Энергии орбиталей одного подуровня одинаковы.
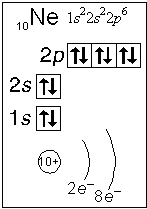
Правило Хунда – электроны располагаются на орбиталях таким образом, чтобы суммарный спин атома был максимален. Согласно этому правилу в пределах энергетического подуровня все орбитали сначала заселяются одним электроном, а затем – вторым.
40
Спиновое квантовое число (ms) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси. Число ms принимает два значения: +1/2 и –1/2.Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, l и ml, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
![]()
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
41
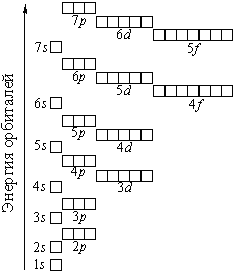
Правило Клечковского (принцип наименьшей энергии) – последовательность заселения электронами энергетических уровней и подуровней в атоме должна отвечать наибольшей связи электронов с ядром, т.е. электронная система должна обладать наименьшей энергией. Порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного квантовых чисел, причем при фиксированном значении (n + l) заполняются состояния, отвечающие минимальному значению n.
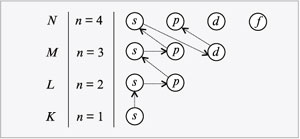
Последовательность заполнения электронами энергетическиуровней и подуровней
42
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность. Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества. Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.
Эне́ргией сродства́ а́тома к электро́ну называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона) Э + e− = Э− + ε Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ атома - условная величина, характеризующая способность атома в молекуле приобретать отрицательный заряд (притягивать электроны). Зная электроотрицательность, можно определить полярность ковалентной связи, вычислить эффективные заряды атомов.
43
Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Периоды- это горизонтальные ряды( их 7).Бывают малые(1,2,3) и большие(4,5,6).Номер периода показывает число слоёв (энергетический уровень).Свойства элементов повторяются т.к повторяется число электронов на последнем слое.
Группы- это вертикальные ряды элементов(их 8),они делятся на подгруппы(главная и побочная). Показывает число электронов на последнем слое.
Главная (элементы больших и малых периодов)
Побочная(элементы только больших периодов)
В группе металлические свойства увеличиваются, а неметаллические уменьшаются.
В периоде металлические свойства уменьшаются, а неметаллические увеличиваются.
44
Вертикальная периодичность заключается в повторяемости свойств простых веществ и соединений в вертикальных столбцах Периодической системы. Это основной вид периодичности, в соответствии с которым все элементы объединены в группы. Элементы одной группы имеет однотипные электронные конфигурации. Химия элементов и их соединений обычно рассматривается на основе этого вида периодичности.
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода. Она особенно заметна для элементов VIIIБ-группы и лантаноидов (лантаноиды с четными порядковыми номерами более распространены, чем с нечетными). В таких физических свойствах, как энергия ионизации и сродство к электрону, также проявляется горизонтальная периодичность, связанная с периодическим изменением числа электронов на последних энергетических подуровнях.
Диагональная периодичность - повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Вторичная периодичность . Многие свойства элементов в группах изменяются не монотонно, а периодически, особенно для элементов IIIA-VIIA-групп. Такое явление носит название вторичной периодичности. Так, германий по своим свойствам больше похож на углерод, чем на кремний. Для элементов 4-го периода, находящихся в VA-VIIA-группах, (As, Se, Br) характерна малая устойчивость соединений в высшей степени окисления. Вторичная периодичность связана, в частности, с относительной инертностью валентных s-электронов за счет так называемого "проникновения к ядру", поскольку увеличение электронной плотности вблизи ядра при одном и том же главном квантовом числе уменьшается в последовательности ns > np > nd > nf. Поэтому элементы, которые в Периодической системе стоят непосредственно после элементов со впервые заполненным p-, d- или f-подуровнем, характеризуются понижением устойчивости их соединений в высшей степени окисления. Это натрий и магний (идут после элементов с впервые заполненным р-подуровнем), р-элементы 4-го периода от галлия до криптона (заполнен d-подуровень), а также послелантаноидные элементы от гафния до радона.
45
Радиусы атомов элементов находятся в периодической зависимости от их порядкового номера.
В периодах по мере увеличения заряда ядра радиусы атомов, в общем, уменьшаются, что связано с усилением притяжения внешних электронов к ядру. Наибольшее уменьшение атомных радиусов наблюдается у элементов малых периодов. В группах элементов радиусы атомов, в общем, увеличиваются, так как растет число электронных слоев. Таким образом, в изменении атомных радиусов элементов просматриваются разные виды периодичности: вертикальная, горизонтальная и диагональная.
Небольшие размеры атомов элементов второго периода приводят к устойчивости кратных связей, образованных при дополнительном перекрывании р-орбиталей, ориентированных перпендикулярно межъядерной оси. Так, диоксид углерода − газообразные мономер, молекула которого содержит две двойные связи, а диоксид кремния − кристаллический полимер со связями Si−O. При комнатной температуре азот существует в виде устойчивых молекул N2, в которых атомы азота соединены прочной тройной связью. Белый фосфор состоит из молекул Р4, а черный фосфор представляет собой полимер.
По-видимому, для элементов третьего периода образование нескольких одинарных связей выгоднее формирования одной кратной связи. Вследствие дополнительного перекрывания р-орбиталей для углерода и азота характерны анионы СО32− и NO3− (форма треугольника), а для кремния и фосфора более устойчивы тетраэдрические анионы SiO44− и PO43−.
46
