
- •Основные показатели стадии химического превращения
- •Пример 10.
- •Пример 11.
- •Пример 12.
- •Пример 15.
- •Пример 16.
- •Пример 18.
- •Пример 22.
- •Пример 23.
- •Пример 24.
- •Пример 25.
- •Пример 30.
- •Пример 35.
- •Пример 40.
- •Пример 42.
- •Пример 43.
- •Пример 44.
- •Пример 45.
- •Пример 46.
- •Пример 47.
- •Пример 48.
- •Пример 49.
- •Пример 51.
- •Пример 52.
- •Пример 53.
- •Пример 54.
- •Пример 55.
- •Пример 56.
- •Пример 57.
- •Пример 58.
- •Пример 59.
- •Пример 60.
- •Пример 62.
- •Пример 63.
- •Пример 64.
Пример 1.
Определить плотность синтез-газа при 300 °С и 10 МПа, если объемное соотношение оксида углерода и водорода равно 2:1. Для решения воспользоваться уравнением Беатти — Бриджмена. Постоянные для СО: А0= 1,3445, а=0,02617, В0 = 0,05046, 6 = — 0,00691, с = 420000; для Н2: А0 = 0,1975, а = —0,00506, В0= 0,02096, b = —0,04359, с=504.
Решение. Мольные доли в смеси: для СО 0,67, для Н2 0,33. Постоянные для смеси:
 =
0,8530
=
0,8530
асм = 0,67 · 0,02617 — 0,33 · 0,00506 = 0,01586
B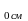 = 0,67 · 0,05046 + 0,33 · 0,02096 = 0,04073
= 0,67 · 0,05046 + 0,33 · 0,02096 = 0,04073
bсм= —0,67 · 0,00691 —0,33 · 0,04359 = —0,01901
ссм
=
0,67 · 420000 + 0,33 · 504 = 281566,32
Подставляя значения параметров и постоянных в уравнение, получим:

Решение этого уравнения методом подбора дает V=0,515 м3/кмоль.
Средняя мольная масса смеси:
МсР = 0,67 · 28 + 0,33 · 2 = 19,42 кг/кмоль
Плотность смеси:
 =
19,42 : 0,515 = 37,71 кг/м3
=
19,42 : 0,515 = 37,71 кг/м3
Для сравнения: плотность жидкого водорода при 20 К равна 71 кг/м3, а плотность жидкого оксида углерода при 80 К равна 803 кг/м3.
Основные показатели стадии химического превращения
Пример 2.
Пиролизу подвергли 1500 м3 метана. Степень конверсии метана равна 60%, масса ацетилена в продуктах пиролиза составляет 400 кг. Определить селективность процесса.
Решение. Уравнение реакции:
2СН4 → С2Н2 + 3 Н2
2·22,4 м3 26 кг 3·2 кг
Объем превращенного метана:
1500 · 0,6 = 900 м3
Теоретически возможную массу ацетилена (в расчете на превращенный метан) определяют, исходя из стехиометрических соотношений по пропорции:
2·22,4 м3 СН4 — 26 кг С2Н2
900 м3 СН4 — m кг С2Н2
Откуда
 кг С2Н2
кг С2Н2
Селективность процесса:
400 : 522 = 0,766 или 76,6%
Пример3.
Выход этилхлорида, получаемого гидрохлорированием этилена, составляет 90% от теоретического. Определить объем этиленовой фракции, если объемная доля этилена в ней равна 90%, необходимый для получения 810 кг этилхлорида.
Решение. Уравнение реакции:
С2Н4 + НС1→C2H5Cl
22,4 м8 36,5 кг 64,5 кг
Максимально возможную (теоретическую) массу этилхлорида определяют с учетом выхода продукта:
810 : 0,9 = 900 кг С2Н6С1
Объем этилена исходя из стехиометрических соотношений:
22,4 · 900 : 64,5=312,6 м3 С2Н4
Объем этиленовой фракции:
312,6 : 0,9 = 347,3 м3
ЭЛЕМЕНТЫ РАСЧЕТОВ ХИМИЧЕСКИХ РЕАКТОРОВ
Пример 4.
Производительность реактора дегидрирования н-бутана до н-бутенов составляет 17400 кг целевого продукта в час. Процесс проводят при 600 °С, и в этих условиях степень конверсии н-бутана равна 30%, а селективность по н-бутенам составляет 75%. Определить вместимость реактора, приняв для расчета константы скорости формулу:

Решение. Уравнение реакции:
СН3-СН2-СН2-СН3 ↔ СН2=СН-СН2-СН3 + Н2
58 кг (22,4 м3) 56 кг 2 кг
Расход н-бутана для проведения процесса:
теоретический (17400·22,4)/56 = 6960 м3/ч
фактический (( 6960·100)/30)·(100/75) = 30933 м3/ч,
или 30933 : 3600 = 8,6 м3/с
Константа скорости:


Предполагая, что дегидрирование н-бутана протекает по уравнению первого порядка, определим время пребывания реагирующих газов в зоне контакта:

Вместимость реактора:

Пример 5.
Акрилонитрил получают окислительным аммонолизом пропилена в псевдоожиженном слое катализатора. В реактор, производительность которого по целевому продукту равна 5600 кг/ч, поступает газовая смесь, объемная доля пропилена в которой 8%. При 450°С степень конверсии пропилена равна 60%, а селективность по акрилонитрилу составляет 75%. Определить объем катализатора в реакторе, приняв для расчета константы скорости такую формулу:

Решение. Уравнение реакции:
СН2 =СН—СН3 + NH3 + 1,5 О2 → СН2 = CHCN + 3 Н20
42 кг (22,4 м3) 17 кг 15·32 кг 53 кг 3·18 кг
Расход пропилена на проведение процесса:
Теоретический
5600
Фактический

Объемный расход газовой смеси на входе в реактор:

Определение константы скорости:
k = 2,8 · 105 · 2,72-80000//8,314(450+273) =
= 2,8·105 ·2,7213,3=2,8· 105·0,2 · 10-5 = 0,56 с-1
где R=8,314 кДж/(моль·К), а е=2,72.
При соотношении исходных веществ С3Н6 : NН3 : О2 : Н20, равном 1:0,7:1,7:3, реакция окислительного аммонолиза имеет первый порядок по пропилену, а по кислороду и аммиаку — нулевой.
Формула для расчета времени прерывания веществ в реакционной зоне:
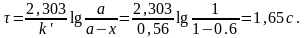
Объем катализатора в реакторе:
18,3·1,65 = 30 м3
Пример 6.
Время пребывания углеводородов при получении ацетилена электрокрекингом равно 0,001 с, объемный расход газов пиролиза равен 25500 м3/ч, скорость газов в реакционной камере составляет 900 м/с. Определить площадь сечения, высоту и объем реакционной камеры электродугового реактора.
Решение. Секундная объемная производительность реактора (по газам электрокрекинга):
25500:3600 = 7,08 м3/с
Объем реакционной камеры:
7,08·0,001= 0,0071 м3
Площадь сечения реакционной камеры:
7,08 : 900 = 0,0079 м2
Высота реакционной камеры:
0,0071 : 0,0079 = 0,9 м или 900 · 0,001 = 0,9 м
Пример 7.
Объемная скорость подачи этилена в реактор прямой гидратации равна 1900 ч-1, а объемный расход этилена составляет 22000 м3/ч. Определить объем катализатора, необходимый для проведения процесса.
Решение. Объем катализатора:
22 000 : 1900 = 11,6 м3
Пример 8.
Производительность реактора окисления метанола составляет 3500 кг формалина в час; массовая доля формальдегида в нем равна 37%. Диаметр сечения аппарата 1,4 м, высота слоя контактной массы 75 мм. Определить производительность 1 кг и 1 л контактной массы. Насыпная плотность катализатора равна 300 кг/к3.
Решение. Производительность реактора по целевому продукту — формальдегиду:
3500·0,37 = 1295 кг/ч
Объем катализатора
в реакторе

0,785 (1,4)2 *0,075 = 0,115 м3 или 115 л
Производительность 1 л катализатора:
1295 : 115 = 11,3 кг/(л·ч)
Масса катализатора в реакторе:
0,115·600 = 69 кг
Производительность 1 кг катализатора:
1295:69=18,8 кг/(кг·ч)
ТЕПЛОВЫЕ РАСЧЕТЫ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Пример 9.
Производительность реактора газофазной гидратации ацетилена равна 35000кг ацетальдегида в час. Определить тепловой эффект реакции и массовый расход водного конденсата, даваемого в межтрубное пространство реактора для снятия выделяющегося тепла за счет испарения воды. Теплота парообразования воды равна 2262 кДж/кг. Теплоты образования реагентов и продуктов реакции: для ацетилена — 226,75 кДж/моль, для воды 241,84 кДж/моль, для ацетальдегида 166,0 кДж/моль.
Решение. Уравнение реакции:
СН СН
+ Н20→СН3–СНО
+ Q
СН
+ Н20→СН3–СНО
+ Q
Тепловой эффект реакции:
—∆Н°298 = 166- (-226,75+ 241,84) = 150,9 кДж/моль
Количество выделяющейся теплоты в расчете на секундную производительность реактора (тепловой поток):
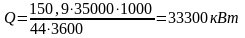
Массовый расход водного конденсата:
33300 : 2262 = 14,7 кг/с или 14,7·3600 = 52920 кг/ч
