
- •Гетерогенный катализ
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •Ионное произведение воды
- •Вывод значения ионного произведения воды
- •Практическое значение ионного произведения воды
- •Ионные произведения других растворителей
- •Водородный показатель
- •Ионные произведения других растворителей
- •Водородный показатель
- •Общая характеристика физико-химических методов
- •Потенциометрический метод.
По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.
Порядок протекания электролиза.
Существует эмпирическое правило, согласно которому в первую очередь на аноде разряжаются анионы бескислородных кислот (кроме F-), затем вода, и только потом – анионы кислородосодержащих кислот.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциалы других веществ или ионов, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металл или другого проводника, используемого в качестве анода, имеет более положительное значение, то идет электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют Au и платиновые металлы, PbO2, RuO4, С графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например Ni и Fe в щелочном растворе, Pb в H2SO4, Ti, Ta, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
Теперь уточним последовательность электродных процессов на катоде. Все окислители, которые восстанавливаются на К(-) можно разделить на три группы:
1.Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода (-0,41В, pH=7). В таких водных растворах на катоде выделяется только водород. Металлы могут быть получены только электролизом расплавов.
2.Ионы металлов, потенциалы которых более положительны, чем потенциал водородного электрода ( Cu2+, Hg2+, Ag+, Au3+). При наличии этих ионов в растворе они разряжаются в первую очередь, т. е. на К(-) выделяется металл и разряд ионов H+ не происходит.
3.ионы, потенциал которых мало отличается от потенциала водородного электрода – Cd2+,
Co2+, Ni2+ ( с учетом изменения Е0Н2/Н+вследствие различного pH солей этих металлов). В таких случаях на катоде протекают два параллельных процесса: выделение металла и
выделение водорода.
Т. о., под действием электрического тока на электродах происходят процессы, называемые электролизом. Последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
38.
Ионные произведения других растворителей
Ионное произведение можно рассчитать не только для воды. Ионное произведение воды является лишь одной (хотя практически наиболее важной) из констант автопротолиза.
Водородный показатель
Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с
vk.com/id446425943
vk.com/club152685050

обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.
Порядок протекания электролиза.
Существует эмпирическое правило, согласно которому в первую очередь на аноде разряжаются анионы бескислородных кислот (кроме F-), затем вода, и только потом – анионы кислородосодержащих кислот.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциалы других веществ или ионов, присутствующих в растворе, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металл или другого проводника, используемого в качестве анода, имеет более положительное значение, то идет электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют Au и платиновые металлы, PbO2, RuO4, С графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например Ni и Fe в щелочном растворе, Pb в H2SO4, Ti, Ta, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
Теперь уточним последовательность электродных процессов на катоде. Все окислители, которые восстанавливаются на К(-) можно разделить на три группы:
1.Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода (-0,41В, pH=7). В таких водных растворах на катоде выделяется только водород. Металлы могут быть получены только электролизом расплавов.
2.Ионы металлов, потенциалы которых более положительны, чем потенциал водородного электрода ( Cu2+, Hg2+, Ag+, Au3+). При наличии этих ионов в растворе они разряжаются в первую очередь, т. е. на К(-) выделяется металл и разряд ионов H+ не происходит.
3.ионы, потенциал которых мало отличается от потенциала водородного электрода – Cd2+,
Co2+, Ni2+ ( с учетом изменения Е0Н2/Н+вследствие различного pH солей этих металлов). В таких случаях на катоде протекают два параллельных процесса: выделение металла и
выделение водорода.
Т. о., под действием электрического тока на электродах происходят процессы, называемые электролизом. Последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
39.
vk.com/id446425943
vk.com/club152685050

Подобные соли легче других подвергаются гидролизу, так как ионы этих солей одновременно связываются обоими ионами воды с образованием двух слабых электролитов.
Реакция среды в растворах таких солей зависит от относительной силы кислоты и основания, т.е. водные растворы таких солей могут иметь нейтральную, кислую, или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Гидролиз ацетата аммония CH3COONH4
Соль CH3COONH4 образованна слабым основанием NH4OH и слабой кислотой CH3COOH одинаковой силы. (Кдис.NH4OH =1.8∙10-5; Кдис.CH3COOH =1.8∙10-5).
Реакция гидролиза в молекулярной форме:
CH3COONH4 +H2O NH4OH + CH3COOH
в ионно-молекулярной форме:
NH4+ + CH3COO– + H2O NH4OH + CH3COOH.
Поскольку концентрация ацетат-ионов и ионов аммония в растворе одинаковы, а константы диссоциации кислоты и основания равны, то реакция среды будет нейтральной (рН=7).
В результате реакции гидролиза цианида аммония NH4CN (Кдис.HCN =7.2∙10-10; Кдис.NH4OH =1.8∙10-5)
NH4CN +H2O NH4OH + HCN
среда будет слабощелочной (рН>7).
40.
В электрохимии широко используется понятие электродный потенциал. Электродный потенциал возникает на поверхности раздела - электрод - раствор при погружении металла (Me) в воду или раствор, содержащий ионы данного металла (Mez+). На границе металл - раствор устанавливается равновесие Me ↔Mez++ Ze,которое обусловливает образование двойного электрического слоя.
Наличие двойного электрического слоя приводит к возникновениюразности потенциалов между металлом и раствором, которую
принято называть электродным потенциалом металла и обозначать
φМеz+/Mе. Измеряется потенциал в вольтах (В). Электрод принято изображать в виде схемы:
Me|Mez+,где вертикальная черта обозначает поверхность раздела металл -раствор.
Если металл опущен в раствор собственной соли с концентрацией катионов металла, равной 1 моль/л при температуре
vk.com/id446425943
vk.com/club152685050
298 К (25 °С), то возникающий потенциал называют стандартным и обозначают φМеz+/Mе. Непосредственно определить потенцииал отдельного электрода нельзя, его измеряют путем сравнения спотенциалом эталонного электрода. Чаще всего для этой цели используют стандартный водородный электрод, который схематически изображается так: Pt, H2 | 2H+. Платина не участвует в окислительновосстановительной реакции и выполняет роль проводника электронов. На границе раздела фаз в водородном электроде устанавливается равновесие:
Н2↔2Н++2e.
Величину потенциала такого электрода принимают за ноль (при всех температурах) и называют стандартным потенциалом водородного электрода φ0H+/H2 = 0.Располагая металлы в порядке возрастания значений их стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов: Li, К, Ва, Sr, Са, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Sb, Bi, Cu, Hg, Ag, Pt, Au.
Числовые значения стандартных потенциалов металлов приведены в таблицах, имеющихся в учебник?" по общей химии. Ряд напряжений характеризует химические свойства металлов: чем меньше алгебраическое значение φ0Меz+/Mе, тем сильнее выражены
восстановительные свойства металлов, т.е. легче окисляются (отдают электроны) и труднее восстанавливаются из своих ионов.
Величина электродного потенциала металла φМе z+/Mе зависит от
величины φ0Меz+/Mе концентрации его ионов в растворе, СMеz+, температуры Т и выражается уравнением Нернста: 
где R - газовая постоянная равная 8,3 Дж/(моль*К); F - число Фарадея.
Уравнение Нернста при Т = 298 К принимает вид: 
41.
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, при которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй ‒ наоборот, химическая ‒ в электрическую.
Примерами процессов обоих типов могут быть процессы, происходящие в аккумуляторах. Так, при работе свинцового аккумулятора генератора электрической энергии происходит реакция:
Рb + РbO2 + 4Н+ + 2SO42- → РbSO4 + 2Н2O.
Вследствие этой реакции освобождается энергия, которая и превращается в электрическую. Когда аккумулятор разрядится, его заряжают, пропуская через него электрический ток в обратном направлении.
В обратном направлении протекает и химическая реакция: 2РbSO4 + 2Н2O → Рb + РbO2 + 4Н+ + 2SO42-.
vk.com/id446425943
vk.com/club152685050

В этом случае электрическая энергия превратилась в химическую. Теперь аккумулятор снова имеет запас энергии и снова может разряжаться.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках, как мы знаем, ток переносят электроны, в растворе электролитов ‒ ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит На одном электроде происходит процесс приема электронов ‒ восстановление, на втором электроде - процесс отдачи электронов, т.е. окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
Если погрузить металлическую пластинку (электрод) в раствор электролита, то между пластинкой и раствором возникает разность потенциалов, которая называется электродного потенциала.
Рассмотрим причины его возникновения. В узлах кристаллической решетки металла содержатся только положительно заряженные ионы. Благодаря их взаимодействию с полярными молекулами растворителя, они отрываются от кристалла и переходят в раствор. Вследствие такого перехода в металлической пластинке остается избыток электронов, отчего она приобретает отрицательный заряд. Положительно заряженные ионы, которые перешли в раствор благодаря электростатическому притяжению, остаются непосредственно у поверхности металлического электрода. Образуется двойной электрический слой. Между электродом и раствором возникает скачок потенциала, который и называется электродным потенциалом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
 , где
, где
 — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
 — абсолютная температура;
— абсолютная температура;
 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
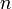 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
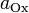 и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант  и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим
42.
vk.com/id446425943
vk.com/club152685050
Растворимость одного вещества в другом – свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда осуществляется переход веществ через поверхность их контакта.
Любой металл растворяется в воде, однако растворимость металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и образуется раствор гидроксида.
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает область химической науки – электрохимия.
Ниже мы поговорим об особой группе электрохимических реакций, протекающих на границе раздела фаз, в частности металл–вода (или раствор соли металла). Эти реакции характеризуются переносом заряда (электронов) и вещества через границу раздела фаз твердое вещество–жидкость.
Вы знаете, что металл проводит ток благодаря тому, что в его кристаллической решетке есть свободные (точнее, слабо связанные с атомами) электроны. А это означает, что в кристаллической решетке имеется некоторое количество положительно заряженных ионов металла.
Если металлическую пластинку, например медную, погрузить в воду или раствор соли меди, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu2+ начнут переходить в воду. Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, т.е. процесс растворения металла прекращается. Подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле. На рис. 8.5 ион металла для простоты изображен негидратированным.
При контакте металла с водой или раствором соли металла жидкая и кристаллическая фазы приобретают на границе раздела противоположные заряды, в результате чего на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия. На рис. 8.5 двойной электрический слой изображен в виде двух плотных слоев электронов и катионов. В действительности каждый слой распространяется по обе стороны от места контакта металла с водой, и постепенно количество электронов и катионов в слоях понижается.
Равновесие между ионами раствора и металлом выражается уравнением
Cu2+ (р-р) + 2е = Сu (кр.).
vk.com/id446425943
vk.com/club152685050
В уравнении равновесия электрохимической реакции, принимаемые электроны обычно записывают в левой части уравнения, перед знаком равенства. Соблюдение этого правила крайне важно, т.к. по таким уравнениям можно предсказывать направление электродных процессов.
Посмотрите на написанное уравнение – это уравнение окислительновостановительной реакции! Поэтому все, что вы знаете об окислительновосстановительных реакциях, следует использовать и для этих реакций.
Система, состоящая из проводника электрического тока и раствора (или расплава) электролита, в который погружен проводник, называется электродом. Так, медная пластинка, погруженная в водный раствор сульфата меди CuSО4, – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл–электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно сравнить с потенциалами других электродов (при стандартных условиях).
На медном электроде (медь–раствор с концентрацией ионов Cu2+, равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом, равным 0,34. В:
Cu2+ + 2e = Cu , E = 0,34 В.
Положительное значение потенциала этой электродной реакции означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), т.е. ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Хотя, разумеется, знак заряда электрода не зависит от способа написания уравнения электродного процесса, при его записи в противоположном направлении знак потенциала необходимо изменить на противоположный.
Стандартный потенциал цинкового электрода равен –0,76 В:
Zn2+ + 2e = Zn, E = –0,76 B.
Отрицательное значение электродного потенциала цинка свидетельствует о невозможности прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Zn – 2e = Zn2+, E = 0,76 B.
Уравнение этой реакции показывает, что цинк может «растворяться» в кислотах, или, более правильно, цинк реагирует с ионами водорода и образуются ионы цинка и газообразный водород.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т.е. в порядке возрастания их электродных потенциалов, то получится ряд стандартных электродных потенциалов.
Чем более отрицателен (менее положителен) электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель. Металлический литий – самый сильный восстановитель среди
vk.com/id446425943
vk.com/club152685050

металлов, а металлическое золото в данном перечне уравнений реакций – самый слабый восстановитель.
Все металлы, расположенные в этом списке выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в растворах кислот с концентрацией ионов водорода 1 моль/л. Если электродный потенциал металла имеет положительный знак, то металл
не растворяется в растворах кислот с  = 1 моль/л.
= 1 моль/л.
Эти правила можно не запоминать, лучше запомнить общий подход (уже вам известный) к определению направления окислительно-восстановительной реакции в гальваническом элементе.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
43.
Для водных растворов в качестве электрода сравнения принят
стандартный водородный электрод, представляющий собой платинированную пластину, погруженную в 1 М раствор кислоты, через который пропущен газообразный водород при соблюдении условий стандартности:
аH+ = 1 н; РН2 = 1,013·105 Па = 1 атм; t = 25 °C.
Потенциал водородного электрода определяется равновесием электродной реакции
Н2 – 2е = Н+
и рассчитывается по уравнению Нернста:
E2H+/H2 |
(3) |
vk.com/id446425943
vk.com/club152685050
При выполнении стандартных условий второе слагаемое обращается в нуль и тогда
E2H+/H2 = E0 2H+/H2=0
Стандартный потенциал , согласно международному соглашению, принят равным нулю и за точку отсчета потенциалов всех электродов, имеющих табличные значения. Схематически водородный электрод может быть представлен следующим образом:
Рtо, Н2(газ) | Н+ ||…,
где одна вертикальная черта отделяет твердую и газообразную фазы от жидкой, а две вертикальные черты – от второго электрода.
При условии, если РН2 = 1 атм, аH+ ≠1 моль/л, т. е. водородный электрод не является стандартным, уравнение (3) упрощается:
E2H+/H2 =0,059lg = - 0,059рН.
= - 0,059рН.
ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода, является электродным потенциалом на водородной шкале.
Абсолютное значение электродного потенциала непосредственно определить нельзя. Можно измерить лишь разность потенциалов, возникающую между двумя электродами, образующими замкнутую электрическую цепь:
Е = Е2– Е1
В связи с этим для практических целей применяют условную величину, характеризующую потенциал электрода относительно другого электрода взятого за стандарт (электрод сравнения). При этом потенциал электрода сравнения принимают равным 0. Тогда потенциал определяемого электрода будет равен
измеренной Е (если Е определяемого электрода > Е электрода сравнения) или – Е
(если Е определяемого электрода < Е электрода сравнения).
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят равным нулю.
одородный электрод представляет собой специально обработанную платиновую пластинку, которая опущена в раствор кислоты (H2SO4илиHCl) с активностью ионов Н+в нём равной 1 моль/дм3. Через раствор с постоянной скоростью про-
. Водородный электрод: 1 – раствор Н2SO4; 2 – платиновая пластинка с проводом; 3 – сифон для соединения с другим электродом
пускается газообразный Н2под давлением 101,325 кПа. Молекулы Н2, адсорбируясь на поверхности платины, частично диссоциируют с образованием ионов Н+:
Н2 2Н++ 2ē,
которые могут обмениваться с аналогичными ионами, находящимися в растворе кислоты.
vk.com/id446425943
vk.com/club152685050
Таким образом водородный электрод подобен металлическому электроду первого рода. Его потенциал будет зависеть от концентрации ионов Н+в растворе кислоты.
Разность потенциалов, между металлом, погруженным в раствор своей соли с активностью ионов Men+ в нём равной 1 моль/дм3 и стандартным водородным электродом, измеренная при 298 K, называется стандартным или нормальным электродным потенциалом металла (Е0).
44.
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, при которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй ‒ наоборот, химическая ‒ в электрическую.
Примерами процессов обоих типов могут быть процессы, происходящиев аккумуляторах. Так, при работе свинцового аккумулятора генератора электрической энергии происходит реакция:
Рb + РbO2 + 4Н+ + 2SO42- → РbSO4 + 2Н2O.
Вследствие этой реакции освобождается энергия, которая и превращается в электрическую. Когда аккумулятор разрядится, его заряжают, пропуская через него электрический ток в обратном направлении.
Вобратном направлении протекает и химическая реакция: 2РbSO4 + 2Н2O → Рb + РbO2 + 4Н+ + 2SO42-.
Вэтом случае электрическая энергия превратилась в химическую. Теперь аккумулятор снова имеет запас энергии и снова может разряжаться.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках, как мы знаем, ток переносят электроны, в растворе электролитов ‒ ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит На одном электроде происходит процесс приема электронов ‒ восстановление, на втором электроде - процесс отдачи электронов, т.е. окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
Если погрузить металлическую пластинку (электрод) в раствор электролита, то между пластинкой и раствором возникает разность потенциалов, которая называется электродного потенциала.
Рассмотрим причины его возникновения. В узлах кристаллической решетки металла содержатся только положительно заряженные ионы. Благодаря их взаимодействию с полярными молекулами растворителя, они отрываются от кристалла и переходят в раствор. Вследствие такого перехода в металлической пластинке остается избыток электронов, отчего она приобретает отрицательный заряд. Положительно заряженные ионы, которые перешли в раствор благодаря электростатическому притяжению, остаются непосредственно у поверхности металлического электрода. Образуется двойной
vk.com/id446425943
vk.com/club152685050
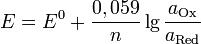
электрический слой. Между электродом и раствором возникает скачок потенциала, который и называется электродным потенциалом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
 , где
, где
 — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
 — абсолютная температура;
— абсолютная температура;
 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
 и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант  и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 
45.
Гальванические элементы – химические источники электрической энергии. Они представляют собой системы, состоящие из двух электродов (проводниковIрода), погруженных в растворы электролитов (проводниковIIрода).
Электрическая энергия в гальванических элементах получается за счет окислительновосстановительного процесса при условии раздельного проведения реакции окисления на одном электроде и реакции восстановления на другом. Например, при погружении цинка в раствор сульфата меди цинк окисляется, а медь восстанавливается
Zn + CuSO4 = Cu + ZnSO4
Zn0+Cu2+=Cu0 +Zn2+
Можно провести эту реакцию так, чтобы процессы окисления и восстановления были пространственно разделены; тогда переход электронов от восстановителя к окислителю будет происходить не непосредственно, а через электрическую цепь. На рис. 2 представлена схема гальванического элемента Даниэля-Якоби, электроды погружены в растворы солей и находятся в состоянии электрического равновесия с растворами. Цинк, как более активный металл, посылает в раствор больше ионов, чем медь, в результате чего цинковый электрод за счет остающихся на нем электронов заряжается более отрицательно, чем медный. Растворы разделены перегородкой, проницаемой только для ионов, находящихся в электрическом поле. Если электроды соединить между собой проводником (медной проволокой), то электроны с цинкового электрода, где их больше, будут по внешней цепи перетекать на медный. Возникает непрерывный поток электронов
vk.com/id446425943
vk.com/club152685050
- электрический ток. В результате ухода электронов с цинкового электрода Znцинк начинает переходить в раствор в виде ионов, восполняя убыль электронов и стремясь тем самым восстановить равновесие.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
При работе медно-цинкового элемента протекают следующие процессы:
1)анодный – процесс окисления цинка Zn0– 2e→Zn2+;
2)катодный – процесс восстановления ионов меди Cu2++ 2e→Cu0;
3)движение электронов по внешней цепи;
4)движение ионов в растворе.
46.
Коррозия (от латинского corrodo) — это разрушение конструкций и изделий из металлических материалов (металлов и сплавов), происходящее вследствие их физико– химического взаимодействия с окружающей средой, которую называют коррозионной (или агрессивной), а образовавшиеся химические соединения
— продуктами коррозии.
Коррозия сопровождается выделением энергии (процессы коррозии протекают самопроизвольно и сопровождаются убылью энергии Гиббса (∆ G < 0) и рассеиваем продуктов коррозии в окружающей среде. Процесс коррозии железа и его сплавов называют ржавлением.
Коррозионные среды бывают жидкими и газообразными, токопроводящими и неэлектролитами, естественными и искусственно созданными.
К газообразным относятся природная атмосфера и газы, образующиеся при сгорании топлива или выделяющиеся в различных химических производствах.
Жидкие — это жидкости-электролиты (водные растворы солей, кислот, щелочей, морская вода) и жидкости неэлектролиты (сернистая нефть, бензин, керосин и др.).
Естественными, кроме атмосферы, являются вода и почва, искусственными — многие химические вещества.
Химическая коррозия характерна для сред, преимущественно не проводящих электрический ток (иключение: опыт №1 из лабораторной работы — там химическая коррозия протекает в растворе HCl). В зависимости от вида этих сред различают:
1.Химическую коррозию в жидкостях-неэлектролитах — неэлектропроводных жидких средах, обычно органического происхождения (сернистая нефть, керосин, бензол);
2.Химическую газовую коррозию (в дальнейшем газовую), протекающую обычно при высоких температурах.
vk.com/id446425943
vk.com/club152685050
Эти два вида химической коррозии не сопровождаются возникновением электрического тока, т.е. представляют собой обычное окислительно-восстановительное (химическое) взаимодействие металла с окружающей средой.
Газовая коррозия является наиболее часто встречающимся видом химической коррозии и обычно протекает при высоких температурах в газах и парах агрессивных веществ, когда исключена возможность их конденсации на поверхности металла, поэтому ее называют высокотемпературной коррозией. Это коррозия сопел ракетных двигателей, лопаток газовых турбин, элементов электронагревателей и др. К газовым коррозионным агентам относятся О2, СО2, SO2, H2O, H2S, Cl2. Их агрессивность по отношению к различным металлам не является одинаковой, следовательно, и скорость коррозии различается.
Рассмотрим пример наиболее часто встречающейся на практике газовой коррозии:
— коррозия железа, чугуна и сталей в атмосфере О2,, СО2, и H2O:
При нагревании этих материалов происходит их окисление:
Fe + H2O → FeO + H2
Fe + CO2 → FeO + CO
2Fe + O2 → 2FeO
Состав продуктов окисления определяется главным образом температурой газовой коррозионной среды.
Наряду с окислением, в сталях и чугуне протекает процесс обезуглероживания — обеднения поверхностного слоя углеродом вследствие взаимодействия карбида железа, содержащегося в них, с кислородом и кислородсодержащими реагентами:
Fe3C + O2 → 3Fe + CO2
Fe3C + CO2 → 3Fe + 2CO
Fe3C + H2O → 3Fe + CO + H2
При этом ухудшаются их механические и антикоррозионные свойства.
Обезуглероживание может происходить и в атмосфере водорода:
Fe3C + 2H2 → 3Fe + CН4 ↑
Этот вид газовой коррозии называют водородной. Наряду с обезуглероживанием одновременно осуществляется и наводороживание — проникновение атомарного водорода в материал и последующее его растворение в нем, что ведет к резкому снижению пластичности металла.
Электрохимическая коррозия: причины и механизм возникновения.
vk.com/id446425943
vk.com/club152685050
На практике чаще всего приходится иметь дело с электрохимической коррозией. Она, в отличие от химической, сопровождается возникновением электрического тока и протекает, как правило, в средах с хорошей ионной проводимостью.
По условиям осуществления различают:
—коррозию в электролитах;
—атмосферную коррозию;
—электрокоррозию;
—коррозию под напряжением и др.
Причинами возникновения электрохимической коррозии служат различные виды неоднородностей как самой поверхности металла или сплава, так и коррозионной среды.
Врезультате вся поверхность, соприкасающаяся с токопроводящей коррозионной средой, разделяется на катодные и анодные участки, которые имеют очень малые размеры и чередуются друг с другом. В такой среде они представляют собой совокупность огромного числа короткозамкнутых коррозионных гальванических элементов, вследствие чего электрохимическую коррозию часто называют гальванической коррозией.
ВСИСТЕМАХ ВОЗМОЖНО ВОЗНИКНОВЕНИЕ КОРРОЗИОННЫХ НЕ ТОЛЬКО МИКРО-, НО И МАКРОЭЛЕМЕНТОВ, НАПРИМЕР, ПРИ КОНТАКТЕ С ЭЛЕКТРОЛИТОМ ДВУХ СОПРИКАСАЮЩИХСЯ ДЕТАЛЕЙ, ИЗГОТОВЛЕННЫХ ИЗ МЕТАЛЛОВ РАЗЛИЧНОЙ АКТИВНОСТИ (ТАК НАЗЫВАЕТАЯ КОНТАКТНАЯ
КОРРОЗИЯ).
Механизм электрохимической коррозии сводится к возникновению и функционированию коррозионных гальванических макро- и микро-элементов., поэтому ее процессы аналогичны процессам, протекающим в химических источниках тока: гальванических и топливных элементах, аккумуляторах. Основное отличие коррозионных процессов — отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а перемещаются внутри него от анодных участков к катодным.
Процесс электрохимической коррозии представляет собой совокупность двух взаимосвязанных полуреакций., одновременно протекающих на поверхности металла:
а) анодной, сопровождающейся окислением атомов металла на анодных участках поверхности:
(–) А: Ме – ne → Меn+
б) катодной, сопровождающейся восстановлением окислителя (окисленной формы компонента Оф) коррозионной среды (электролита) на катодных участках поверхности:
(+) К: Оф + ne → Вф
Окислители электрохимической коррозии называют деполяризаторами. К наиболее часто встречающимся деполяризаторам относятся молекулы О2, Н2О и ионы водорода Н+. Основными катодными реакциями с их участием при электрохимической коррозии являются:
vk.com/id446425943
vk.com/club152685050
1. в аэрированных (насыщенных кислородом) коррозионных средах:
нейтральных и щелочных (рН ≥ 7)
(+)К: О2 + 2Н2О + 4е → 4ОН– (φ0 = 0,401 В); в кислотных (рН < 7)
(+)К: О2 + 4Н+ + 4е→ 2Н2О (φ0 = 1,229 В);
2. в деарированных (несодержащих растворенный кислород) коррозионных средах:
нейтральных и щелочных (рН ≥ 7)
(+)К: 2Н2О + 2е → Н2 ↑ + 2ОН– (φ0 = –0,828 В); в кислотных (рН < 7)
(+)К: 2Н+ + 2е→ Н2 (φ0 = 0 В);
47.
Для борьбы с коррозией принимают самые разнообразные методы, учитывающие особенности не только самого металла, но и условия эксплуатации металлического изделия. В большинстве случаев можно подобрать тот или иной конструкционный материал для его эксплуатации в коррозионных средах. Когда этот выбор сделать нельзя, приходится защищать металл от коррозии. Выбор того или иного способа защиты определяется его эффективностью и экономической целесообразностью.
Все используемые в практике меры по защите металлов от коррозии можно разделить на несколько групп:
1.Повышение коррозионной стойкости металлов и сплавов легированием. 2.Снижение агрессивности коррозионной среды.
3.Защита электрическим током (электрохимическая защита). 4.Нанесение защитных покрытий.
5.Комбинированные методы защиты и рациональное конструирование.
48.
сли взять пластину какого либо металла и опустить ее в воду, то ионы поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в жидкость. В результате такого перехода жидкость заряжается положительно, а металл отрицательно, поскольку на нем появляется избыток электронов. Накопление ионов металла в жидкости начинает тормозить растворение металла. Устанавливается подвижное равновесие
Ме0 + mН2О = Меn+×m H2O + ne-
vk.com/id446425943
vk.com/club152685050
Состояние равновесия зависит как от активности металла так и от концентрации его ионов в растворе. В случае активных металлов, стоящих в ряду напряжений до водорода, взаимодействие с полярными молекулами воды заканчивается отрывом от поверхности положительных ионов металла и переходом гидратировнных ионов в раствор (рис. б). Металл заряжается отрицательно. Процесс является окислением. По мере увеличения концентрации ионов у поверхности становится вероятным обратный процесс - восстановление ионов. Электростатическое притяжение между катионами в растворе и избыточными электронами на поверхности образует двойной электрический слой. Это приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов, или скачка потенциала. Разность потенциалов, возникающую между металлом и окружающей его водной средой, называют электродным потенциалом. При погружении металла в раствор соли этого
металла равновесие смещается. Повышение концентрации ионов данного металла в растворе облегчает процесс перехода ионов из раствора в металл. Металлы, ионы которых обладают значительной способностью к переходу в раствор, будут заряжаться и в таком растворе положительно, но в меньшей степени, чем в чистой воде.
Для неактивных металлов равновесная концентрация ионов металла в растворе очень мала. Если такой металл погрузить в раствор соли этого металла, то положительно заряженные ионы выделяются на металле с большей скоростью, чем происходит переход ионов из металла в раствор. Поверхность металла получит положительный заряд, а раствор отрицательный из-за избытка анионов соли. И в этом случае на границе металл - раствор возникает двойной электрический слой, следовательно, определенная разность потенциалов (рис. в). В рассмотренном случае электродный потенциал положительный.
Ряд напряжений характеризует некоторые свойства металлов:
1. Чем меньшее значение имеет электродный потенциал металла, тем он химически активнее, легче окисляется и труднее восстанавливается из своих ионов. Активные металлы в природе существуют только в виде соединений Na, K, ..., встречаются в природе, как в виде соединений, так и в свободном состоянии Cu, Ag, Hg; Au, Pt - только в свободном состоянии;
2.Металлы, имеющие более отрицательный электродный потенциал, чем магний, вытесняют водород из воды;
3.Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из растворов разбавленных кислот (анионы которых не проявляют окислительных свойств);
4.Каждый металл ряда, не разлагающий воду, вытесняет металлы, имеющие более положительные значения электродных потенциалов из растворов их солей;
5.Чем больше отличаются металлы значениями электродных потенциалов, тем большее значение э.д.с. будет иметь построенный из них гальванический элемент.
Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста
ЕМе = ЕоМе + RTln(aМеn+)/nF,
где ЕоМе – стандартный электродный потенциал металла, aMen+ – активность ионов металла в растворе. При стандартной температуре 25 оС, для разбавленных растворов
vk.com/id446425943
vk.com/club152685050
заменяя активность (а) концентрацией (с), натуральный логарифм десятичным и подставляя значения R , T и F, получим
ЕМе = ЕоМе + (0,059/n )lgс.
Например, для цинкового электрода, помещенного в раствор своей соли, концентрацию гидратированных ионов Zn2+× mH2O сокращенно обозначим Zn2+ , тогда
ЕZn = ЕоZn + (0,059/n) lg[ Zn2+].
Если [Zn2+]= 1 моль/дм3, то ЕZn = ЕоZn.
49.
Химическая идентификация
Химическая идентификация - это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ. Идентификация является целью качественного анализа. При идентификации обычно определяется комплекс свойств веществ: цвет, фазовое состояние, плотность, вязкость, температуры плавления, кипения и фазового перехода, растворимость, электродный потенциал, энергия ионизации и др.
Комплексные соединения. Внешние и внутренние сферы. Комплексный ион. Ионкомплексообразователь, лиганды (моно и полидентальные) координационные числа. Конфигурация комплексного иона в зависимости от величины координационного числа.
Соединения сложного состава, у которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды), называются комплексными соединениями.
По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки.
Центральный атом внутренней сферы комплексного соединения, вокруг которого группируются ионы или молекулы, называется комплексообразователем. Частицы, непосредственно связанные с комплексообразователем, называются лигандами. Число лигандов в комплексе называется координационным числом комплексообразователя. Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут разместиться лиганды. Координационные числа разных комплексообразователей имеют значения от 2 до 12. Чаще Других встречаются комплексные соединения с координационным числом, равным 4 или 6, затем 8 или 2.
Заряд комплекса численно равен суммарному заряду внешней сферы и противоположен ему по знаку. Различают катионные, анионные и нейтральные комплексы. Комплекс с положительным зарядом называют катионным, с отрицательным зарядом — анионным, с нулевым зарядом — нейтральным.
Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов.
vk.com/id446425943
vk.com/club152685050
