
- •Раздел I. Механика. Молекулярная физика. Термодинамика 16 глава 1. Законы динамики ньютона. Законы сохранения 16
- •Вопросы и задачи к главе I. 33 глава 2. Молекулярно-кинетическая теория газов
- •Глава 3. Применение первого начала термодинамики к процессам в идеальном газе 52
- •Глава 4. Реальные газы 74
- •Вопросы и задачи и вопросы к главе 4. 82 глава 5. Поверхностное натяжение жидкости 82
- •Вопросы и задачи к главе 5 102
- •Глава 6. Вязкость жидкости 103
- •Вопросы и задачи к главе 6 116
- •Глава 7. Твёрдые и жидкие кристаллы. Стеклообразное состояние вещества. Полимеры 117
- •Глава 8. Процессы переноса 127
- •Раздел II колебания и волны 135
- •Глава 1. Механические колебания 135
- •Вопросы и задачи к главе 1. 153
- •Глава 2. Механические волны 153
- •Вопросы задачи к главе 2. 158
- •Глава 3. Звук 159
- •Вопросы и задачи к главе 3. 167
- •Глава 4. Ультразвук. Его применение в медицине. Инфразвук
- •Вопросы задачи к главе 4 180
- •Глава 5. Электромагнитные колебания и волны 181
- •Вопросы задачи к главе 5 201 глава 6. Оптика 201
- •Вопросы задачи к главе 6 251
- •Раздел III. Атомная, ядерная и квантовая физика
- •Глава 1. Тепловое излучение тел 253
- •Глава 2. Рентгеновское излучение 261
- •Глава 3. Радиоактивность 272
- •Глава 4. Дозиметрия ионизирующих излучений 282
- •Раздел IV. Биофизика 337 глава1 молекулярная биофизика 337
- •Глава 2. Биологические мембраны. 358
- •Глава 3. Термодинамика биологических систем 386
- •Глава 4. Транспорт веществ через биологические мембраны
- •Глава 5. Биопотенциалы 416
- •Глава 6. Биофизика нервного импульса 427
- •Глава 7. Моделирование биологических процессов 446
- •Введение
- •Раздел I механика. Молекулярная физика. Термодинамика.
- •Глава 1 законы динамики ньютона. Законы сохранения.
- •1.1. Законы ньютона. Основные дифференциальные уравнения движения.
- •Здесь аx , аy , аz - проекции вектора ускорения на оси координат X , y и z;
- •1. 2. Законы сохранения импульса и энергии
- •. Задача о центральном ударе шаров: абсолютно упругом и абсолютно неупругом.
- •1.4 Физические основы центрифугирования
- •Глава 2. Молекулярно-кинетическая теория газов
- •2.1 Отличия молекулярной структуры газов, жидкостей и твёрдых тел. Характер молекулярного движения в различных состояниях вещества. Аморфные и кристаллические жидкости и твёрдые тела
- •Примечание 2
- •2.2 Основное уравнение молекулярно-кинетической теории газов. Средняя квадратическая скорость молекул газа.
- •2.3 Средняя кинетическая энергия поступательного движения молекул газа. Распределение энергии по степеням свободы. Внутренняя энергия идеального газа
- •2.4 Распределение Максвелла молекул идеального газа по абсолютным значениям их скоростей.
- •2.5 Распределение Больцмана по потенциальным энергиям молекул идеального газа. Барометрическая формула Больцмана.
- •Глава 3. Применение первого начала термодинамики к процессам в идеальном газе.
- •3.1. Особенности термодинамического метода. Первое начало термодинамики.
- •3.2. Применение первого начала термодинамики к равновесным изопроцессам идеального газа
- •Работа газа при его расширении
- •Теплоёмкость
- •Политропные процессы - процессы с постоянной теплоёмкостью.
- •Глава 4. Реальные газы
- •4.1.Уравнение состояния реального газа Ван - дер - Ваальса и изотермы Ван- дер - Ваальса.
- •4.2. Изотермы Эндрюса
- •Сжижение газов. Получение низких температур.
- •Глава 5. Поверхностное натяжение жидкости
- •5.3 Поверхностные явления на границе твёрдой, жидкой и газообразной фазы. Краевой угол смачивания. Смачивание и несмачивание твёрдой поверхности жидкостью.
- •5.4 Давление Лапласа. Капиллярные явления.
- •5.5 Методы определения коэффициента поверхностного натяжения
- •1. Метод отрыва капель
- •2. Метод отрыва кольца
- •Глава 6. Вязкость жидкости
- •6.1 Вязкость жидкости. Закон ньютона. Ньютоновские и неньютоновские жидкости. Реологические свойства биологических жидкостей в норме и при патологиях
- •6.2 Ламинарное течение жидкостей по цилиндрическим трубам с жёсткими стенками. Формула пуазейля. Закон гагена – пуазейля
- •1. Метод капиллярного вискозиметра (оствальда).
- •2. Метод падающего шарика (стокса)
- •Глава 7 твёрдые и жидкие кристаллы. Стеклообразное состояние вещества. Полимеры.
- •7.1. Фазовые переходы. Плавление, кристаллизация, сублимация.
- •7.2.Кинетические превращения. Стеклование и размягчение
- •7.3. Жидкие кристаллы
- •7.4. Кристаллические модификации твёрдых кристаллов.
- •7.5 Механические свойства твёрдых тел. Закон гука. Упругость и пластичность
- •7.6 Полимеры. Их кристаллическое, стеклообразное, высокоэластическое, вязкотекучее состояние.
- •Глава 8. Процессы переноса
- •8.1. Диффузия
- •8.2. Теплопроводность
- •8.3. Вязкость
- •8.5. Общий вид уравнений процессов переноса
- •Раздел II
- •Глава 1. Механические колебания
- •1.2. Свободные незатухающие механические колебания
- •1.3 Смещение, скорость и ускорение гармонически колеблющегося тела
- •1.4. Энергия гармонически колеблющегося тела
- •1.5. Свободные затухающие колебания
- •1.6 Вынужденные колебания. Резонанс
- •1.7. Автоколебания
- •1.8. Сложения гармонических колебаний, направленных по одной прямой. Теорема фурье. Гармонический спектр сложного колебания
- •Вопросы и задачи к главе 1
- •Глава 2. Механические волны
- •2.1 Механические волны, продольные и поперечные волны
- •2.2. Уравнение и график плоской незатухающей гармонической волны
- •2.3. Энергия волны. Поток энергии. Интенсивность.
- •Вопросы и задачи к главе 2
- •Глава 3. Звук
- •3.1. Субъективные (физиологические) характеритики восприятия звука и их связь с объективными, физическими характеристиками звуковой волны
- •3.2 Область слышимости
- •3.3. Закон вебера-фехнера
- •3.4. Уровень интенсивности
- •Уровень громкости, фон
- •Вопросы и задачи к главе 3
- •Глава 4. Ультразвук. Его применение в медицине инфразвук
- •4.1. Физические свойства ультразвука
- •1. Частотный диапазон ультразвука
- •2. Скорости распространения ультразвука
- •3. Особенности физических свойств ультразвука
- •4. Отражение ультразвука на границе раздела сред
- •5. Поглощение ультразвука
- •4.2 Действие ультразвука на вещество. Биологическое действие ультразвука
- •Механическое действие
- •2..Тепловое действие
- •3. Физико-химическое действие ультразвука
- •4. Биологическое действие ультразвука
- •1. Диагностика.
- •4.4.Источники и приёмники ультразвука
- •1. Пьезоэлектрические излучатели-приёмники
- •2. Магнитострикционные излучатели ультразвука
- •Инфразвук
- •Вопросы и задачи к главе 4
- •Глава 5. Электромагнитные колебания и волны
- •5.1. Некоторые необходимые сведения об основах электричества и магнетизма.
- •Электрические заряды
- •Закон кулона
- •Электроёмкость электрического конденсатора
- •6) Сила ампера -
- •8) Закон электромагнитной индукции фарадея
- •11)Энергия магнитного поля катушки индуктивности
- •5.3. Идеальный колебательный контур
- •5.4. Реальный колебательный контур
- •5.4. Получение незатухающих электромагнитных колебаний
- •5.5. Основные положения теории максвелла
- •Глава 6. Оптика
- •Корпускулярно – волновая природа света
- •6.2. Интерференция света
- •. Разрешающая способность оптических приборов-
- •. Голография
- •Поляризованный свет
- •Естественный и поляризованный свет.
- •2. Поляризатор и анализатор. Закон Малюса.
- •3. Поляризация света при отражении и преломлении. Закон Брюстера.
- •4. Двойное лучепреломление
- •Получение поляризованного света.
- •6. 11 Вращение плоскости поляризации. Оптическая активность. Поляриметрия.
- •Дисперсия света
- •Нормальная дисперсия
- •Качественное объяснение причины нормальной дисперсии
- •Аномальная дисперсия
- •Поглощение света
- •1.Закон Бугера - Ламберта
- •2. Закон Бера
- •Закон Бугера – Ламберта – Бера
- •Коэффициент пропускания и оптическая плотность. Колориметрия
- •2. Два вида рассеяния
- •3. Закон Рэлея
- •4.Турбидиметрия и нефелометрия.
- •6.14. Элементы геометрической оптики
- •Законы отражения и преломления света
- •Явления предельного преломления и полного внутреннего отражения
- •Волоконная оптика. Световоды
- •4.Линзы. Примеры построения изображений в тонких линзах
- •Микроскоп
- •Оптическая система глаза. Некоторые её недостатки, их исправление
- •Рефрактометр
- •Раздел III . Атомная, ядерная и квантовая физика
- •Глава 1. Тепловое излучение тел
- •Основные характеристики теплового излучения. Абсолютно чёрное тело
- •Закон кирхгофа
- •1.2 Спектр теплового излучения абсолютно чёрного тела.Закон вина. Закон стефана-больцмана.
- •1.3 Гипотеза планка. Формула планка
- •1.5. Примеры применения теплового излучения в фармации и медицине
- •Глава 2. Рентгеновское излучение
- •2.1 Простейшая рентгеновская трубка
- •2.2. Основные свойства рентгеновского излучения.
- •Рентгенодиагностика:
- •Рентгенотерапия.
- •Научные исследования.
- •2.4. Природа рентгеновского излучения
- •2.6 Характеристическое рентгеновское излучение
- •Глава 3. Радиоактивность
- •3.1. Радиоактивность. Виды радиоактивных излучений. Основные типы ядерных распадов.
- •3.2 Основной закон радиоактивного распада
- •3.3 Активность радиоактивных препаратов
- •3.4. Ядерные реакции. Меченые атомы
- •Глава 4. Дозиметрия ионизирующих излучений
- •2) Характеристическое рентгеновское излучение.
- •2) Характеристическое рентгеновское излучение.
- •Глава 5. Элементы квантовой механики.
- •5.1. Волновые свойства микрочастиц. Уравнение дё бройля
- •5.2. Электронный микроскоп
- •5.3. Основные положения квантовой механики
- •5.4. Решение уравнения шрёдингера для частицы в потенциальной яме с бесконечно высокими стенками
- •Глава 6. Люминесценция
- •6.1. Виды люминесценции
- •6.2. Фотолюминесценция. Флюоресценция. Фосфоресценция
- •6.3. Спектр фотолюминесценции. Правило стокса
- •6.4. Люминесцентный анализ. Применение в фармации и медицине
- •6.5. Хемилюминесценция
- •Глава 7. Лазер
- •7.1. Вынужденное излучение. Инверсная заселённость. Метастабильные уровни
- •7.3. Свойства лазерного излучения
- •7.4. Применение лазерного излучения в фармации и медицине
- •Глава 8. Оптическая спектроскопия. Ик- спектроскопия. Радиоспектроскопия.
- •8.1. Спектры испускания и спектры поглощения. Спектрографы. Спектрометры. Спектрофотометры
- •8.2. Атомарные спектры. Энергетические уровни атомов
- •8.3. Молекулярные спектры. Энергетические уровни молекул
- •8.4. Спектры комбинационного рассеяния
- •8.5. Радиоспектроскопия
- •Магнитные свойства вещества
- •Раздел IV. Биофизика
- •Глава 1. Молекулярная биофизика
- •Энтропийный характер упругости биополимеров в высокоэластическом состоянии.
- •1.4. Основные типы межатомных и межмолекулярных взаимодействий
- •1.Ионная связь
- •2.Ковалентная связь
- •3.Межатомное отталкивание
- •4. Донорно- акцепторная связь
- •5. Водородная связь
- •1. Ориентационная связь
- •3. Индукционная связь
- •3. Дисперсионная связь
- •4. Межмолекулярное отталкивание
- •5. Гидрофобные взаимодействия
- •Глава 2. Биологические мембраны
- •. Исследование структуры биологических мембран с помощью физических методов.
- •2.3. Жидкостно-мозаичная модель биомембран
- •2.4. Модельные липидные мембраны.
- •2.5. Физические свойства мембран и методы их исследования.
- •2.6. Физическое состояние и фазовые переходы фосфолипидного бислоя
- •Глава 3. Термодинамика биологических систем.
- •3.1 Применение первого начала термодинамики к биологическим системам. Прямая и непрямая калориметрия. Энергетический баланс организма.
- •3.2. Применение второго начала термодинамики к живым системам. Уравнение пригожина.
- •3.3 Сопряженные процессы. Сопряженные процессы созидания и разрушения
- •3.4 Стационарное состояние. Теорема пригожина. Аутостабилизация. Адаптация.
- •Глава 4. Транспорт веществ через биологические мембраны.
- •4.1 Пассивный и активный транспорт веществ
- •Глава 5. Биоэлектрические потенциалы
- •5.1Виды биопотенциалов. Их виды: покоя, действия. Природа биопотенциалов
- •5.2. Методы регистрации биопотенциалов. Микроэлектроды.
- •5.3 Биопотенциалы покоя. Уравнение Гольдмана, уравнение Нернста. Роль ионных насосов в создании биопотенциала покоя
- •Глава 6. Биофизика нервого импульса
- •6.1. Потенциал действия и его свойства
- •Уравнение Ходжкина-Хаксли
- •6.3.Метод фиксации мембранного потенциала. Ионные токи. Ионные каналы
- •Глава 7. Моделирование биофизических процессов
- •7.1 Моделирование биологических процессов. Моделирование физическое, аналоговое, математическое. Основные требования к моделям.
- •Математические модели роста популяции
- •7.3 Фармакокинетическая модель
2.4 Распределение Максвелла молекул идеального газа по абсолютным значениям их скоростей.
Абсолютное значение скорости молекулы идеального газа - случайная величина. С разной вероятностью она может принимать любые значения от 0 до :
0
.![]()
Получено методом статистической физики и подтверждено экспериментально, что число молекул в единице объема, скорость которых лежит в малом интервале значений ( , +d :
dn
(
= ![]()
![]() d
(2.17)
d
(2.17)
где m0 – масса одной молекулы,
k – константа Больцмана,
Т – абсолютная температура
А
= 
(
= ![]() = A
= A
![]() 2
(2.18)
2
(2.18)
( - функция распределения Максвелла (плотность вероятности).
На рис 2.5 представлен график функции распределения Максвелла по абсолютным скоростям при данной температуре Т.

Рис.2.5. График функции распределения Максвелла по абсолютным скоростям при данной температуре Т.
Вероятность малых и больших значений абсолютных значений скоростей молекул мала. Соответствующие математические расчеты дают, что наивероятнейшая скорость молекул:
в
=  =
= 
средняя скорость:
vв=
![]()
Средняя квадратичная скорость:
кв
= ![]() =
= ![]()
На рис 2.6 представлены графики функции распределения Максвелла по абсолютным скоростям при разных температурах.
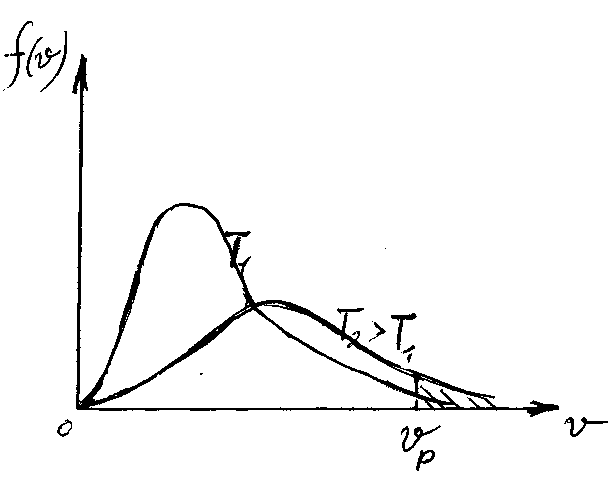
Рис. 2.6. Графики функции распределения Максвелла по абсолютным скоростям при разных температурах.
При повышении температуры увеличивается наивероятнейшее значение скорости - максимум графика смещается вправо. Одновременно кривая «расплывается», максимум понижается, так как площадь под кривой неизменна:

n – общее число молекул в единице объема остается постоянным.
При повышении температуры увеличивается число молекул с большими скоростями. Известно, что во многих случаях в химическую реакцию могут вступать только так называемые реакционноспособные молекулы, скорость которых больше некоторой скорости v vр.
Число реакционноспособных молекул в единице объема идеального газа равно заштрихованной площади под «хвостом» графика на рис. 2.6.
При повышении температуры увеличивается число реакционноспособных молекул и константа скорости химической реакции повышается. Этим объясняется, в частности, то обстоятельство, что природа держит нас, млекопитающих, почти на грани перегревания при температурах 37-40 С. При температурах всего на несколько градусов выше начинается денатурация белков. Зато это обеспечивает большое число реакционноспособных молекул, высокую скорость химических реакций в организме млекопитающих и как следствие их высокую жизненную активность. Однако это же ставит перед фармацевтическими науками задачу разработки жаропонижающих препаратов.
2.5 Распределение Больцмана по потенциальным энергиям молекул идеального газа. Барометрическая формула Больцмана.
Распределение Больцмана молекул идеального газа по потенциальным энергиям рассмотрим на примере частного случая, когда молекулы идеального газа насходятся в гравитационном поле у поверхности Земли. Считаем, что ускорение свободног падения g=const, так как рассматриваются высоты над поверхностью Земли h значительно меньшие радиуса Земли.
Как следует из выводов статистической физики и опыта, число частиц в единице объема n газа в этом случае зависит от высоты h по формуле:
n
= n0
![]() = n0
= n0
![]() (2.19)
(2.19)
Давление p = nkT (см. формулу 2.3)
p
= n0kT
![]()
или
p = p0 (2.20)
Формулы 2.19 и 2.20 называются барометрическими формулами Больцмана.
В формулах 2.19 и 2.20 n0 и p0 - число частиц в единице объема и давление у поверхности Земли (когда h = 0) соответственно.

Рис. 2.7. Графики распределения концентрации (а) и давления (б) молекул идеального газа для разных температур: 1 – Т1, 2 – Т2 > Т1.
Гравитационное поле Земли стремится перевести систему в состояние с минимумом потенциальной энергии Е пот min.
Поэтому при H = 0, Eпот. = mgh = 0
n = nmax = n0, р = pmax = p0.
Но хаотическое тепловое движение молекул газа стремится создать в системе максимальный беспорядок, состояние с максимальной энтропией Smax.
В борьбе этих двух противоположных тенденций:
Епот Еmin
S Smax
устанавливается равновесие.
При повышении температуры все более преобладает вторая тенденция (см. рис.2.8). Чем выше температура, тем меньше n0 и р0 и тем медленнее n и р уменьшаются с высотой.
Чем больше масса молекулы газа m0, тем больше число молекул в единице объема n0 и давление газа р0 у поверхности Земли и тем быстрее n и р уменьшаются с высотой h (см. рис. 2.9).

Рис. 2.8 Графики распределения концентрации (а) и давления (б) молекул идеального газа с разными молярными массами: 1 – М1, 2 – М2 > М1.
Поэтому тяжелый газы скапливаются у поверхности Земли, их концентрация с высотой уменьшается быстрее, чем легких.
Вопросы и задачи к главе 2.
Считая плотность иода = 9.102кг/м3 , оценить среднее расстояние между центрами молекул в кристаллике иода.
Найдите число молекул идеального газа в единице объема при давлении p = 105 Па и температуре t = 20 С. Оцените среднее расстояние между молекулами.
Найдите энергию активации перескока молекулы жидкости из одного положения равновесия в другое, считая период колебаний молекул около положения равновесия
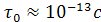 ,
а время осёдлой жизни
,
а время осёдлой жизни  при температуре 200
С.
при температуре 200
С.Найдите среднюю квадратическую скорость молекул азота, водорода, кислорода, углекислого газа и водяного пара при температуре 200 С.
Пользуясь математическими методами исследования функций на экстремум покажите, что наивероятнейшее значение абсолютной скорости молекулы идеального газа
 .
.Начертите графики распределений Максвелла и Больцмана для предельных случаев: T
 0
и T→
∞.
0
и T→
∞.Почему в больших городах, отравленных автомобильными выхлопами, больше, чем взрослые, страдают от вдыхания ядовитые тяжёлых газов маленькие дети?
Бриз это лёгкий прибрежный ветерок, поднимающийся перед закатом и после восхода солнца. Когда бриз дует с суши на воду, а когда с воды на сушу? Почему?
При восхождении высоко в горы иногда возникает горная болезнь одна из причин - понижение парциального давления углекислого газа. Почему парциальное давления углекислого газа понижается с высотой быстрее, нежели парциальные давления кислорода и азота.
