
7.1 Электродные потенциалы.
Химические процессы, которые сопровождаются возникновением электрического тока или, наоборот, сами вызывают их, называются электрохимическими.
Электрохимические свойства металлов. Основным химическим свойством металлов является способность их атомов отдавать свои валентные электроны. Поэтому, типичные металлы являются энергичными восстановителями. Однако, способность к отдаче электронов у металлов не одинакова. Чем легче металлы отдают электроны, тем они химически активнее.
Н.И. Бекетов на основании изучения реакций вытеснения одних металлов другими из растворов их солей расположил металлы в ряд по убывающей вытеснительной способности (прототип электрохимического ряда напряжений). Каждый металл этого ряда вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. Только те металлы, которые стоят перед водородом, могут вытеснять его из кислот. Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительные свойства, тем легче он сам превращается в ион, но тем труднее восстановить его ионы.
Металлы
имеют кристаллическое строение; В узлах
кристаллической решетки металла
находятся катионы металлов, между
которыми перемещаются валентные
электроны, т.е. существует динамическое
равновесие:

При
погружении металла в воду, диполи воды
взаимодействуют с ионами металла. Ион
металла в растворе гидратируется.
Металлическая пластинка за счет избытка
электронов начинает притягивать ионы.
Однако, гидратированному иону труднее
вернуться на поверхность металла. В
результате в системе устанавливается
подвижное равновесие:
 +n
+n
На границе металл - вода возникает система, напоминающая плоскопараллельный конденсатор и носящая название двойного электрического слоя. Металл, погруженный в раствор электролита, называется электродом. Разность потенциалов, возникающая на границе металл-раствор, между обкладками в двойном электрическом слое, называется электродным потенциалом. Если металл опустить не в воду, а в раствор своей соли, то нарушается равновесие в двойном электрическом слое (сдвиг равновесия влево) и изменится скачок потенциала.
Водородный
электрод. Потенциалы
электродов измерить непосредственно
невозможно. Поэтому их измеряют
относительно другого электрода, потенциал
которого условно принят за нуль. В
качестве электрода сравнения
используют водородный электрод. Он
состоит из платиновой пластины,
покрытой платиновой чернью (адсорбирующей
газообразный водород), погруженной
в раствор серной кислоты, с активностью
ионов
водорода, равной 1. Между платиной и
раствором кислоты возникает скачок
потенциала. Равновесие на водородном
электроде можно представить в виде .
Потенциал водородного электрода
условно считают равным нулю.
.
Потенциал водородного электрода
условно считают равным нулю.
Для определения электродных потенциалов собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым - стандартный водородный электрод; измерение проводят компенсационным методом.
Электродный потенциал, возникающий при погружении металла в раствор собственной соли с концентрацией 1 моль/л при температуре 25°С, измеренный по отношению к водородному электроду, называется стандартным электродным потенциалом. Для более точных измерений используются активности ионов.
В электрохимическом ряду напряжений металлы размещаются в соответствии с величинами стандартных электродных потенциалов. Чем меньше значение стандартного электродного потенциала, тем металл активнее. Электродные потенциалы зависят от природы металла, температуры и концентрации соли металла. Эта зависимость отражена в формуле Нернста:
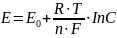
где Е - электродный потенциал при заданных условиях;
Е0 - стандартный электродный потенциал;
R
= 8,31 Дж/(моль К);
К);
Т - температура, К;
п - число электронов, участвующих в процессе;
F - число Фарадея;
С - концентрация катионов металла в растворе.
При подстановке всех констант получаем выражение:

