
Диаграмма Латимера для серы
а) в кислой среде:

б) в щелочной среде:
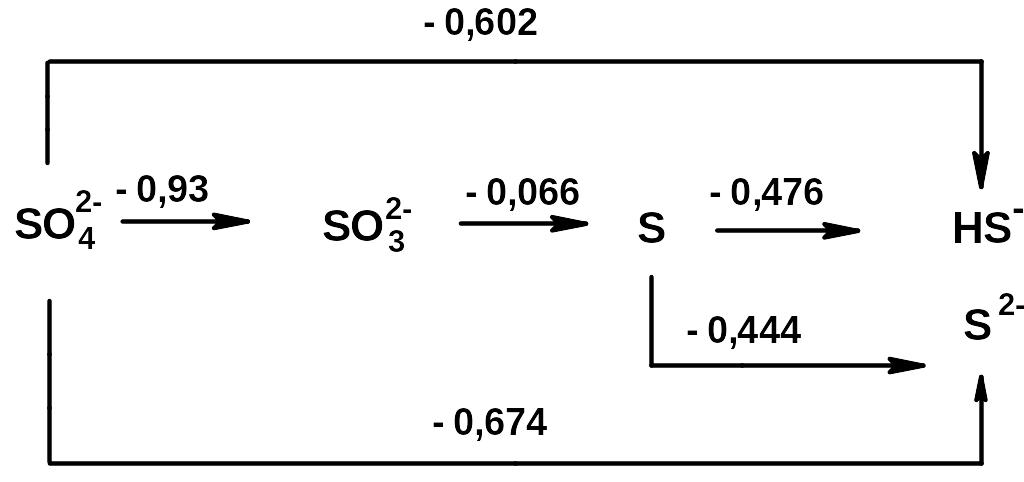
- Значения стандартных окислительно-восстановительных (электродных) потенциалов
φ(S/H2S) = +0,144 … …..φ(Se/H2Se) = - 0,115………. φ(Te/H2Te) = -0,464………
- окислительная активность халькогенов в ряду: (S Se Te) …………………:
- восстановительная активность халькогенидов в ряду: (S-2 Se-2 Te-2) ……………:
- Укажите, какие свойства в окислительно-восстановительных реакциях могут проявлять халькогеноводородные кислоты:
Все опыты проводить в вытяжном шкафу, так как все соединения серы ядовиты!
Опыт 1. Сероводород и его свойства
а) Получение сероводорода и его горение
Пробирку, на 1/3 наполненную мелкими кусочками сернистого железа, закрепить в штативе. Добавить в нее концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Быстро закрыть пробирку пробкой с отводной трубкой. Выделяющийся газ зажечь у конца отводной трубки. Над пламенем горящего газа подержать смоченную дистиллированной водой индикаторную бумажку.
- отметить, какие изменения происходят в пробирке
- выделяется газ -……..
- Составить уравнение реакции взаимодействия сульфида железа (II) с соляной кислотой (получения сероводорода)
FeS + HCl → …..…… + ……
- Составить уравнение реакции горения сероводорода
H2S + O2 → …..…… + ……
- Указать окислитель ………………..и восстановитель………….
б) Растворение сероводорода в воде
В пробирку с сульфидом железа (II) добавить концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Закрыть пробирку пробкой с изогнутой трубкой. Выделяющийся сероводород направить в пробирку, наполненную дистиллированной водой. Добавить в полученную сероводородную воду индикатор.
- Отметить и объяснить изменение цвета индикатора, указав, что собой представляет водный раствор сероводорода.
- Написать уравнения диссоциации сероводородной кислоты по 1-ой и по 2-ой ступени
1 ст. H2S → …..…… + ……
2 ст. HS- → …..…… + ……
- Составьте выражения для констант диссоциации по 1-ой и по 2-ой ступени.
K1 = K2 =
- Выписать значения констант диссоциации из таблицы.
K1 = 1,05 10-7 K2 = 1,23 10-13
- Сделать вывод о свойствах сероводородной кислоты.
в) Восстановительные свойства сероводорода
В две пробирки внести растворы: в первую - 5 капель перманганата калия и 2 капли 2н. раствора серной кислоты, во вторую - 5 капель дихромата калия и 2 капли 2н. раствора серной кислоты. В каждую из пробирок добавлять по каплям сероводородную воду до изменения окраски растворов и помутнения вследствие выделения серы.
- отметить, какие изменения происходят в пробирках
- Составить уравнение реакции взаимодействия сероводорода с перманганатом калия, учитывая, что KMnO4 переходит - в сульфат марганца (II) и образуется сера
KMnO4 + H2S + H2SO4 → MnSO4 + …… + ……
- Указать окислитель ………………..и восстановитель………….
- Составить уравнение реакции взаимодействия с дихроматом калия, учитывая, что что K2Cr2O7 переходит в Cr(III) и образуется сера
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + …… + ……
- Указать окислитель ………………..и восстановитель………….
- Сделать вывод о свойствах сероводорода.
Опыт 2. Получение малорастворимых сульфидов
В первую пробирку внести 2 - 3 капли раствора сульфата марганца(II), во вторую пробирку - 2 - 3 капли раствора нитрата свинца(II). В каждый раствор добавить, по 2 - 3 капли сульфида аммония. Наблюдать выпадение осадков сульфида марганца(II) и сульфида свинца(II). К полученным осадкам прибавить по 2 - 3 капли 2н. раствора азотной кислоты.
- отметить, какие изменения происходят в пробирках. Указать цвет осадков
- Составить уравнения реакций получения сульфидов марганца(II) и свинца(II) в молекулярном и ионном виде.
MnSO4 + (NH4)2S →
Pb(NO3)2 + (NH4)2S →
- Указать, какой сульфид растворился……………
- Ответить, возможно, ли его образование в кислой среде…………..
- Составить уравнение реакции растворения MnS в кислоте в молекулярной и ионной форме
MnS + HNO3 →
- Пользуясь значениями (ПРMnS = 1,1 10-13) и констант диссоциации сероводородной кислоты рассчитать константу равновесия для процесса растворения и сульфида марганца(II) в кислоте
K = ПРMnS/ (K1H2S K2H2S) =
- Пользуясь значениями (ПРPbS, = 8,7 10-29) и констант диссоциации сероводородной кислоты рассчитать константу равновесия для процесса растворения и сульфида свинца(II) в кислоте
K = ПРPbS/ (K1H2S K2H2S) =
- Сделать вывод о направлении протекания указанных реакций.
В две другие пробирки с растворами солей марганца(II) и свинца(II) добавить по 3 - 4 капли сероводородной воды.
- отметить, какие изменения происходят в пробирках.
- Указать, какой сульфид образовался……………
- Составить уравнения реакций получения сульфида свинца(II) в молекулярном и ионном виде.
Pb(NO3)2 + H2S →
- Объяснить различные результаты действия H2S и (NН4)2S на соль марганца(II) и образование осадка PbS в обоих случаях.
Образование черного осадка PbS может служить реакцией обнаружения иона Pb2+ или сероводорода.
Опыт 3. Получение диоксида серы и его растворение в воде
В колбу поместить кристаллический сульфит натрия (Na2SO3), добавить 6-8 капель 4 н. раствора серной кислоты и быстро закрыть пробкой с отводной трубкой. Выделяющийся газ пропустить в пробирку с дистиллированной водой в течение 2-3 мин. Если выделение газа идет недостаточно энергично, пробирку осторожно подогреть. Проверить универсальным лакмусом рН раствора.
- отметить, какие изменения происходят в пробирках.
- выделяется газ…………….
- Окраска индикатора …………………, рН = ………..
- окраска индикатора указывает на………………… свойства водного раствора SO2
- Составить уравнение реакции получения оксида серы в молекулярном и ионном виде:
Na2SO3 + H2SO4
- Составить уравнение реакции растворения оксида серы в воде в молекулярном и ионном виде:
SO2 + H2O
- Написать уравнения диссоциации сернистой кислоты по 1-ой и по 2-ой ступени
1 ст. H2SO3 → …..…… + ……
2 ст. HSO3- → …..…… + ……
- Составьте выражения для констант диссоциации по 1-ой и по 2-ой ступени.
K1 = K2 =
- Выписать значения констант диссоциации из таблицы.
K1 = 1,6 10-2 K2 = 6,31 10-8
- Сделать вывод о свойствах сернистой кислоты.
Сохранить раствор SO2 для следующего опыта.
Опыт 4. Окислительные и восстановительные свойства соединений серы (IV)
а) Окислительные и восстановительные свойства SO2.
В две пробирки, одна из которых с сероводородной (а), другая с йодной водой (б) (по 3-5 капель), добавить по несколько капель водного раствора SO2.
- Отметить происходящие изменения в растворах.
- Составить уравнение реакции диоксида серы с сероводородной водой
H2S + SO2
- Указать окислитель………………….., восстановитель ………………….
- Составить уравнение реакции диоксида серы с йодной водой
I2 + SO2 + H2O
- Указать окислитель………………….., восстановитель ………………….
- указать, какие свойства проявляет диоксид серы.
Опыт 5. Дегидратирующие свойства серной кислоты
а) «Черная колонна» (демонстрационный).
В стаканчик объемом 100 мл поместить 10-15 гр сахарозы (С12Н22О11) или глюкозы (С6Н12О6), поместить стеклянную палочку длиной приблизительно 30 см. Прилить по палочке 10 мл 4н.серной кислоты, энергично перемешать палочкой, оставить палочку в стакане вертикально.
- Отметить происходящие изменения
- Составить уравнение реакции обугливания
С12Н22О11 + Н2SО4(конц) 12C + Н2SО4 11H2O
- Объяснить образование газа с резким запахом.
- Составить уравнение реакции.
С + H2SO4(конц)
- Вывод
Опыт 6. Взаимодействие серной кислоты с металлами
(см. лабораторные работы №5 – 10)
Опыт 7. Различная растворимость сульфита и сульфата бария в кислоте
В двух пробирках получить обменной реакцией сульфит и сульфат бария, для чего взять по 3-4 капли растворов соответствующих солей Na2SO3 или Na2SO4 и BaCl2. Наблюдать образование осадков в обеих пробирках. Сравнить растворимость сульфита и сульфата бария в кислоте, добавив в обе пробирки по 1-2 капли 2 н. соляной кислоты.
- Отметить происходящие изменения в пробирках
- Составить уравнение реакции получения сульфата бария в молекулярной и ионной форме
BaCl2 + Na2SO4 →
- Составить уравнение реакции получения сульфита бария в молекулярной и ионной форме
BaCl2 + Na2SO3 →
- Составить уравнение реакции растворения сульфита бария в кислоте в молекулярной и ионной форме
BaSO3 + HCl →
-Ответить, можно
ли этой реакцией различить ионы SO![]() и SO
и SO![]() .
.
Опыт 8. Восстановительные свойства тиосульфата натрия
В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель тиосульфата натрия до обесцвечивания растворов.
- Отметить происходящие изменения в пробирках
- Составить уравнение реакции, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. Выделяющаяся сера является продуктом побочной реакции.
Na2S2O3 + Br2 + H2O → Na2SO4 + H2SO4 + HBr
- Указать окислитель………………….., восстановитель ………………….
- Составить уравнение реакции, учитывая, что йод окисляет тиосульфат до тетратионата Na2S4O6.
Na2S2O3 + I2 → Na2S4O6 + NaI
- Указать окислитель………………….., восстановитель ………………….
- указать, какие свойства проявляет тиосульфат натрия.
