
- •Выводы 1:
- •Выводы 2:
- •Выводы 3а:
- •Выводы 3б:
- •Выводы 3в:
- •Три явления 3а,б.В
- •Весь процесс электролиза происходит в кислой среде:
- •4. Затруднен процесс отвода продуктов прямого электролиза от анода в объем раствора:
- •5. Просто: по изменению цвета раствора: розовый цвет – весь загрязнитель разложен до со2; еще можно вести электролиз смеси при сером цвете ее раствора.
- •Масса 1,22.10-3г,
- •8. Пример расчетов:
- •Е(ориентационные), е(индукционные), е(дисперсионные).
- •Обратный процесс это десорбция
- •22. Да может!!!
Весь процесс электролиза происходит в кислой среде:
наряду с «объемными» ОВ-реакциями в растворе смеси на поверхностях электродов
протекают сопутствующие взаимодействия:
КАТОД: 2 H2O(ж) + 2 ē H2(г) + 2 OH-(aq)
возникает щелочная среда ,образующиеся ионы OH- вступают в реакцию с Н+:
Eo2Н+/Н2 = 0 В EoН2О / Н2,ОН- = -0,83В
ЛЕГЧЕ протекает восстановления более сильного окислителя – Co3+: EoCo3+/Co2+ = +1,81B.
3. АНОД: 2 H2O(ж) - 4 ē О2(г) + 4 H+(aq) ); EoO2, H+ / Н2О = +1,23В
4. Затруднен процесс отвода продуктов прямого электролиза от анода в объем раствора:
УМЕНЬШИТЬ можно встряхиванием- перемешиванием, нагреванием … на водяной бане -
(при непрямом окислении полезно увеличить концентрацию МЕДИАТОРА и
повысить силу ТОКА )
5. Просто: по изменению цвета раствора: розовый цвет – весь загрязнитель разложен до со2; еще можно вести электролиз смеси при сером цвете ее раствора.
6.
C3H8O3 + 7 Co2(SO4)3 + 3 H2O = 14 CoSO4 + 3 CO2 + 7H2SO4
Со3+ + 1 ē Со2+ EoCo3+/Co2+ = +1,81B
C3H8O3 + 3 H2O - 14 ē 3 СО2 + 14 Н+ EoCО2, Н+ / C3Н8О3, Н2О -0,2B
______________________________________________________________________________
C3H8O3 + 3 H2O + 14 Со3+ 3 СО2 + 14 Co2+ + 14 Н+
7.
Масса объема смеси в микроячейке «сосуда-электролизера» 10мл . 2/3 = 6,7мл 6,7г
( при плотности раствора 1г/мл ),
В двух каплях «загрязнителя»-глицерина ( С3Н8О3 ) в этом «растворе» содержится его
Масса 1,22.10-3г,
Концентрация «загрязнителя» в водной смеси составляет:
1,22.10-3г / 6,7г = 0,182. 10-3 = 182.10-6 182ppm
8. Пример расчетов:
М(C3H8O3) = 92г/моль, Мэ(C3H8O3) = 92 / 14 = 6,57г/моль, Мэ(CO2) = 44 / 4 = 11г/моль
I = 1,6А, U = 3,6В
(наблюдаются газообразования вблизи поверхностей катода (2v H2(г)) и анода (1v О2(г)).)
τ = 33 . 60 = 1980с
Массу газообразного СО2, образуемого в ходе «непрямого» электролиза, рассчитывать по закону Фарадея так:
m(CO2) = Мэ(CO2) . I . τ / 96500 = 11 . 1,6 . 1980 / 96500 = 3,6 . 10-1г
V(СО2)опытная = ( 22,4 / m(CO2)опытная ) . 44 = 0,18л
9. Метод фотоколориметрии : Со2+ - розовый раствор, Со3+ - «серый раствор»
Использовать данные эксперимента:
m(Со2+)
=
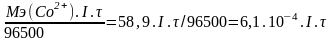
Исходный раствор: 0,1МСо2+ в Н2SO4 содержит 5,89. 0,007 / 1 = 4,1 . 10-2 г Со2+
Молярная концентрация Со2+ = 4,1 . 10-2 / 58,9 = 0,007М
стр. 9.
1. В образовании на АНОДЕ рыхлого осадка Fe(ОН)2(тв)$, легко переходящий в Fe(ОН)3(тв)$ (Eo Fe(ОН)3 / Fe(ОН)2, ОН- -0,56B), а далее в т.н.»ржавчину» FeО(ОН)(тв)$. На них и происходит сорбция органического загрязнителя.
2. Образующиеся на электродах газы Н2 и О2#. Вторичной реакцией на АНОДЕ является:
О2(г)# + 2 H2O + 4 Fe(ОН)2(тв)$ 4 Fe(ОН)3(тв)$
3. Образуется МИЦЕЛЛА – она захватывает поверхностью ГИДРОКСИДА любой краситель-загрязнитель из раствора, формируя на своей поверхности КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ:
( L-H )краситель + FeО(ОН)(тв)$ H2O + [ FeO-L ]
4. В первом варианте при образовании комплексов между «поверхностными» катионами ЖЕЛЕЗА и ионными молекулами красителя возникает ХЕМОСОРБЦИЯ:
Fen+ + nL- [ Fe-L ]
Во втором варианте комплекс образуется простым электростатическим притяжением ПОЛОЖИТЕЛЬНО или ОТРИЦАТЕЛЬНО заряженными ЦЕНТРАМИ гидратированных частиц рыхлого осадка ГИДРОКСИДА железа и противоположно заряженных частей молекул «загрязнителя» - это случай ФИЗИЧЕСКОЙ АДСОРБЦИИ.
5. Fe – анод ( растворимый ), на нем реально окисляется НАИБОЛЕЕ СИЛЬНЫЙ из восстановителей – тот, который имеет МЕНЬШЕЕ значение Eo.
Поэтому при растворении железного анода образуются Fe2+(aq)., а не сразу Fe3+(aq)., т.к.:
EoFe2+/Fe = -0,440B EoFe3+/Fe = -0,036B
6. В кислой среде, возникающей у поверхности АНОДА, Fe2+(aq) переходит в Fe3+(aq) :
АНОД: Fe(кр) - 2 ē Þ Fe2+(aq)
«параллельный» окислительный процесс на электроде:
2 H2O(ж) - 4 ē Þ О2(г)# + 4 H+(aq)
EoН+, О2/Н2О = +1,23B EoFe3+/Fe2+ = +0,770B
Реален вторичный процесс:
4 Fe2+ + 4 H+(aq) + О2(г) Þ 4 Fe3+ + 2 H2O
7. Реакции, происходящие на электродах показывает изменением своего цвета ИНДИКАТОР – тимоловый синий:
Вблизи поверхности КАТОДА раствор становится СИНИЙ!
Вблизи поверхности АНОДА раствор становится ВСЕ БОЛЕЕ КРАСНЫМ!
8. На осях КАЛИБРОВОЧНОГО графика откладывают оптическую плотность поглощения и величину концентрации Н+ раствора.
стр. 18.
1. ХЕМОСОРБЦИЯ – это ПРОЧНОЕ образование соединений между СОРБЕНТОМ (почва) и ионами раствора:
NH3(г) + H2O = NH4OH(слабое основание)
СаО + СО2 = СаСО3
3С2Н2 (600оС,активированный уголь) = С6Н6 реакция Зелинского Н.Д., 1911г.
A-B + C-D = [-A-B-C-D-](активированный комплекс) = A-C + B-D
2. ФИЗИЧЕСКАЯ АДСОРБЦИЯ – осуществляется за счет ОСТАТОЧНЫХ сил Ван-дер-Ваальсова взаимодействия между АДСОРБЕНТОМ и АДСОРБТИВОМ.
Ван-дер-Ваальсовы взаимодействия обусловлены наличием у реагирующих молекул ЭНЕРГИЙ трех видов:
