
I tnvl I l
V = *Рmax cos ( a>0t + ф) с собственной частотой COq и периодом T.mq = J—2- , Т = 2л \ = 2л\—, где
V I \mgl yg
величину L = I/ml называют приведенной длиной физического маятника (ф - начальная фаза колебания). Точка О'
на продолжении прямой ОС , отстоящая от оси подвеса на расстоянии приведенной длины L , называется центром качаний физич. маятника.
■Ф Математический маятник / рк
' ! VV
Идеализированную систему, состоящую из материальной точки массой т, подвешенной на невесомой / ; \\
нерастяжимой нити длиной I и колеблющейся под действием силы тяжести без трения, называют матема- rl_ \ g\l
тическим маятником. Реальной моделью математич. маятника может служить небольшой тяжелый ша- О*]'
рик, подвешенный на тонкой длинной нити. Математический маятник можно представить как частный (пре- \р дельный) случай физического маятника, вся масса которого сосредоточена в его центре масс. ДУ
движения математич. маятника тогда м-но получить из ур-ния (****), полагая, что I = ml2, т.е., получают такое соотношение: т d2(pjdt2 = -mg ср/l или d2(pjdt2 + g cp/l = 0. Следовательно, движение математич. маятника описывается ДУ гармонических колебаний, то есть происходит по закону cp(t) = <pmax COS {CO0t + ср) с частотой и периодом, соответственно: = -]g/l, Т = 2n ^jl/g. Приведенную длину физич. маятника можно определить как длину такого математич. маятника, который имеет такой же период колебаний, что и данный физич. маятник.
■ф Уравнение движения колебательных систем с трением. Затухающие колебания.
Рассмотренных выше гармонических колебаний, происходящих только под действием упругих или квазиупругих сил и продолжающихся неограниченно долго, в природе не существует, пос-ку всегда есть сила трения. Как только осцилля- торная система израсходует свою энергию на работу против сил трения, колебания прекратятся. Поэтому реальные осцилляции всегда затухающие. ДУ, описывающее физич. тело, совершающее затухающие колебания вдоль оси х, следуя основному уравнению динамики (тах = записывают в таком виде: т = ^ynp,x + fтр,х ■ В
зависимости от условий движения сила трения имеет различное выражение. Ниже использовано форма, наиболее удоб-
dx
dt
осциллятор - среда). Тогда ДУ движения примет вид: m = _/q- _ у — => ~ + 2г — + о&х = 0,; у/т = 2г,
■X |
|
|
\ |
'(-rt) |
|
|
У т |
J |
dt2 dt dt2 dt u
Г — коэффициент затухания колебаний; k/m = Ct)0 , здесь COq - частота незатухающего колебания, именуемая
обычно собственной. Так что это соотношение — окончательный вид ДУ затухающих колебаний. Его решение известно, так что на его основе м-но выразить функцию, к-рой описывается затухающее колебание:
x(t) = Ame~rt cos (со t + фо). At
Выражение, стоящее перед косинусом— амплитуда колебания. A(t) = Ame~'f. Амплитуда, т.о., не постоянна, зависит от времени, и при t —> да A(f) —» 0 ; Ао-амплитуда в Q момент времени t — 0. Чтобы построить график затухающего колебания, надо провести кривую A(t) = Аде~г' (как на рис.), затем провести симметричную ей относит-но оси 0/ ли-
I 2 2
чг Добротность осциллятора Важнейшими характеристиками затухающего колебания, кроме СО и Т, являются декремент затухания - отношение
Л (t ^ А е ~ н
амплитуд колебания, отстоящих через период Li— = J> _ >т также логарифмич. декремент затуха-
A(t + Т) А0<Гг(, + т>
1 п ЖО 1 тТ л пн - 1
ния К - ггл - хп е \ К = П и промежуток времени х = Г , в течение к-рого амплитуда уменьшает-
A(t + Т)
ся в ераз. Число колебаний, совершенных за это время, Ne = A = J_ = _L;,{. = i//\/(j .
Добротностью осциллятора называют безразмерную величину Q, равную произведению 2к на отношение энергии £(f) колебаний системы в произвольный момент времени t к убыли этой энергии за промежуток времени от t до t+T (за один условный период затухающих
E(t)
колебаний): Q = 2л -^-у — —. Энергия £(f) пропорциональна квадрату амплитуды A{t), поэтому:
Q = 2л A2(t + T)/[/\2(f) - A2{t + T)J = = 2tt/(i - e~2rTJ = 2;r/(l - e-2/l). При малых значениях логарифмического декремента
затухания (А,«1) 1-е"2'-=2А., поэтому (принимая Т я Т0) : Q = — = лЫе = — = — . При слабом затухании колебаний добротность
Л гТ 2 г
с точностью до множителя я пропорциональна отношению энергии, оставшейся в колебательной системе в данный момент, к потере этой энергии за 1 период осцилляций. Для прекращения колебаний в технич. системы вводятся дополнит, устройства - их называют демпферами.
•ё Вынужденные колебания Чтобы в реальной колебательной системе получить незатухающие колебания, следует компенсировать там потери энергии. Такая компенсация возможна с помощью какого-либо периодически действующего внешнего фактора (причины) возмущения системы X(f) , изменяющегося по гармоническому закону, —X(f) = Х0 cos Q/..
В случае механических колебаний таким фактором является вынуждающая сила!{{] = F0cosQt. Закон движения
■у
d х , dx _ л
для пружинного маятника будет иметь вид — m—= —kx - у— + Fi\ cos D.t.
dt2 dt
* В общем виде дифференциальное уравнение вынужденных колебаний имеет вид — d х dx 2
—х- + 2г — + conX = Xq cos Qf. Это — линейное неоднородное Ду. Его решение равно сумме функции dt dt
x(t) — Аре rt cos (cot + ф) — общего решения однородного ур-ния и частного решения ^ , резонанс
неоднородного ду. М-но показать, что это частное решение имеет вид: fr\ амплитуды
x(t) = А(О) cos [Qf + , где A(Q) и ср(0.) задаются формулами —
A(Q)
= , и =
,
ср
= arctg
2
-Jim$ - Q2)2 + 4r2Q2 ®0 - «
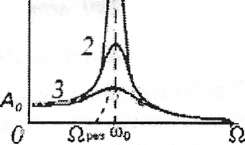
У Резонансом называется явление резкого возрастания амплитуды вынужденных колебаний при приближении частоты вынуждающей силы (или, в случае электрических колебаний — частоты вынуждающего переменного напряжения) к частоте, равной или близкой собственной частоте колебательной системы.
Амплитуда вынужденных колебаний a(Q) = — имеет максимум Арез = — при
" V<^o - О2)2 + 4r2Q2 lr\o\-2г2
I 2 2
частоте Qрез = Jo>q - 2г , к-рая называется резонансной частотой (1-ая производная знаменателя (- 4{coq - Q2]q + 8= о] обращается в нуль при Q" = COq — 2г2.
При й -> 0 амплитуда достигает предельного значения А0 = Х0/со2 , к-рое называется статическим отклонением. В случае механических колебаний - А0 = F0/mcog . При Q —> со амплитуда стремится к нулю. В слу- чае относительно малого затухания, когда г «соо2, с учетом того, что добротность колебательной системы м-т быть выражена как Q = СО0 /2г, величина резонансной амплитуды:
Арез - *о/2гС00 = соохо
/2гсо2 = К/2 г)А о - Q ■ А0 (Ао - статическое отклонение). Т.о., добротность характеризует резонансные свойства колебательной системы: чем выше добротность Q, тем больше Арез.
Итак, процесс вынужденных колебаний поддерживают для получения незатухающих колебаний. Неизбежные потери энергии на трение д-ны компенсироваться подводом энергии от внешнего источника периодически действующей силы. Существуют системы, в которых незатухающие колебания возникают не за счет периодич. внешнего воздействия, а в результате имеющейся у таких систем способности самой регулировать поступление энергии от постоянного источника. Такие системы называют автоколебательными, а процесс незатухающих колебаний в таких системах - автоколебаниями.
В автоколебательной системе можно выделить три характерных элемента - колебательная система, источник энергии и устройство обратной связи между колебательной системой и источником. В качестве колебательной системы может быть использована любая механическая система, способная совершать собственные затухающие колебания (например, маятник настенных часов).
Источником энергии м-т служить энергия деформация пружины или потенциальная энергия груза в поле тяжести. Устройство обратной связи представляет собой нек-рый механизм, с помощью которого автоколебательная система регулирует поступление энергии от источника.
П<
Г2<
Г3
; Осно " i О- ' 3акон°меРнос™ изолроцессов в газе. Уравнение Менделее-
до „ ' " 'М- Клапейрона. Идеальный газ. Микропараметры системы. -L '
лекция ы ; кинетичсескои теории ! Основное уравнение MKT. Термодинамическая температура.
Молекулярная физика представляет собой раздел физики, изучающий строение и свойства вещества, следуя молекуляр- но-кинетическим (МК) представлениям. С этих позиций любое материальное тело состоит из огромного количества хаотически движущихся обособленных малых частиц. Интенсивность этого движения (в основном, характеризуемая скоростью и амплитудой смещения) зависит от температуры. МФ изучает свойства тел в зависимости от их строения, сил взаимодействия между образующими тело частицами, от характера движения этих частиц. В ней рассматриваются превращения вещества, связанные с изменением энергии его молекул, изменения агрегатного состояния. Её практическое значение в том, что она лежит в основе материаловедения и указывает пути создания материалов с заданными механическими, а также электрическими и оптическими свойствами (сплавы, пластмассы, керамика, стекло, резина, бетон, полупроводниковые материалы).
МФ ставит целью дать объяснения тем явлениям и св-вам тел, к-рые непосред-но наблюдаются в опытах как суммарный рез-т действия движущихся молекул (характеризуемого температурой или давлением). При этом она пользуется статистическим методом, оперируя не движением отдел, молекул, а лишь такими, ср. величинами, k-рые характеризуют движение огромной совокупности частиц. В историческом отношении МФ и важна именно тем, что в ходе её развития был сформулирован и получил применение используемый в физике статистический метод - метод исследования систем из большого числа частиц, оперирующий вероятностными закономерностями и средними (усредненными) значениями физич. величин, характеризующих всю систему. МФ ставит целью дать объяснения тем явлениям и свойствам тел, к-рые непосред-но наблюдаются в опытах как суммарный результат действия движущихся молекул (характеризуемого температурой или давлением). Здесь и используется статистич. метод, который не рассматривает движение каждой отдельной молекулы, а оперирует лишь такими средними величинами, k-рые характеризуют движение огромной совокупности частиц.
Для характеристики масс атомов и молекул применяются величины, называемые атомной массой и молекулярной массой. Относительной атомной массой (А) химического элемента называется отношение массы атома этого элемента к 1/12 массы атома углерода б С12. Относительной молекулярной массой (М) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома углерода б С12: А = та/(шс/12) ; А4 = тм/(шс /12) . Это безразмерные величины. В 1971 г. Международная конференция по мерам и весам приняла 7-ю единицу измерения - количество вещества (v). Единица измерения количества вещества [v] ■— 1 моль. Моль — это количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в
74
углероде б С12 массой 0,012 кг. Моли всех веществ содержат одно и то же число молекул (число Авогадро): N д = 6,023 • 10 молъ-г. Массу моля обозначают через р (М). Единица измерения молярной массы в СИ [р] = кг/моль.
Теория молекулярной физики носит название молекулярно-кинетической (MKT). Развитие MKT началось в 18 в. и, в основном, тогда было призвано объяснить наблюдавшиеся закономерности так называемых изоироцессов в газах.
Было эмпирически установлено, во-1-ых, что в изотермическом процессе (т.е. при неизменной температуре) для данной массы таза произведение его давления на объем есть величина постоянная. Графически зависимость между Р и 1/выражается изотермами, к-
рые в системе координат Pv\ V имеют вид равносторонних гипербол: PV = Const.
Во-2-ых, объем данного количества газа при постоянном давлении прямо пропорционален его температуре: (У/Т) = Const. Такова закономерность изобарического процесса.
В-З-их, выполнялся закон Шарля: давление данного количества газа при постоянном объеме линейно зависит от его температуры: (Р/Т) = Const. Закон верен для изохорического процесса.
—В-4-ых, был установлен объединённый газовый закон (ОГЗ): произведение давления газа на объем, деленное на абсолютную температуру, для данной массы газа есть величина постоянная. PV/Т = Const.
В-5-х, закон Дальтона, давление смеси газов равно сумме парциальных давлений.
Пусть имеется в данном сосуде смесь газов, число молекул которой в единице объема равно соответственно П\, /Ъ,~, п„. Очевидно, что общее число молекул в единице объема будет равно сумме количеств молекул отдельных газов: п= гь+ П2+-+ п„. Поскольку все газы в смеси находятся при одинаковой температуре, то из уравнения следует, что Р - р\ + /%+...+ р„, где р\, pz,.., рп -так называемые парциальные давления, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один.
* Уравнение Менделеева - Клапейрона (УМК). Для нормального состояния принято считать Ро=1,01 •105Пй, t°=Q°C (Т0= 273,15 К), а объём одного моля газа при этом состоянии V0„=22,41 М^лАЗапишем ОГЗ для одного моля идеального газа в виде: PV^/T = PqV^q/Tq ~ R. Здесь R = 8.31 (Дж/молъ-К) -
рассчитываемое значение Ро Уоц/ То, к-рое называют универсальной газовой постоянной.
Записывают далее, что PV^ — RT. Это - уравнение Менделеева-Клапейрона для одного моля газа, одна из формулировок
уравнения состояния идеального газа. Для массы газа m УМК примет вид: PV = V RT, где m/\X = v — число молей газа. Физический смысл универсальной газовой постоянной R в том, что это - величина работы расширения одного моля газа при его нагревании на один градус (на 1 К) при постоянном давлении. Если использовать постоянную Больцмана: k = R/NA = 1.38-10"23 Дж/К, то уравнение состояния примет вид: Р = RT/V^ — kN^T/V^ = пкТ, где П = Na/V^ ~ концентрация молекул (в м3). Ф Исходные положения MKT
Для объяснения наблюдаемых явлений MKT оперировала следующими представлениями и понятиями. Во - 1-ых, принималось, что все вещества состоят из молекул—это следовало из обобщения результатов многих наблюдений. Молекулами называют наименьшие частицы вещества, сохраняющие его химические свойства. Молекулы состоят из одинаковых или различных атомов. Атом - это наименьшая часть вещества, обладающая всеми химическими свойства данного химического элемента.
Отметим далее особо - гипотеза об атомно-молекулярном устройстве вещества является фундаментальным предположением физики и всей системы естествознания в целом. На его основе удалось дать объяснение многому из происходящих вокруг явлений, обоснованно использовать выводы, следуя этой гипотезе, и предсказать свойства и поведение физических систем в интересах развития техники.
Во-2-ых, вводятся специальные физич. величины, которые называют параметрами состояния системы (нек-рого тела как системы из молекул или атомов) (впоследствии они будут именоваться термодинамическимй). В качестве основных используют три величины: давление Р, объем Ии температуру tsC(T=(tBC+273,15)К). Абсолютный нуль соответствует температуре -273,155С
У При изменении хотя бы одного из параметров изменяется и состояние системы, т.е. состояние системы определяется совокупностью значений параметров состояния. Между этими тремя основными параметрами состояния существует связь, называемая уравнением состояния:f(P,V,T) = 0. Наиболее простой вид имеет уравнение состояния газообразных веществ (см. выше записанное уравнение МК).
В-З-их. в качестве одной из основных моделей рассматривался идеальный газ - совокупность одинаковых, хаотически движущихся, не взаимодействующих друг с другом на расстоянии молекул. Размеры молекул столь малы, что суммарным объемом их можно пренебречь по сравнению с объемом сосуда. Подавляющую часть времени каждая молекула движется свободно, претерпевая иногда упругие соударения с другими молекулами или со стенками сосуда. При этих столкновениях и соударениях со стенками молекулы газа ведут себя подобно абсолютно упругим шарикам. Реальные газы очень близки к такой модели, представляющей идеальный газ. У Физические свойства и явления в газах, к-рые подтверждают состоятельность представлений MKT, следующие:
Высокая сжимаемость газов (наличие больших расстояний между молекулами газа).
Взаимное проникновение соприкасающихся газов (диффузия).
Давление газа на стенки сосуда (удары молекул газа).
Броуновское движение (тепловое движение молекул и отсутствие полной компенсации производимых ими ударов).
Средняя длина свободного пробега и среднее число столкновений. Простейшая МК модель газа - совокупность одинако вых, хаотично движущихся молекул. Их размеры крайне малы, и суммарным объёмом всех молекул м-но пренебречь по сравнению с объ ёмом всего сосуда. Подавляющую часть времени каждая из молекул движется свободно, иногда претерпевая упругие соударения с други
ми молекулами или стенками сосуда. Ниже рассмотрен ряд величин, к-рые, в отличие от термоди О i ■ ^ ^ намич. (макро-) параметров системы молекул, именуют микропараметрами системы.
gs/^ > ^ Минимальное расстояние, на к-рое сближаются при соударении центры 2-х молекул
y^si (рисЛя), называют эффективным диаметром молекулы (ЭДМ). За время между 2-мя последова- d А '/Л тельными столкновениями молекула газа проходит проходит нек-рый путь /, именуемый длиной
0 свободного пробега (ДСП). Это — случайная величина (рис.16), поэтому оперируют вероятностью * ■ra(Z) того, что частица пролетит без столкновений нек-рый путь
/ : Zff(lj= ехр(-//д) <— Л— средний путь, проходимый частицей между 2-мя последовательными столкновениями (средняя ДСП). За интервал At = 1 С частица проходит в среднем путь, равный средней скорости <V>. Если за 1 сек. частица претерпевает в среднем v соударений, то А, = (f)/v , с другой стороны (если представить, что частица при этом, двигается в пространстве, заключённом в коленчатом «цилиндре» с диаметром, равным удвоенному ЭДМ), число соударений (частота V) д-но быть равным V' = Ял/2Й2п(г?) <— т.е., числу частиц в этом «цилиндре». Тогда из сопоставления V, V' => X — (лл/2d21tj , или
X — [a42<51iJ , (*) где 7ТС?2/4 = а <— эффективное сечение молекулы (ЭСМ).
У Поск-ку при постоянной температуре и изменяется пропорц-но давлению Р, то согласно (1) X ~ 1 /Р . С повышением темпера
туры (Т) ЭДМ d неск-ко уменьшается, поэтому ДСП возрастает, и его увеличение описывается формулой Сезерленда. X = ХхТ/(Т + С) , С — постоянная, типичная для каждого из газов.
-ё Основное уравнение молекулярно — кинетической теории идеальных газов Пусть в сосуде объёмом V находится газ массой т, состоящий из N молекул, т.е., по определению концентрация молекул в газе п = N/ V. Рассматривается идеальная модель газа — молекулы одинаковой массы тй движутся с одинаковыми скоростями V. При ударе о стенку сосуда молекула сообщает ей импульс, численно равный изменению импульса молекулы. Удары молекул и обусловливают давление газа на стенки ограничивающего его сосуда. Расчёт этого импульса за время At для площадки Д5дает величину
Ар = nmQv2ASAt/3 . Известно, что Ар = FAt и Р = Fj AS , т.е. импульс Ар и давление Р связаны так:
Р = Ар/(AS At) . Поэтому давление, оказываемое газом на стенку сосуда: Р = пт0и2/3 . Если газ в объёме V содержит N
молекул, движущихся с определённым разбросом скоростей, так что их скорости— Vj, V2, • . • , V^, то целесообразно рассмат-
}2 = £ of Jn = £max v2dNvlN и характеризует
1 2
всю совокупность молекул газа. Так, что основное уравнение MKT идеальных газов. Р = —nnio(uKg) . (*) > Другие варианты записи этого уравнения с учетом соотношений tt=N/V и т = то N:
PV = i Nm 0 (укв )2 • PV = | м(ш0(и^>2/2) = 2Ek/3 , PV = т(икв)2/з .
Здесь Ек - суммарная кинетич. энергия поступательного движения молекул газа, также вводится (s^ = Ek/N - щ(оке)2/2.
Из (*) следует, что при постоянном п (неизменный объём) давление пропорц-но средней кинетич. энергии поступательного движения. Вместе с тем известно, температура T, измеряемая по газовой шкале, определяется как величина, пропорциональная давлению
идеального газа при постоянном объёме. Естественен вывод - температура Г пропорц-на (eq) . Далее умножая обе части ур-ния (*) на значение молярного объёма, записывают: PV^ = 2(nV^£0)/3 . Отмечается далее, что nV^ = NA — произведение числа молекул и объема 1 моля V^ равно числу Авогадро, поэтому PV^ = 2N^(s0)/3 . Сопоставление последнего с уравнением состояния идеального газа для 1 моля — Р7| (т.е., УМК) приводит к соотношению 2NA{z^j3 = RT , откуда следует:
(sq) = 3kT/2 , (* *) ■*—здесь также к = R/NA — постоянная Больцмана.
Судя по (**), абсолютная температура есть величина, пропорциональная средней энергии движения молекулы. Отсюда следует, что = 0 при Т = ОК (т.е., при абсолютном нуле температуры движение молекул газа должно прекратиться). Тем самым, термодинамическая температура — есть мера средней кинетической энергии поступательного движения молекул газа, в этом — молекулярно-кинетическое толкование температуры. Ещё раз подчёркивается, что замена в ур-нии состояния PV^-RT постоянной R ША с учётом того, что п = NAjVfl ведёт к такой формулировок основного уравнения MKT: Р = пкТ. (* * *)
ривать
среднюю квадратичную скорость, которая
определяется как /у
2. ' Кинетическая энергия Wk = mv2/2 3' j Работа постоянной силы (ф = 0) : А = F • S
tg ср
А | COS ср 0| + А 2 cos /р 02 Итак, в результате сложения двух гармонических колебаний одинаковой частоты, описываемых (**), получается также гармоническое колебание с амплитудой (***) и начальной фазой (****). Если частоты колебаний Х-^ и Х2 будут неодинаковыми, то векторы А| и
А2 будут вращаться с различными скоростями. В результате вектор А будет вращаться с непостоянной скоростью, а его величина
