
Лекція 6
Ароматичні вуглеводні
1 Вступ
2 Номенклатура похідних бензену
3 Стабільність бензену
4 Фізичні властивості ароматичних вуглеводнів
5 Добування бензену
Реакції бензену
1 Вступ
Бензен (бензол)
Високоненасичена сполука у вигляді шестикутного кільця з чередуванням одинарних і подвійних зв'язків між атомами вуглецю. Хімічно неактивна порівняно з алкенами.
2 Номенклатура похідних бензена
Монозаміщені бензени
Для певних монозаміщених сполук бензену замісник позначається в префіксі

Якщо алкільний замісник має більше шести атомів вуглецю, сполуку називають феніл-заміщеним алканом.

Для інших сполук бензольне кільце з замісником утворюють нову тривіальну назву


Полізаміщені бензени
Якщо сполука містить більше одного замісника і замісники ідентичні, для позначення їхнього розташування викорстовують префікси ди- (ді-), три-, тетра- і т.і.


Н азви
дизаміщених
бензенів
утворюють
також
з
використанням
префіксів
орто
(o)
для
1,2-дизаміщених,
мета
(м)
для
1,3-дизаміщених,
пара
(п)
для
1,4-дизаміщених.
азви
дизаміщених
бензенів
утворюють
також
з
використанням
префіксів
орто
(o)
для
1,2-дизаміщених,
мета
(м)
для
1,3-дизаміщених,
пара
(п)
для
1,4-дизаміщених.

Коли присутні два або більше різних замісника, їх називають в абетковому порядку.


Якщо присутній замісник, що з бензольним кільцем утворює нову тривіальну назву, він набуває позицію 1 і використовується нова тривіальна назва


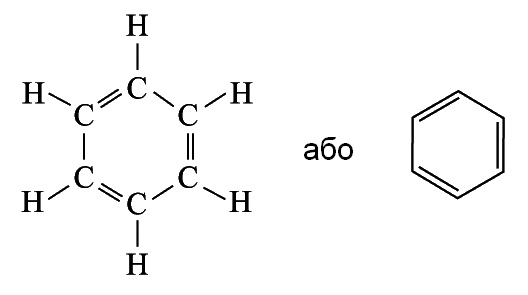
3 Стабільність бензену
В 1865, Кекуле запропонував структуру бензолу:
Згідно зі структурою Кекуле повинно існувати дві різні сполуки 1,2-дибромбензолу:
 Насправді
існує
лише
одна
сполука
1,2-дибромбензолу!!
Насправді
існує
лише
одна
сполука
1,2-дибромбензолу!!
Згідно зі структурою Кекуле бензен повинен легко вступати в реакції приєднання, але він легше утворює продукти заміщення ніж приєднання. Þ Структура Кекуле не може пояснити поведінку бензолу
Зміна ентальпії процесів гідрування бензолу і циклогексену
Зміна ентальпії процесу гідрування циклогексену = –119,6 кДж моль–1

Зміна ентальпії процесу гідрування циклогексадієну-1,3 очікуваано повинна бути вдвічі більша ніж відповідне значення для циклогексену

Якщо бензен має структуру циклогексатриєну-1,3,5, можна очікувати, що зміна ентальпії процесу гідрування буде втричі більша ніж у циклогексену

Бензол більш стабільний ніж структура Кекуле.
Різниця енергії на стабілізацію бензолу називається резонансною енергією бензолу

Пояснення структури бензолу явищем резонансу
Експериментально доведено, що довжина зв’язку карбон-карбон в молекулі бензолу має проміжне значення між дловжинами одинарного C – C і подвійного C = C зв’язків
0.134 нм > 0.139 нм > 0.154 нм C = C зв’язок в бензолі C – C
В бензолі всі атоми карбону знаходяться в стані sp2-гибридизації
Бічне перекривання негібридних 2p орбіталей по обидва боки циклу створює умови для делокалізації p електронних хмар над і під площиною циклу (π-π спряження)

Делокалізація p електронів робить бензол дуже стабільним та визначає його хімічні властивості


В ластивості
бензолу
можна
пояснити
резонансною
теорією,
як
резонансний
гібрид
двох
еквівалентних
структур
Кекуле:
ластивості
бензолу
можна
пояснити
резонансною
теорією,
як
резонансний
гібрид
двох
еквівалентних
структур
Кекуле:
Структурна формула бензолу
Коло позначає шість електронів, що делокалізовані між шістьома атомами карбону в бензольному кільці
Бензол – ароматична сполука, що має площинну циклічну будову з шістьома спряженими π електронами.
Правило Хюккеля:
Ароматична молекула має бути плоскою, циклічною, спряженою і мати 4n+2 π електронів (де n = 0, 1, 2, 3, і т.д.). Плоска, циклічна, спряжена молекула з іншою кількістю π електронів є неароматичною.
Алкілбензени – група ароматичних вуглеводнів, в яких алкільна група безпосередньо зв’язана з ароматичним кільцем. Інакше їх називають “арени”


Будова метилбензолу
Всі C атоми в кільці знаходиться в стані sp2-гібридизації
C атом в метильній групі в стані sp3-гібридизації
Делокалізовані p електрони підвищують стабільність
Фізичні властивості ароматичних сполук:
мають сильний, часто приємний, запах
густина, головним чином, менше, ніж у води при 20°C
як правило не змішуються з водою
розчиняються в органічних розчинниках
Назва |
Формула |
Ткип (°C) |
Тплавл (°C) |
Густина 20°C (гсм–3) |
Бензол |
|
80.1 |
5.5 |
0.878 |
Толуол |
|
111 |
–95 |
0.867 |
Етилбензол |
|
136 |
–94 |
0.867 |
1,2-Диметилбензол (о-Ксилол) |
|
144 |
–25.2 |
0.880 |
1,3-Диметилбензол (м-Ксилол) |
|
139 |
–47.4 |
0.864 |
1,4-Диметилбензол (п-Ксилол) |
|
138 |
13.3 |
0.861 |



