
Явления переноса.
Процессы, протекающие в системе, могут быть равновесными и неравновесными.
Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
При нарушениях равновесия в системах возникают потоки массы, либо энергии, либо электрического заряда и т.д. Эти процессы носят названия явлений переноса.
Диффузия
–это обусловленное тепловым движением
выравние концентраций двух соприкасающихся
газов, жидкостей и даже твёрдых тел.
Явление диффузии для газа подчиняется
закону Фика: масса вещества
переносимого через площадку S,
перпендикулярную оси x,
пропорциональна градиенту плотности
вещества
![]() , площади поверхности и времени переноса
, площади поверхности и времени переноса
![]() ,
,
![]() ,
,
где
![]() – коэффициент диффузии,
=
– коэффициент диффузии,
=![]() ,
,
![]() - средняя скорость теплового движения
молекул газа,
- средняя скорость теплового движения
молекул газа,
![]() - средняя длина свободного пробега
молекул.
- средняя длина свободного пробега
молекул.
Знак минус обусловлен тем, что поток массы направлен в сторону убывания плотности.
Теплопроводность. Если в
некоторой среде создать вдоль оси x
градиент температуры
![]() ,
то возникает поток тепла.
,
то возникает поток тепла.
Явление теплопроводности подчиняется закону Фурье:
![]()
Здесь
![]() - теплота, переносимая через поверхность
S, перпендикулярную
к оси x, за время
,
- теплота, переносимая через поверхность
S, перпендикулярную
к оси x, за время
,
![]() - коэффициент теплопроводности. Знак
минус отражает тот факт, что теплота
течет в направлении убывания температуры.
Для газов коэффициент теплопроводности
- коэффициент теплопроводности. Знак
минус отражает тот факт, что теплота
течет в направлении убывания температуры.
Для газов коэффициент теплопроводности
![]() , где
, где
![]() - удельная теплоёмкость газа при
постоянном объёме.
- удельная теплоёмкость газа при
постоянном объёме.
Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа или жидкости, движущимися с различными скоростями, заключается в том , что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее- увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:
![]()
где
![]() - динамическая вязкость,
- динамическая вязкость,
![]() - градиент скорости, показывающий
быстроту изменения скорости в направлении
x, перпендикулярном
направлению движения слоев, S-
площадь соприкасающихся слоев.
- градиент скорости, показывающий
быстроту изменения скорости в направлении
x, перпендикулярном
направлению движения слоев, S-
площадь соприкасающихся слоев.
Взаимодействие двух слоёв согласно второму закону Ньютона можно рассматривать как процесс, при котором от одного слоя к другому в единицу времени передается импульс, по модулю равный действующей силе:
![]()
![]()
![]()

![]() где
где
![]() - импульс , переносимый через площадку
S , перпендикулярную
оси x, за время dt.
Знак минус указывает, что импульс
переносится в направлении убывания
скорости слоёв газа (жидкости). Из
кинетической теории газов следует, что
коэффициент вязкости
- импульс , переносимый через площадку
S , перпендикулярную
оси x, за время dt.
Знак минус указывает, что импульс
переносится в направлении убывания
скорости слоёв газа (жидкости). Из
кинетической теории газов следует, что
коэффициент вязкости
![]()
Длина
свободного пробега молекул
![]() - это расстояние между двумя последовательными
соударениями данной молекулы с другими.
- это расстояние между двумя последовательными
соударениями данной молекулы с другими.
Основы термодинамики
Первый закон термодинамики
Первое начало термодинамики: теплота d´Q, сообщаемая системе, расходуется на увеличение её внутренней энергии dU и на совершение ею работы d´A против внешних сил
d´Q= dU+ d´A
Внутренняя энергия U - это энергия хаотического движения микрочастиц системы (молекул, атомов и др.) и энергия взаимодействия этих частиц. Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенным значением внутренней энергии. Для идеального газа внутренняя энергия- это суммарная кинетическая энергия движения его молекул.
Средняя кинетическая энергия одной молекулы
![]() ,
,
где
![]() – число степеней свободы молекулы
– число степеней свободы молекулы
= пост+ вращ+2 колеб .
Одноатомная молекула имеет три степени свободы поступательного движения ( =3); двухатомная молекула имеет пять степеней свободы ( =5),
трёхатомная и многоатомная молекулы имеют шесть степеней свободы
( =6).
Внутренняя энергия одного моля идеального газа
![]()
Внутренняя энергия произвольной массы идеального газа
![]()
Работа газа при изменении его объёма
![]()
Теплоёмкость
Удельная теплоёмкость вещества – величина равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1К:
![]() ,
,
Молярная теплоёмкость - величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К:
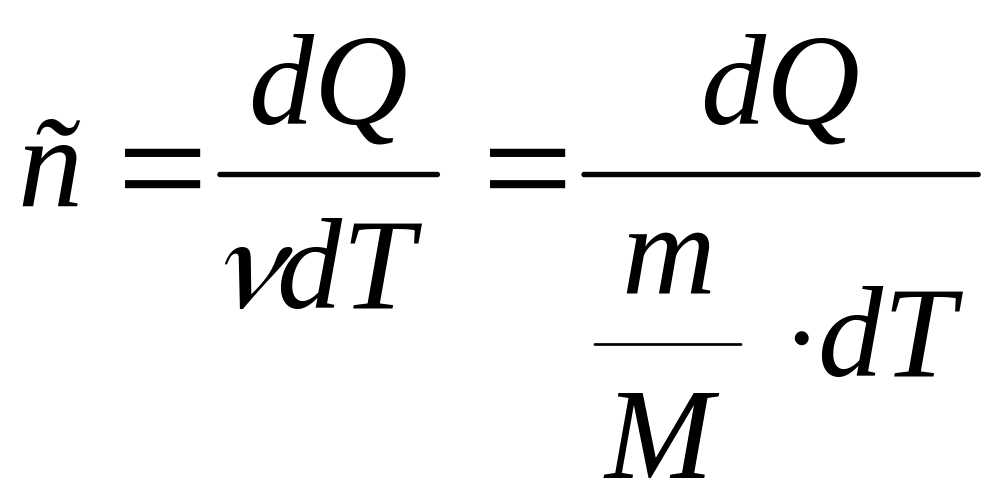 ,
,
Удельная теплоёмкость с связана с молярной С соотношением:
![]()
Применение I начала термодинамики к изопроцессам
Изохорический процесс:

![]() при
при
![]() ,
,
![]() , т.к.
, т.к.
![]()
![]() Вся теплота идёт на приращение
внутренней энергии
Вся теплота идёт на приращение
внутренней энергии
Молярная теплоёмкость при постоянном объёме:
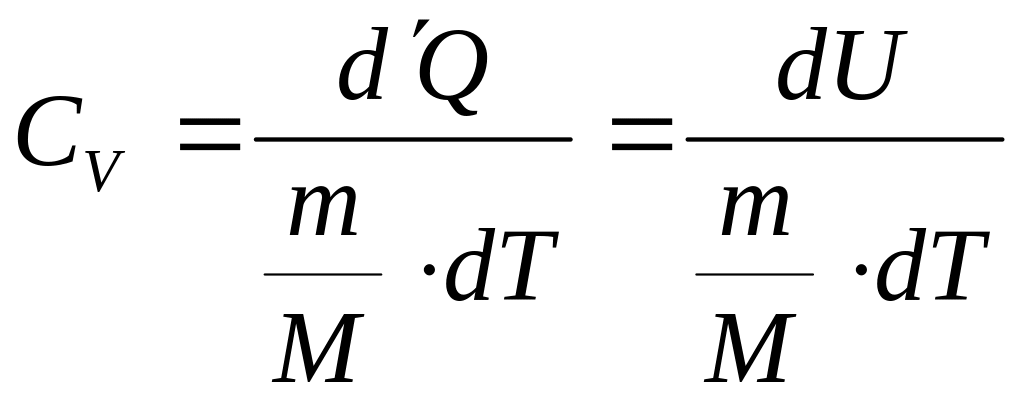
Тогда приращение внутренней энергии
![]() .
С другой стороны:
.
С другой стороны:
![]() .
.
Следовательно, молярная теплоёмкость при постоянном объёме
![]()
Изобарный процесс:
при
![]()
Работа
при изобарном процессе:

Молярная теплоёмкость при постоянном давлении

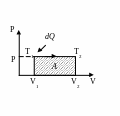
Первое
слагаемое правой части даёт Сv
, а второе – R –
газовую постоянную. В самом деле, из
уравнения
(учитывая, что P –
const) следует, что
![]() .
Тогда связь между молярными и удельными
теплоёмкостями (уравнения Майера) имеет
вид:
.
Тогда связь между молярными и удельными
теплоёмкостями (уравнения Майера) имеет
вид:
![]() ,
,
![]()
Изотермический процесс:
 при
при
![]()
![]()
![]() , т.к.
, т.к.
![]()
Вся теплота, сообщённая системе в ходе изотермического процесса, идёт на совершение системой работы над внешними силами.
![]() , учтем, что
, учтем, что
![]() , тогда
, тогда

В ходе изотермического процесса
внутренняя энергия системы не изменяется,
![]()
4. Адиабатический процесс –
это процесс, протекающий без теплообмена
с окружающей средой
![]() , следовательно
, следовательно
![]()

Работа в ходе адиабатического расширения осуществляется за счет убыли внутренней энергии.

Получим уравнение адиабаты. Возьмем систему (газ) в количестве 1Моль.
или
![]() .
Разделим это уравнение на уравнение
Клайперона:
.
Разделим это уравнение на уравнение
Клайперона:
![]() или
или
![]()
Обозначим отношение
![]() , тогда
, тогда
![]()
Следовательно,
![]() , или
, или
![]()
Это уравнение связывает температуру
и объем газа в ходе адиабатического
процесса. Из уравнения Клайперона
![]() , тогда
, тогда
![]() или
или
![]()
![]() - уравнение Пуассона.
- уравнение Пуассона.
Выразим
![]() через число степеней свободы молекул
газа.
через число степеней свободы молекул
газа.
Молярная теплоемкость при постоянном
объеме
, при постоянном давлении
![]()

Их отношение:
