
5. Рефрактометрический метод анализа (рефрактометрия). Теоретические основы метода, его применение. (№47)
Сущность метода и область применения.
Преломление световых лучей на границе раздела двух различных оптических сред называют рефракцией, которая характеризуется показателем преломления.
Рефрактометрический метод анализа (рефрактометрия) основан на зависимости показателя преломления света от состава системы. Такую зависимость устанавливают путём определения показателя преломления для ряда стандартных смесей растворов.
Предварительно по экспериментальным данным строят градуировочный график в координатах: состав смеси – показатель преломления; затем по градуировочному графику определяют показатель преломления раствора неизвестного состава. Метод рефрактометрии применяют для количественного анализа бинарных, тройных и разнообразных сложных систем растворов. Примером бинарных систем являются водные растворы спиртов, сахаров, глицерина, кислот, оснований, солей и др.
Для водного раствора сахара и метанола градуировочный график имеет следующий вид: на оси ординат откладывают показатель преломления (п), который определяют с помощью рефрактометра, на оси абсцисс – содержание сахара и метанола (в %).
Рефрактометрический метод анализа имеет ряд достоинств, простота и быстрота определений, высокая точность анализа (до сотых долей процента). Метод применяют для анализа разнообразных сложных систем: горючих и смазочных материалов, биологических и пищевых продуктов, лекарственных препаратов и др. При анализе многокомпонентных систем часть компонентов может находится в постоянном соотношении, что упрощает анализ, так как даёт возможность рассматривать систему как двойную.
В связи с тем, что показатель преломления является индивидуальной характеристикой вещества, и присутствие в исследуемой системе примесей влияет на его значение, то определение его используют для установления степени чистоты вещества. С помощью рефрактометрических измерений проводят индентификацию веществ путём определения величин преломления и их физических характеристик (плотности, температуры кипения и т. д.). Полученные экспериментальные величины сравнивают с табличными и, таким образом, устанавливают природу веществ.
Теоретические основы рефрактометрического метода анализа.
Скорость распространения света в разных средах различна. Этим обстоятельством объясняется явление преломления света, т. е. отклонения световых лучей от первоначального направления на границе раздела двух сред. Преломление света оценивается абсолютным и относительным показателями преломления света. Абсолютным показателем преломления света (N) для данного вещества называют отношение скоростей света в вакууме (Vв) и в данной среде (Vc):
N
=

Так как скорость света в вакууме всегда больше скорости света в любой другой среде, то N всегда больше единицы.
Таким
образом, если луч переходит из среды
менее оптически плотной в среду более
оптически плотную, то угол падения (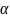 )
всегда больше угла преломления (
)
всегда больше угла преломления (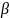 ).
Этот общий случай преломления светового
луча на границе дух оптических сред
характеризуется относительным показателем
преломления:
).
Этот общий случай преломления светового
луча на границе дух оптических сред
характеризуется относительным показателем
преломления:
nотн
=
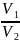
где V1 и V2 – скорости распространения света в первой и второй средах.
В практике работы с твердыми и жидкими средами показатели преломления устанавливают по отношению к воздуху и называют их показателями преломления (п). Показатель преломления зависит от природы вещества, длины световой волны и температуры. Для веществ в газообразном состоянии учитывают ещё давление.
В
таблицах значения показателей преломления
приведены для желтой линии в спектре
натрия
 D
– 589,3 нм (линия D).
Они обозначены через nD.
D
– 589,3 нм (линия D).
Они обозначены через nD.
Для рефрактометрии, наиболее важна зависимость показателя преломления от длины волны падающего света. Эту зависимость называют дисперсией.
Различают частную дисперсию и среднюю дисперсию.
Дисперсия, так же как и показатель преломления, зависит от природы вещества. Чем больше разница в показателях преломления для двух волн какой-либо длины 1 и 2, тем больше дисперсия. Разность коэффициентов преломления для двух волн различной длины п 1 – п 2 называют частной дисперсией, которая может служить мерой дисперсии вещества.
Табличной характеристикой дисперсии вещества является разность показателей преломления для длин волн, соответствующих граничным линиям средней части спектра водорода. В спектре водорода имеется красная линия С( с = 656,3 нм) и синяя линяя F( F = 486,1 нм). Разность показателей преломления для длин волн, соответствующих указанным линиям (пF – пс), называют средней дисперсией. Иногда вещества с близкими показателями преломления имеют резко различную дисперсию. Определение дисперсии помогает избежать ошибки при установлении природы вещества. Совпадение значений показателя преломления и дисперсии подтверждает правильность сделанного вывода о природе вещества.
При рефрактометрических измерениях необходимо учитывать зависимость показателя преломления от температуры; измерение показателей преломления веществ проводят при постоянной температуре. Если измерения проводят с целью идентификации чистого вещества, то температура опыта должна соответствовать табличным значениям коэффициентов преломления.
В процессе перекристаллизации твердого тела из одной аллотропической модификации в другую или в процессе изменения давления для газовых сред показатель преломления вещества принимает различные значения в соответствии с изменением плотности вещества.
Связь между показателем преломления п и плотностью d (в г/см3) можно выразить уравнением:
f (п) = rd
где r – коэффициент пропорциональности удельная рефракция.
Существует связь между явлением рефракции и поляризацией вещества в электромагнитном поле видимого света. В результате поляризации вещества (молекул, атомов) поток световых веществ – фотонов отклоняется от заданного направления. Следовательно, преломление луча может зависеть не только от внешних факторов, но и от внутренней структуры вещества.
Для
нахождения показателя преломления,
отражающего внутреннюю структуру
вещества, предложено несколько формул
для выражения удельной рефракции r
и мольной рефракции R,
получаемой умножением удельной рефракции
r
на молекулярную массу вещества
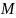 .
Одна из них формула Лорентца-Лоренца:
.
Одна из них формула Лорентца-Лоренца:
R
=
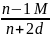 м3/кмоль
м3/кмоль
Величины r и R зависят от интенсивности поляризации частиц вещества в электромагнитном поле падающего света. Внешние условия: температура, давление, агрегатное состояние вещества не оказывают влияния на мольную рефракцию. В этом аспекте мольную рефракцию рассматривают как среднюю меру поляризуемости молекул.
Исходя из того, что поляризационный эффект молекулы складывается из поляризационных эффектов, входящих в неё атомов, то численное значение мольной рефракции состоит из суммы атомных рефракций. Так, мольная рефракция метана может быть представлена, как сумма атомных рефракций углерода и водорода. Например, мольная рефракция бензола является суммой атомных рефракций элементов, входящих в его состав, а именно:
RC6H6 = 6RC + 6RH
Если мы имеем смесь веществ, то их мольная и удельная рефракции слагаются из рефракций компонентов, входящих в состав смеси с учётом их количества.
Например, мольная рефракция смеси бензола С6H6 и мезитилена С6Н3(СН3)3 будет равна:
RC6H6 + C6H3(CH3)3 = RC6H6NC6H6 + RC6H6 + C6H3(CH3)3NC6H6 + C6H3(CH3)3
где NC6H6 и NC6H6 + C6H3(CH3)3 – мольные доли указанных веществ в смеси.
В справочных таблицах указаны атомные рефракции.
На практике для определения мольной рефракции измеряют показатель преломления вещества и его плотность. По формуле Лорентца-Лоренца вычисляют значение мольной рефракции. Так как поляризация молекулы является суммарным эффектом поляризации входящих в её состав атомов, численное значение её должно быть суммой атомных рефракций.
По табличным данным проводят проверку экспериментальных результатов, для чего суммируют атомные рефракции. Совпадение найденных значений с экспериментальными подтверждает правильность анализа исследуемого вещества.
Расхождения допускаются в пределах 0,2 – 0,4 см3/моль для более простых соединений, а для очень сложных – в пределах 0,1 – 0,2 см3/моль.
