
- •Кафедра прикладной химии и физики
- •Буйлова е.А., ассистент
- •Содержание
- •Лабораторная рабoта №1 элементы I b группы. Мeдь Теоретическая часть.
- •Лабораторная работа № 2 Элементы II b группы. Цинк
- •Контрольные вопросы.
- •Лабораторная работа № 3 элементы VI в группы. Хром
- •Лабораторная работа № 4 элементы VII в группы. Марганец
- •Экспериментальная часть.
- •Лабораторная работа № 5 железо. Комплексные соединения
- •Лабораторная работа № 6 элементы III а группы. Алюминий
- •Лабораторная работа № 7 элементы VI a группы. Сера
- •Лабораторная работа № 8 элементы II а группы
- •Лабораторная работа № 9 жесткость воды
- •Лабораторная работа № 10 элементы IV а группы. Углерод. Кремний
- •Лабораторная работа № 11 элементы V а группы. Азот. Фосфор
Лабораторная работа № 9 жесткость воды
Опыт 1. Определение общей жесткости воды трилонометрическим (комплексонометрическим) методом
Основа метода – комплексонометрия, которая представляет собой раздел объемного анализа, основанный на реакциях комплексообразования между определенным компонентом и титрантом, т.е. веществом, которым производится титрование.
Этот метод значительно удобнее и является более точным по сравнению с другими методами. Трилонометрический метод определения общей жестокости воды основан на использовании титрованного раствора трилона Б (другое название – комплексов ЭДТА, титриплекс, версен и др.) в качестве комплексообразователя. Трилон Б – это двузамещенная двунатриевая соль этилендиаминтетрауксусной кислоты:
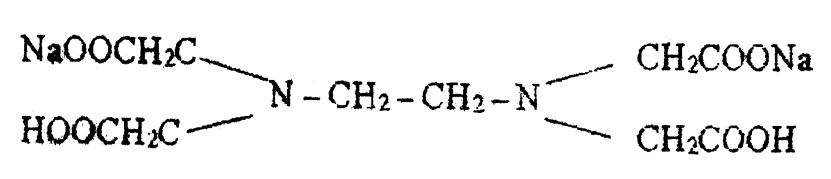
Условно формулу трилона Б запишем в виде Na2[H2Tp]. Трилон Б образует прочные растворимые комплексы с ионами многих металлов, в том числе и с Са2+ и Mg2+. С целью предотвращения отрицательного влияния низких значений рН на процесс комплексообразования титрование ведут в щелочной среде, которая создается аммиачным буферным раствором (смесь NH4OH и NH4Cl). Буферный раствор обеспечивает стабильное значение рН = 8- 10. Титрование ведут в присутствии индикатора кислотного хромогена черного. Индикатор, окрашивающий в присутствии ионов кальция и магния раствор в винно-красный цвет, при их полном исчезновении (связывании в комплекс с трилоном Б) меняет свой цвет на синий.
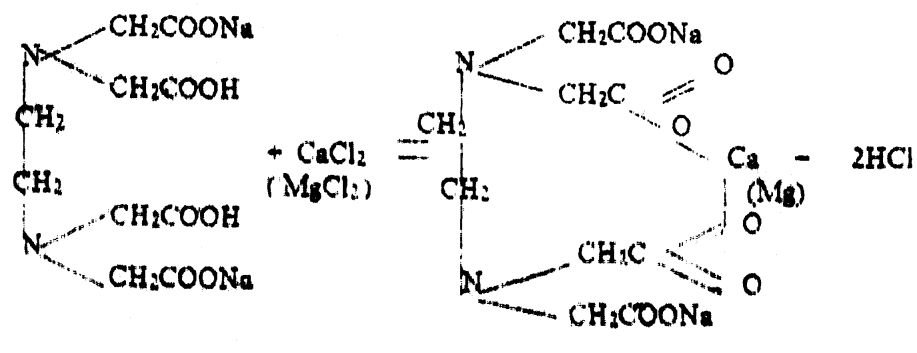
Химизм процесса можно представить так: индикатор H2Jnd с ионами Са2+ и Mg2+ образует комплексное соединение винно-красного цвета (менее прочное, чем комплексы с трилоном Б):
Са2+ + H2Jnd → СаJnd + 2 Н+
винно-красный цвет
При титровании трилоном Б с ним взаимодействуют сначала свободные ионы Са2+ и Mg2+:
Na2[H2Tp] + Са2+ → Na2 [CaTp] + 2Н+;
а затем связанные с индикатором ионы:
CaJnd + Na2[H2Tp] → Na2 [CaTp] + 2H+ + Jnd2-
Когда в растворе не остается ионов Са2+ и Mg2+, раствор окрашивается в чисто синий цвет. Это точка эквивалентности. Зная нормальность раствора трилона, объем трилона, объем взятой для титрования воды, можно рассчитать жесткость в мг-экв/л по формуле:
![]()
где Жоб. – общая жесткость, мг-экв/л;
Nтp. – нормальная концентрация трилона Б;
Vтр. – объем трилона, израсходованный на титрование, мл;
V (Н2О) – объем пробы воды, мл.
Ход определения. В две конические колбы емкостью 250 – 300 мл отмерить пипеткой 50 мл воды с неизвестной жесткостью. Объем доводят до 100 мл дистиллированной водой. Добавить в эти же колбы по 5 – 10 мл буферной смеси и стеклянной ложечкой сухого индикатора хромогена черного до получения винно-красной окраски. Одна из колб служит контрольной. Титровать пробу из бюретки раствором трилона Б до тех пор, пока от одной капли трилона Б окраска перейдет из винно-красной в синюю. Записать число миллилитров раствора трилона Б, израсходованных на титрование (точность 0,1 мл). Титрование повторить с новой порцией воды и при исходных результатах между двумя параллельными определениями (разница не более 0.2 мл) взять среднее арифметическое из числа миллилитров раствора трилона Б, пошедших на титрование (конец титрования лучше всего наблюдать, если рядом поставить заранее перетитрованную пробу).
Расчет жесткости провести по выше приведенной формуле.
Опыт 2. Умягчение водопроводной воды катионитом КУ-2
Катионит КУ-2 относится к универсальным катионитам. Получают его совместной полимеризацией стирола и дивинилбензола с последующей обработкой концентрированной серной кислотой. Выпускается катионит в виде сферических гранул желтого или коричневого цвета. Катионит в Н-форме применяется для умягчения, обессоливания воды и для очистки производственных сточных вод от катионов тяжелых металлов.
Взять две пробирки с водопроводной водой. В одну из пробирок добавить 1...2 капли индикатора метилового оранжевого. Отметить цвет полученного раствора. В другую пробирку по каплям прилить раствор щавелевокислого аммония (NH4)2C2O4. Что произошло? Написать реакцию, имея в виду, что образуется белый осадок оксалата кальция (оксалат ионы C2O42- - наиболее чувствительный и наиболее важный реактив на присутствие ионов Са2+).
Аналогичные опыты провести с пробами воды, пропущенными через слой катионита КУ-2.
Объяснить наблюдаемые, факты. Сделать выводы.
Контрольные вопросы
1. Составить молекулярные и ионные уравнения реакций, происходящих при добавлении к раствору Са(НСО3)2 раствора NaOH, раствора Na2CO3.
2. Сколько гаммов соды Na2CO3 нужно прибавить для умягчения 100 л воды, имеющей жесткость 10 мг-экв/л?
3. Какова жесткость воды, содержащей в 1 л 0,6 г хлористого кальция?
4. Растворимость CaSO4 при обычных условиях составляет 8·I03 моль/л. Рассчитать жесткость насыщенного сульфата кальция.
5. В 250 мл воды содержится 4,60 мг ионов Са2+ и 2,40 мг ионов Mg2+. Определить общую жесткость воды.
6. Для определения общей жесткости воды взято 100 мл воды и на ее титрование израсходовано 15,40 мл трилона Б с N=0,06. Вычислить общую жесткость воды.
