
- •1.1)Электрохимия
- •2.1) Электрохим. Цепь
- •3.1) Законы электролиза (законы Фарадея)
- •4.1) Кулонометры и кулонометрия
- •5.1) Представления об эл-литической диссоциации, модель гротгуса, представления фарадея.
- •7.1) Теория Аррениуса, ионные равновесия, недостатки классической теории диссоциации.
- •8.1) Энергия ионной кристаллической решетки,модельный метод борна, уравнение борна-ланде. Анализ уравнения. Константа маделунга (хлорид натрия).
- •2.1) Термодинамическое описание равновесий в растворе, связь хим. Потенциала и активности.
- •2.2) Активность и коэффициент активности электролитов. Ионная сила раствора. Распределение ионов в растворе
- •2.3) Теория электролитов дебая и гюккеля.
- •2.4) Применение теории Дебая-Хюккеля к слабым электролитам
- •2,5) Ионная ассоциация
- •2.6) Механизмы образования р-ров эл-литов, сольватация, гидратация кат, ан, м-л. Числа сольватации. Корреляционные подходы к сравнению р-лей. Их хар-ки.
- •2.7) Полиэлектролиты
- •2) Диффузия и ионов. Коэффициент диффузии. Определение, размерность, вывод первого закона Фика. Уравнение первого закона Фика для одномерной и трёхмерной диффузии.
- •4.3) Диффузионный потенциал. Уравнение для диффузионного потенциала. Эффективный коэффициент диффузии электролита. Способы устранения диффузионного потенциала.
- •7)Предельные электропроводности ионов. Формула Стокса. Правило Вальдена-Писаржевского. Формула Стокса-Эйнштейна.
- •8)Основы теории Дебая-Хюккеля-Онзагера
- •9) Эффекты Вина и Дебая-Фалькенгагена, релаксационный, элкектрофоретический.
- •10)Представления о переносе заряда в неводных растворах,ионных расплавах и твёрдых электролитах.
5.1) Представления об эл-литической диссоциации, модель гротгуса, представления фарадея.


6.1) классические методы исследования растворов эл-литов. Измерение осмотического давления, давления пара над раствором, криоскопия, эбулиоскопия, тепловой эффект реакции нейтрализации, корреляция между каталитическим действием кислот и их электропроводностью.





7.1) Теория Аррениуса, ионные равновесия, недостатки классической теории диссоциации.



Преимущества:
Получили объяснение коллигативные свойства растворов электролитов
понижение температуры замерзания;
повышение температуры кипения;
осмотическое давление.
Объяснено постоянство теплот нейтрализации сильных кислот и оснований.
Недостатки
Степень диссоциации, определенная разными методами, может быть различной.
Для концентрированных растворов экспериментальное значение степени диссоциации может превышать единицу.
Константа диссоциации, определенная по Аррениусу, для сильных электролитов зависит от концентрации.
Не указаны причины ионизации электролитов в растворе.
Пренебрежение ион-дипольным взаимодействием делает невозможным объяснить процесс образования ионов и устойчивость ионных систем, ведь именно это взаимодействие является физической основой образования ионов в растворе при растворении электролита.
8.1) Энергия ионной кристаллической решетки,модельный метод борна, уравнение борна-ланде. Анализ уравнения. Константа маделунга (хлорид натрия).






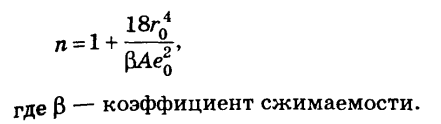

9.1)Энергия сольватации, Энергия сольватации по борну, модель борна для сольватации вывод уравнения борна и борна-бьеррума. Расчет свободной энергии гиббса гидратации по фрумкину, энтропия сольватации.


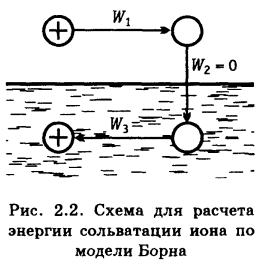


Энтропия сольватации

Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса.
NaCl
(кр)
![]() Na+(газ) + Cl–(газ)
Na+(газ) + Cl–(газ)
 HL
Hs+
Hs–
HL
Hs+
Hs–
Na+ (aq) + Cl– (aq)
HNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: Gp = HNaCl – TS; при 298К TS составляет приблизительно 15 кДж/моль);
HL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли;
Hs+ , Hs– – теплоты сольватации катиона и аниона.
Из этого цикла для теплоты сольватации хлорида натрия получаем:
HsNaCl = Hs+ + Hs– = HL – HNaCl = 4 – 772 = – 768 кДж/моль.
Данное уравнение позволяет найти теплоту гидратации, если известны теплоты растворения и энергия решетки. Теплоты растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины.
Полученное значение достаточно хорошо согласуется с энергией решетки, подсчитанной по уравнению Борна.
Фрумкин


