
- •Предмет, содержание и задачи «Неорганической химии»
- •Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •Химия и переработка продуктов общественного питания.
- •Основные химические законы. Химический эквивалент. Закон эквивалентов. Определение молярных масс газов.
- •5.Уровни структурной организации материи. Двойственная природа микрочастиц (принципы и постулаты квантовой механики)
- •6.Характеристика состояния электрона в атоме. Правила и порядок заполнения атомных орбиталей.
- •7.Периодическая система химических элементов им. Д. И. Менделеева.
- •8.Целостные свойства атомов - масса, размер, устойчивость, их изменение по периодам и группам.
- •9.Природа и образование химической связи: метод молекулярных орбиталей (ммо). Энергия и длина связи.
- •10.Природа и образование химической связи: метод валентных связей (мвс). Ковалентная связь. Свойства ковалентной связи. Неполярная и полярная ковалентная связь.
- •12.Ионная связь. Свойства ионной связи. Свойства веществ с ионным типом связи.
- •13.Межмолекулярные взаимодействия: электростатическая, донорно-акцепторная, водородная связь и их влияние на свойства веществ.
- •14.Строение вещества в конденсированном состоянии. Зависимость физических свойств от типа химической связи в молекулах, между молекулами и ионами.
- •15.Комплексные соединения: состав, номенклатура и классификация. Применение и значение комплексных соединений.
- •16.Теории химической связи в комплексных соединениях: мвс, ммо и теория кристаллического поля (ткп).
- •18.Растворы и их классификация. Способы выражения состава растворов. Идеальные и неидеальные растворы.
- •19.Растворы электролитов. Слабые и сильные электролиты. Ионные реакции в растворах электролитов.
- •20.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Значение pH в производстве пищевых продуктов и непродовольственных товаров.
- •21.Гидролиз солей. Типичные случаи гидролиза солей.
- •22.Буферные растворы. Значение буферных растворов в природе и технике.
- •23.Понятие термодинамической системы. Функции состояния. Тепловой эффект химических процессов и изменение энтальпии.
- •24.Понятие об энтропии. Направленность химических процессов.
- •25.Скорость химических реакций: общие понятия, закон действующих масс, правило Вант-Гоффа и уранение Аррениуса.
- •26.Химическое равновесие, принцип Ле Шателье.
- •29.Свойства неметаллов и их соединений. Электронная структура неметаллов. Сродство к электрону. Электроотрицательность. Изменение свойств неметаллов по периодам и группам.
- •33.Химические свойства металлов. Сравнительная активность металлов. Коррозия металлов. Влияние различных факторов на скорость коррозии. Методы борьбы с коррозией.
- •34.Металлы и их соединения в производстве продуктов общественного питания. Макро и микроэлементы. Ксенобиотики.
- •Предмет, содержание и задачи «Неорганической химии»
- •2.Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •3.Химия и переработка продуктов общественного питания.
20.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Значение pH в производстве пищевых продуктов и непродовольственных товаров.
Электролитическая диссоциация воды:
Вода представляет собой слабый амфотерный электролит:
Н2О Н+ + ОН-
и![]() ли,
более точно:
ли,
более точно:
2Н2О Н3О+ + ОН-
Константа диссоциации воды при 25оС равна:
Такое значение
константы соответствует диссоциации
одной из ста миллионов молекул воды,
поэтому концентрацию воды можно считать
постоянной и равной 55,55 моль/л (плотность
воды 1000 г/л, масса 1 л 1000 г, количество
вещества воды 1000г:18г/моль=55,55 моль,
С=55,55 моль: 1 л =55,55 моль/л). Тогда
![]()
Эта величина
постоянная при данной температуре
(25оС), она называется ионным произведением
воды KW:
![]()
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13.
В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой:
[H+] = [OH-] = 10-7 моль/л
Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Ионное произведение воды:
Ионное произведение воды - произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH— в воде или в водных растворах: KB = [Н+] [ОН—].
Вода является очень слабым амфотерным электролитом:
2H2 « H3O+ + OH- ; D H° » 56 кДж.
Свободные ионы водорода H не способны к существованию в водном растворе - они мгновенно гидратируются водой до катионов оксония (H3O+). Однако, для простоты записи часто используют обозначение H+:
H2O « H+ + OH-.
К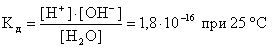 онстанта
диссоциации воды равна:
онстанта
диссоциации воды равна:
В воде и разбавленных водных растворах
электролитов молярная концентрация
воды практически постоянна и равна
воде и разбавленных водных растворах
электролитов молярная концентрация
воды практически постоянна и равна
где 1000 - масса 1 л воды, г; 18 - молярная масса воды, г/моль.
Поэтому можно считать постоянным произведение:
KВ·[H2O] = [H+]·[OH-] = 1,8·10-16·55,6 = 1·10-14 (моль/л)
Водородный показатель.
Водородный показатель - (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. pH = -log[H+].
Водоромдный показамтель, pH - это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
Методы определения значения pH:
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
