
- •Лекция 12 карбоновые кислоты
- •1. Классификация, номенклатура, изомерия.
- •2. Способы получения
- •2.1. Промышленные способы
- •2.4. Карбоксилирование металлорганических соединений
- •3. Физические свойства
- •4.1. Кислотные свойства карбоновых кислот
- •4.2. Реакции, сопровождающиеся разрывом связи о-н
- •4.3. Реакции, сопровождающиеся разрывом связи с-о.
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе.
- •4.5. Реакции замещения атома водорода у α-углеродного атома.
- •4.6. Свойства производных карбоновых кислот.
- •4.6.1. Гидролиз производных карбоновых кислот.
- •4.6.2. Реакции ацилирования.
- •4.6.3. Реакция переэтерификации
- •4.7. Особые свойства непредельных одноосновных кислот и их производных
- •4.8. Особые свойства двухосновных предельных кислот
- •4.9. Двухосновные непредельные кислоты
- •4.10. Свойства ароматических карбоновых кислот
4.1. Кислотные свойства карбоновых кислот
при кислотной диссоциации карбоновой кислоты образуется карбоксилат-анион RCOO- , для которого можно записать резонансные структуры:

Резонансная стабилизация карбоксилат-иона причина того, что карбоновые кислоты являются кислотами средней силы. Электроноакцепторные заместители в молекуле карбоновой кислоты, оттягивающие электронную плотность от карбоксилат –аниона, увеличивают кислотность. Соответственно электронодонорные заместители оказывают противовоположное влияние. Заместитель особенно сильно влияет, если находится у α-углеродного атома. По мере удаления заместителя от карбоксильной группы его влияние уменьшается. Например:

4.2. Реакции, сопровождающиеся разрывом связи о-н
Карбоновые кислоты способны образовывать соли по реакциям с металлами, оксидами, гидроксидами и карбонатами:

Пиролизом и электролизом натриевых солей карбоновых кислот получают углеводороды, пиролизом кальциевых или бариевых солей получают карбонильные соединения.
Кроме того, карбоксилат-анион способен вступать в реакции нуклеофильного замещения с галогеноалкилами:

4.3. Реакции, сопровождающиеся разрывом связи с-о.
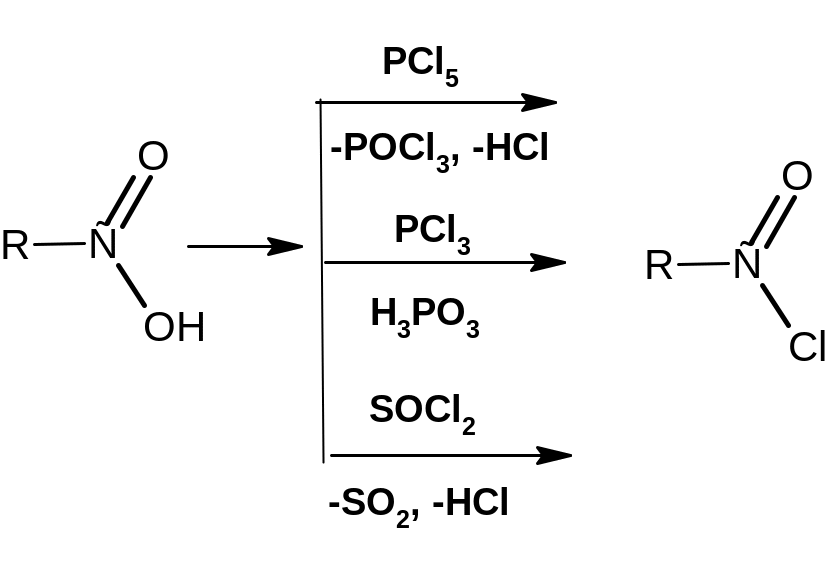
При действии галогенидов фосфора и хлорангидридов серы на карбоновые кислоты получаются галогенангидриды карбоновых кислот:
При дегидратации кислот или при взаимодействии солей кислот с хлорангидридами образуются ангидриды кислот:
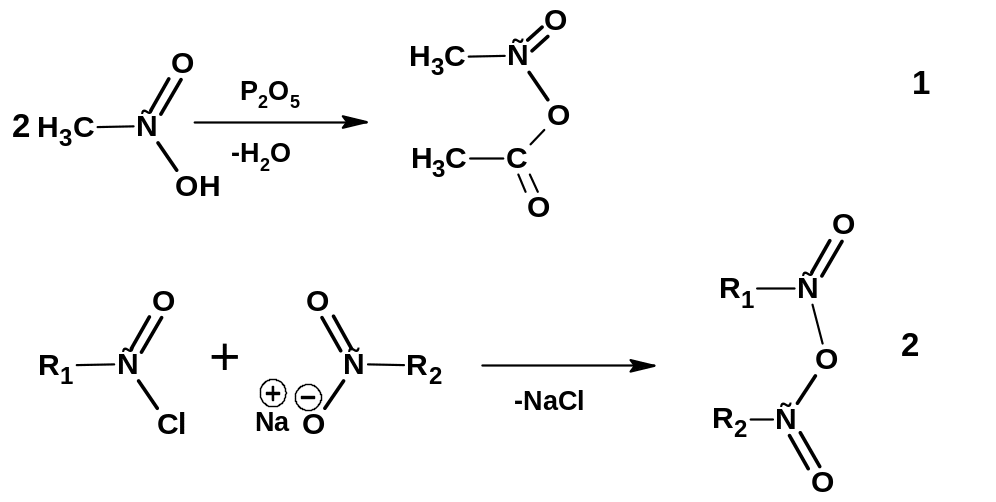
Первый способ применим для уксусной кислоты. Второй способ является универсальным.
При пропускании паров кислот вместе с аммиаком над дегидрирующим катализатором образуются амиды кислот:

Особенным свойством карбоновых кислот является реакция образование сложных эфиров - реакция этерификации:

Механизм реакции включает следующие стадии:

4.4. Реакции нуклеофильного присоединения по карбонильной группе.
Примером реакции нуклеофильного присоединения по карбоксильной группе является реакция восстановления карбоновых кислот литийалюминийгидридом:

Продуктом восстановления являются спирты.
4.5. Реакции замещения атома водорода у α-углеродного атома.
Реакция Гелля-Форльгарда-Зелинского.
Реакция заключается в хлорировании или бромировании карбоновой кислоты по α-углеродному атому. Реакция заключается в воздействии на карбоновую кислоту элементарных хлора или брома в присутствии фосфора:

4.6. Свойства производных карбоновых кислот.
Способы получения производных карбоновых кислот сводятся к химическим свойствам самих кислот.
4.6.1. Гидролиз производных карбоновых кислот.
Производные карбоновых кислот способны подвергаться гидролизу в кислой или щелочной среде с образованием соответствующей кислоты или ее соли:

Реакция гидролиза указывает на обратимый характер реакции нкуклеофильного замещения при карбоксильной группе. Причем прямая реакция протекает только в кислой среде, а обратная может протекать как в кислой, так и щелочной.
4.6.2. Реакции ацилирования.
Хлорангидриды карбоновых кислот и их ангидриды являются так называемыми ацилирующими реагентами. С их помощью можно вводить ацильную группу. Примером являются реакции Фриделя-Крафтса, в ходе которых ацильная группа вводится в ароматическое ядро. Примером ацилирования является реакция между хлорангидридом и солью карбоновой кислоты, рассмотренная выше.
Кроме того, ацилировать можно спирты, аммиак, амины:

Реакции ацилирования спиртов, аммиака и аминов протекают в присутствии каталитических количеств кислоты по тетраэдрическому механизму нуклеофильного замещения при карбоксильной группе.
