
- •Содержание contents
- •Онкологические заболевания органов мочеполовой системы
- •1.1. Эпидемиология
- •1.2. Этиология, факторы риска
- •1.3. Профилактика
- •1.4. Скрининг
- •1.5. Топографическая и клиническая анатомия предстательной железы
- •1.6. Патоморфологическая характеристика рака предстательной железы
- •1.7. Экстрапростатическое распространение опухоли
- •1.8. Международная классификация рака предстательной железы по системе tnm
- •1.9. Диагностика рака предстательной железы
- •1.9.1. Методы диагностики отдаленных метастазов
- •1.9.2. Диагностика и степень распространенности опухолевого процесса
- •1.9.3. Клинические проявления ограниченного и местно распространенного рака предстательной железы
- •1.10. Клинические проявления диссеминированного рака предстательной железы
- •1.11. Оценка степени распространенности рака предстательной железы
- •1.12. Прогноз
- •1.13. Лечение рака предстательной железы
- •1.13.1. Выжидательная тактика
- •1.13.2. Радикальная простатэктомия
- •1.13.3. Неоадъювантная гормонотерапия
- •1.13.4. Адъювантная гормонотерапия
- •1.13.6. Альтернативные методы лечения локализованного рака предстательной железы
- •1.14. Контрольные вопросы
- •1.15. Тестовые задания
- •1.16. Рекомендуемая литература
- •2.1. Эпидемиология
- •2.2. Факторы риска
- •2.3. Патоморфологическая характеристика рака яичка
- •2.4. Клинические проявления
- •2.5. Диагностика рака яичка
- •Уровень хгт и альфа-фп в зависимости от нозологической формы опухоли яичка
- •2.6. Международная классификация рака предстательной железы по системе tnm
- •2.7. Лечение рака яичка
- •2.8. Контрольные вопросы
- •2.9. Тестовые задания
- •2.10. Рекомендуемая литература
- •3.1. Эпидемиология
- •3.2. Патоморфологическая характеристика рака яичка
- •3.3. Диагностика рака яичка
- •3.3.1. Рекомендации по диагностике рака полового члена
- •3.4. Международная классификация рака полового члена по системе tnm
- •3.5. Лечение рака полового члена
- •3.5.1. Первичная опухоль
- •3.5.2. Регионарные метастазы
- •3.5.3. Рекомендации по лечению рака полового члена
- •3.5.4. Качество жизни
- •3.5.5. Технические аспекты оперативного лечения рака полового члена
- •3.5.6. Химиотерапия
- •3.5.7. Прогностические факторы
- •3.6. Диспансеризация
- •3.6.1. Рекомендации по диспансеризации больных раком полового члена
- •3.7. Контрольные вопросы
- •3.8. Тестовые задания
- •3.9. Рекомендуемая литература
- •4.1. Эпидемиология
- •4.2. Этиология и патогенез
- •4.3. Патоморфологическая характеристика рака почки
- •4.4. Метастазирование рака почки
- •4.5. Спонтанная регрессия
- •4.6. Диагностика рака почки
- •4.7. Дифференциальная диагностика рака почки
- •4.8. Клинические проявления рака почки
- •4.9. Классификация рака почки
- •4.10. Прогноз
- •4.11. Хирургическое лечение рака почки
- •4.11.1. Хирургическое лечение локального рака почки
- •4.11.2. Выбор хирургического доступа
- •4.11.3. Хирургическое лечение местно распространенного рака почки
- •I. Опухолевое распространение на магистральные сосуды
- •II. Опухолевое распространение на соседние органы
- •III. Хирургическое лечение отдаленных метастазов
- •4.11.4. Паллиативные хирургические вмешательства
- •4.11.5. Осложнения при хирургическом лечении рака почки
- •4.11.6. Органосохраняющее лечение при раке почки
- •4.11.7. Эндоскопические операции
- •4.11.8. Хирургическое лечение солитарных и единичных метастазов рака почки
- •4.11.9. Хирургическое лечение местных рецидивов после нефрэктомии
- •4.12. Лекарственное лечение метастатического рака почки
- •4.13. Лучевая терапия
- •4.14. Контрольные вопросы
- •4.15. Тестовые задания
- •4.16. Рекомендуемая литература
- •5.7. Контрольные вопросы
- •5.8. Тестовые задания
- •5.9. Рекомендуемая литература
- •6.1. Эпидемиология
- •6.2. Факторы риска
- •6.3. Патоморфологическая характеристика
- •6.4. Классификация tnm
- •6.5. Клиническая картина
- •6.6. Диагностика опухолей мочевого пузыря
- •6.7. Лечение рака мочевого пузыря
- •6.7.1. Лечение поверхностного переходно-клеточного рака мочевого пузыря
- •6.7.2. Лечение инвазивного рака мочевого пузыря
- •6.7.3. Сравнительная оценка органосохраняющих и органоуносящих методов хирургического лечения рака мочевого пузыря
- •6.7.4. Вопросы пластики и протезирования мочевого пузыря
- •6.8. Лечение инвазивного рмп
- •6.9. Лучевая терапия
- •6.10. Генерализованный рак мочевого пузыря
- •6.11. Контрольные вопросы
- •6.12. Тестовые задания
- •6.13. Рекомендуемая литература
- •Первый вариант
- •Второй вариант
- •Глоссарий
- •Интернет ресурсы
- •Онкологические заболевания органов мочеполовой системы
- •644043 Г. Омск, ул. Ленина, 12; тел. 23-05-98
1.13.6. Альтернативные методы лечения локализованного рака предстательной железы
Криотерапия. Предстательная железа замораживается с помощью нескольких криозондов, введенных чрез кожу под контролем УЗИ (рис. 10). Принято использовать пять зондов: два вводят спереди и медиально, два сзади и латерально и один сзади. Большинство авторов рекомендуют проводить два цикла замораживания и оттаивания. Если верхушка предстательной железы не попала в зону замораживания во время сеансов, во время извлечения зондов проводят третий цикл замораживания-оттаивания. Температура по краям замороженного участка колеблется от 0 до -2о С. Поскольку клетки погибают при температуре от -25 до -50о С, на самом деле разрушается несколько миллиметров ткани внутрь замороженного участка и точно определить границы деструкции по УЗИ невозможно. После двукратного замораживания-оттаивания разрушается более обширный участок. Теоретически при этом границы некроза приближаются к границам замороженного участка.

Рис. 10. Криотерапия при раке предстательной железы.
Лазеротерапия. Основана на трансформации световой энергии лазерного луча в тепловую, в результате чего температура внутри железы может на несколько секунд достигать 60о С. На фоне этой температуры возникает денатурация белковых структур клеток и гибель. Глубина проникновения светового лазерного луча зависит от длины волны. Открытие гибких световодов позволило более точно подводить и фокусировать лазерный луч на предстательной железе. Sander и Beisland впервые применили неодимовый лазер (Nd:YAGLaser) для лечения больных с локализованным раком простаты. Излучение этого лазера продуцирует равномерную коагуляцию на глубине 3-4 мм. Зона некроза покрывается фибрином с минимальным рубцеванием.
Гипертермия является методом термической деструкции различных тканей, предположительно обладающим селективным цитотоксическим действием на опухолевые клетки. Хотя до конца механизм подобного действия не определен, существует теория о разрушающем воздействии повышенной температуры на измененные опухолевые сосуды. Кроме того, на опытных моделях выявлена повышенная чувствительность именно опухолевых клеток к повышению температуры. При РПЖ локальная гипертермия может быть выполнена с использованием трансректального доступа. По данным других авторов, у ряда пациентов с РПЖ после проведения гипертермии простаты отмечено прогрессирование заболевания, что, однако, может быть обусловлено недостаточно тщательным отбором пациентов для данного метода.
Гипертермия как вспомогательный метод лечения пациентов с локализованным раком простаты может быть допустим на ранней стадии опухолевого процесса. На сегодняшний день практически невозможно оценить истинную эффективность методики, так как ни в одном из исследований гипертермия не была проведена в самостоятельном варианте в качестве основного вида лечения.
Высокоинтенсивная сфокусированная ультразвуковая аблация простаты (HIFU) – один из малоинвазивных методов лечения рака предстательной железы (рис. 11).

Рис. 11. Этапы проведения HIFU- терапии.
Исследования по изучению воздействия сфокусированных ультразвуковых волн были начаты в 1989 году во Франции, в Лионе. В течение 10 лет метод проходил клинические испытания и получил европейский сертификат. В Европе этим методом пролечено уже более 9000 больных раком простаты. HIFU используется не только в европейских странах (Франции, Германии, Италии и др.), но и в Канаде, Южной Корее. В настоящее время проходят испытания в США.
HIFU-терапия показана больным локализованным раком простаты стадии Т1-Т2, которым не может быть проведена радикальная простатэктомия (по возрасту, соматическому статусу) или в случае отказа больного от оперативного вмешательства по тем или иным причинам. Методика также может использоваться у больных с местным рецидивом после наружной лучевой терапии и радикальной простатэктомии.
Операция выполняется в положении на правом боку под спинальной анестезией на специально оборудованном столе фирмы EDAP (рис. 12).
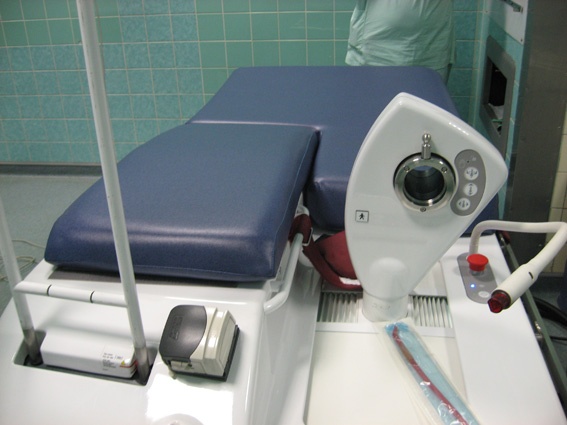
Рис. 12. Стол для проведения HIFU-терапии.
Через прямую кишку устанавливается датчик, излучающий высокоинтенсивные, конвергирующие (сходящиеся) ультразвуковые волны. В определенной точке, где происходит фокусирование лучей, повышается температура (от 85 до 100о С), разрушающая клетки, и возникает эффект кавитации. Зона разрушения при каждом воздействии 24 мм по высоте и менее 2 мм в диаметре. Повторяя импульсы и одновременно перемещая датчик, специалист последовательно разрушает всю ткань предстательной железы с опухолью (для этого требуется примерно 400-600 импульсов). Процедура занимает около 2-3 часов.
Непосредственно после воздействия агрессивных ультразвуковых лучей развивается отек ткани предстательной железы за счет некроза, что требует постоянного дренирования мочевого пузыря на период в среднем 7 дней. Для этого в мочевой пузырь устанавливается по уретре катетер или в некоторых случаях ставится цистостома.
Почти всем больным перед сеансом HIFU-терапии выполняется трансуретральная резекция простаты. Эта операция выполняется в один день непосредственно перед сеансом HIFU. Без разреза, через мочеиспускательный канал специальной петлей удаляется часть предстательной железы – так как это делается при аденоме простаты. Трансуретральная резекция (ТУР) простаты перед сеансом HIFU уменьшает объем предстательной железы, что делает последующую HIFU-терапию более радикальной. С предварительной ТУР предстательной железы процент осложнений после лечения, связанных с расстройствами мочеиспускания, значительно снижается.
Сразу после HIFU происходит пик нарастания ПСА, а затем в течение 3 месяцев уменьшение его до 0,1 нг/мл.
Абсолютными противопоказаниями являются выраженный проктит после лучевой терапии, утолщенная стенка прямой кишки (более 4 мм), пациенты после брахитерапии, предшествующие свищи в прямой кишке, инвазия опухоли в прямую кишку, отсутствие прямой кишки и ряд пациентов после лучевой терапии со склеротическими изменениями в органах малого таза.
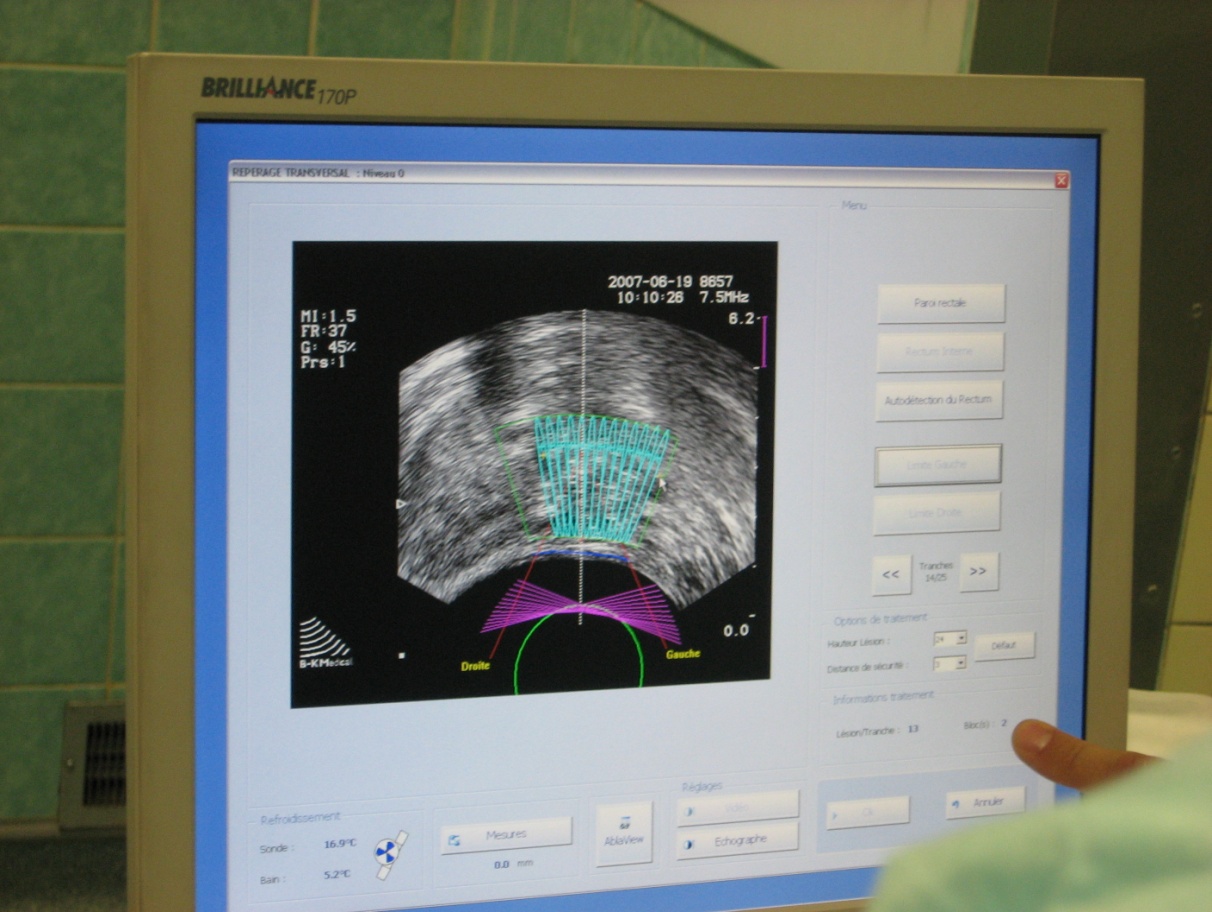
Рис. 13. Рабочее место врача. Сеанс HIFU-терапии.
Для точного определения показания или противопоказания к HIFU-терапии необходимо предварительное трансректальное ультразвуковое исследование (рис. 13) и другие общепринятые обследования при раке простаты. Прогноз лечения зависит от степени онкологического риска, который устанавливается по данным проведенного обследования.
1.13.7. Особенности лечения местно распространенного (T3-4N0M0 или T1-4N1M0) и диссеминированного рак предстательной железы
Основное место в лечении местно распространенного (T3-4N0M0 или T1-4N1M0) РПЖ принадлежит гормонотерапии и лучевой терапии. Большинству больных раком предстательной железы с Т3 проводят неоадьювантную гормональную терапию с последующей лучевой терапией при необходимости. Сочетание 2-х методов значительно улучшает результаты лечения и безрецидивную выживаемость.
В стадии Т3-Т4 рекомендуется СОД 70 Гр на предстательную железу и 44-50 Гр на таз. При конформном (3D) облучении СОД может быть 76 Гр и больше без риска увеличения осложнений. Увеличение дозы лучевой терапии улучшает отдаленные результаты лечения. Облучение регионарных лимфатических узлов проводится во всех случаях, кроме тех, когда отсутствие метастазов в тазовых лимфоузлах доказано морфологически (pN0). Подробнее схемы гормонотерапии приведены далее.
Основное место в лечении диссеминированного РПЖ принадлежит гормональной терапии.
Цель гормонального лечения рака предстательной железы увеличение показателей выживаемости и улучшения качества жизни больных. Гормонотерапию как самостоятельный вариант проводят с паллиативной целью, но гормонопрепараты могут быть использованы в сочетании с радикальным оперативным и лучевым лечением как комбинированная противоопухолевая терапия.
В основе механизма действия эндокринного лечения лежит снижение концентрации тестостерона в клетках предстательной железы, которое может быть реализовано двумя механизмами:
1) подавление секреции андрогенов яичками (достигается снижение уровня сывороточного тестостерона);
2) конкурентное взаимодействие с андрогенными рецепторами в ядрах клеток предстательной железы (достигается снижение уровня внутриклеточной концентрации тестостерона).
Кастрация (хирургическая или медикаментозная). Билатеральная орхидэктомия является «золотым» стандартом в лечении больных метастатическим раком предстательной железы. Преимущества хирургической кастрации: быстрое снижение уровня тестостерона в сыворотке (в течение 3-12 часов), технически несложная операция, низкие затраты на лечение. Двусторонняя орхидэктомия эффективна у 80-85% больных первично выявленным гормонально чувствительным РПЖ. Основные побочные эффекты и осложнения хирургической кастрации: эректильная дисфункция, приливы, остеопороз, мышечная атрофия, нарушения липидного обмена, гинекомастия, нервно-психические расстройства. Побочные эффекты двусторонней орхидэктомии существенно ухудшают качество жизни больных РПЖ. Кроме того, хирургическая кастрация не позволяет проводить у больного интермиттирующую андрогенную блокаду.
Показаниями к хирургической кастрации являются:
1) локализованный РПЖ (Т1-2N0M0) при невозможности проведения радикального лечения; 2) местно распространенный РПрЖ (T3-4N0M0) в качестве самостоятельного лечения или адьювантной или неоадьювантной терапии до и после оперативного или лучевого лечения; 3) метастатический РПЖ.
Медикаментозная кастрация осуществляется путем использования агонистов ЛГРГ синтетических аналогов нативного гипоталамического релизинг-гормона лютеинизирующего гормона. В основе механизма действия агонистов ЛГРГ лежит десенсибилизация рецепторов к рилизинг-гормону, ведущая к снижению продукции лютеинизирующего гомона гипофиза и в дальнейшем к снижению выработки тестостерона клетками Лейдига в яичках. После введения агонистов ЛГРГ отмечают кратковременное повышение концентрации тестостерона на 3-5 день (синдром вспышки) с последующим снижением ее до посткастрационного уровня на 21-28 день. Для профилактики синдрома вспышки у пациентов с метастатическим РПЖ перед введением агониста ЛГРГ и в течение 1-й недели терапии следует назначать антиандрогены. Побочные эффекты и осложнения терапии агонистами ЛГРГ такие же, как при хирургической кастрации.
Показания к применению агонистов ЛГРГ:
1) локализованный РПЖ (Т1-2N0M0) при невозможности проведения радикального лечения или в качестве неоадьювантной терапии перед проведением радикального лечения или лучевым лечением; 2) местно распространенный РПЖ (T3-4N0M0) в качестве самостоятельного лечения или адьювантной или неоадьювантной терапии до и после оперативного или лучевого лечения; 3) метастатический РПЖ.
В настоящее время для лечения РПЖ применяют следующие агонисты ЛГРГ: гозерелин (золадекс) 3,6 мг и 10,8 мг, диферелин 3,75 мг, бусерелин 3,75 мг. Лечение агонистами ЛГРГ проводят длительно до развития рефрактерности к гормональному воздействию. Некоторые авторы рекомендуют применение агонистов ЛГРГ в режиме интермиттирующей терапии, но эффективность интермиттирующей терапии не доказана.
Монотерапия антиандрогенами. К антиандрогенам относятся стероидные и нестероидные препараты. В основе механизма действия стероидных антиандрогенов лежит не только блокирование андрогенных рецепторов в клетках предстательной железы, но и центральное прогестиноподобное действие, что приводит к снижению сывороточной концентрации тестостерона, дегидротестостерона и ЛГРГ. К стероидным антиандрогенам относятся ципротерон, мегастрол и хлормадинон.
Ципротерон назначают в комбинации с хирургической или медикоментозной кастрацией в дозе 100-150 мг перорально ежедневно, в виде монотерапии 250-300 мг перорально ежедневно.
Побочные эффекты стероидных антиандрогенов: сердечно-сосудистые осложнения, гинекомастии, болезненность грудных желез, гастроинтестинальные расстройства.
Механизм действия нестероидных (чистых) антиандрогенов связан с конкурентным взаимодействием с андрогенными рецепторами и их ингибированием. При применении нестероидных антиандрогенов в режиме монотерапии концентрация сывороточного тестостерона возрастает. К нестероидным антиандрогенам относят флутамид, нилутамид, бикалутамид.
Показания к назначению антиандрогенов:
1) локализованный РПЖ (Т1-2N0M0) при невозможности проведения радикального лечения; 2) местно распространенный РПЖ (T3-4N0M0) в качестве самостоятельного лечения или адьювантной или неоадьювантной терапии до и после оперативного или лучевого лечения; 3) метастатический РПЖ.
Флутамид назначают по 250 мг 3 раза в сутки перорально. Препарат применяют в режиме максимальной андрогенной блокады, реже в режиме монотерапии. Побочные эффекты флуцинома: гастроинтестинальные расстройства (диарея, тошнота, рвота), гинекомастия, нарушение функции печени, снижение либидо.
Бикалутамид в режиме максимальной андрогенной блокады назначают в дозе 50 мг перорально ежедневно. В режиме монотерапии в дозе 150 мг для лечения больных с гормонорефрактерным РПЖ, при этом качество жизни пациентов и сексуальная функция достоверно лучше. Побочные эффекты бикалутамида: гинекомастия, болезненность грудных желез, гастроинтестинальные расстройства (редко).
Монотерапия эстрогенами. В основе механизма действия эстрогенных препаратов лежит блокирование по механизму обратной связи синтеза ЛГ и ФГ, что приводит к снижению концентрации тестостерона в сыворотке. Кроме того, эстрогены оказывают прямое ингибирующее действие на яички. Исторически эстрогены являются первой группой гормональных препаратов, которые стали применять для лечения больных с РПЖ. Однако эстрогенные препараты обладают выраженными побочными свойствами, наиболее опасным из которых является кардиотоксичность, существенно ограничивающая применение эстрогенов в клинической практике.
Побочные реакции и осложнения эстрогенотерапии: тромбоэмболические осложнения, сердечно-сосудистые осложнения, отеки, эректильная дисфункция, снижение либидо, гинекомастия и болезненность грудных желез, гастроинтестинальные расстройства (диарея, тошнота, рвота), нарушение функций печени.
Показания к применению эстрогенов:
1) метастатический РПЖ; 2) вторая линия гормонотерапии после прогрессирования опухолевого процесса на фоне хирургической кастрации, лечения агонистами ЛГРГ или антиандрогенами.
Наиболее эффективный препарат из группы эстрогенов диэтилстильбэстрол, его назначают в дозе 1 или 3 мг ежедневно внутримышечно. Пероральное применение препарата в дозе 5 мг/сут приводит к высокой кардиоваскулярной токсичности. При сравнении эффективности двусторонней орхидэктомии, терапии агонистами ЛГРГ и эстрогенами получены одинаковые показатели выживаемости и длительности ремиссии.
Максимальная андрогенная блокада (сочетание хирургической и медикаментозной кастрации с назначением антиандрогенов). Комбинированная блокада андрогенов – сочетание агонистов LHRH с антиандрогенами или орхиэктомии с антиандрогенами. Орхэктомия и комбинированная блокада андрогенов являются стандартными методами лечения метастатического рака предстательной железы. Комбинированная блокада андрогенов (максимальная андрогенная блокада) назначается пациентам с метастатическим РПЖ в течение первых 6 месяцев лечения для более быстрого достижения эффекта, в последующем антиандрогены могут быть отменены.
Интермиттирующая гормонотерапия. У пожилых людей с большим количеством сопутствующих заболеваний и плохим прогнозом при отсутствии клинического проявления рака простаты лечение опухоли целесообразно начинать по мере появления клинической симптоматики. У отдельных больных благодаря гормональной терапии проходят симптомы болезни, показатель ПСА снижается до нормальных цифр, или при плохой переносимости препаратов – в подобной ситуации целесообразно сделать перерыв и лечение вновь начать по мере появления клинических признаков болезни и повышения ПСА. Теоретически этот метод лечения должен иметь определенные преимущества, как, например, периодическое восстановление уровней тестостерона в плазме и восстановление половой активности, снижение риска сердечно-сосудистых осложнений. Лечение начинают с комбинированной андрогенной блокады и продолжают минимум 6 месяцев, пока уровни ПСА не снижались до стойкого минимума. Затем лечение отменяли, пока уровни ПСА не снижались до стойкого минимума. Затем лечение отменяли, пока уровни ПСА не возрастали в среднем до 10-20 мкг/литр. Такой цикл «лечение + перерыв» повторяют, пока изменения ПСА не утрачивали зависимости от уровня андрогенов.
При гормонорефрактерном раке предстательной железы, для которого характерен рост уровня ПСА в сыворотке крови и/или наличие каких-либо других признаков прогрессирования заболевания при адекватной андрогенной блокаде с подтвержденным достоверным кастрационным уровнем тестостерона, стандартов в лечение нет.
Перечисленные методы равноценны, возможности их ограничены, и выживаемость они увеличивают в лучшем случае на 3-4 месяца. (МАБ, интермиттирующая гормонотерапия, антиандрогенная терапия 2-й линии, применение ЛС, ингибирующих андрогены надпочечников, антиэстрогенная терапия, химиотерапия).
Рак простаты является в большинстве своем андрогенозависимой опухолью. Известно также, что с течением времени эта опухоль становится андрогенонезависимой. Критериями эффективности проводимого лечения считаются улучшение самочувствия, уменьшение болевого синдрома и снижение уровня ПСА. Это может быть достигнуто назначением второй линии гормональной терапии при андрогенорезистентном раке предстательной железы или применением химиотерапии.
Наиболее эффективными схемами полихимиотерапии являются:
1) паклитаксел 135 мг/м2 в/в (1-й день) + эстрацит 250 мг внутрь 2 раза в день (1-6-й дни);
2) доксорубицин 50 мг/м2 в/в + цисплатин 50 мг/м2 в/в (1-й день);
3) митоксантрон 12 мг/м2 в/в (1-й день), преднизолон 5 мг внутрь 2 раза в день постоянно.
Интервалы между курсами – 4 недели.
Симптоматическая терапия. Одним из направлений в лечении больных диссеминированным РПЖ является улучшение «качества жизни», для чего в последнее время широко используется большое количество методов.
У больных с метастатическим поражением костного скелета чаще всего основным симптомом являются боли. Болевой синдром часто является причиной значительного физического и психологического стресса, и обезболивающий эффект является важной частью в процессе лечения. Ослабление метастатических болей становится особенно актуальным у больных раком предстательной железы, продолжительность жизни которых может быть значительно продлена в далеко зашедших стадиях, но качество жизни у них часто остается очень плохим, особенно в заключительных стадиях. Устранение болевого синдрома является очень сложной задачей в силу различных факторов, которые могут служить его причиной.
В настоящее время считается, что в 60-90% случаев причиной боли является непосредственно опухоль или метастазы, приблизительно в 5-20% имеются опухоль ассоциированные боли, в 10-25% случаев причиной боли является следствие проведенного лечения – химиотерапии, облучения, хирургических вмешательств, и в 3-10% случаев боли не связаны с опухолью.
Лечение боли у онкологических больных проводится в соответствии с рекомендациями ВОЗ. Терапия состоит из 4 уровней:
1-й уровень – неопиоидные препараты;
2-й уровень – неопиоидные препараты + слабые опиоиды;
3-й уровень – неопиоидные препараты + сильные опиоиды;
4-й уровень – инвазивные методы обезболивания (спинальная анальгезия, использование подкожных аппликаторов).
Неопиоидные препараты: нимесулид, ксифокам и другие.
Слабые опиоиды: дигидрокодеин в разовой дозе 60-90 мг через 8-12 часов (максимальная суточная доза 240 мг), трамадол в разовой дозе 50-100 мг через 3-5 часов (максимальная суточная доза 400 мг). Возможна комбинация с препаратами первой линии.
Сильные опиоиды: препараты морфина. Их применяют в таблетках, ректальных свечах, подкожно, внутривенно и перидурально по мере необходимости. Альтернативой могут служить бупренорфин по 0,2-1,2 мг через 6-8 часов (максимальная суточная доза 4,8 мг) или фентанил-TTS. Также возможна комбинация с препаратами первой линии обезболивания.
Четвертая линия подразумевает спинальное или эпидуральное обезболивание с введением анальгетиков через специальные катетеры. Наряду с препаратами опия рекомендуется назначать антидепрессанты и противосудорожные средства.
При неэффективности противоболевой медикаментозной терапии целесообразна локальная лучевая терапия в небольших дозах (до 20 Гр) на очаги наибольшей болезненности. В случаях компрессии спинного мозга, связанного с метастатическим поражением, применяются стероидные препараты (дексаметазон 4-25 мг через 6 часов) и локальная лучевая терапия на пораженный участок позвоночника. Кроме того, в ряде случаев возможно выполнение ламинэктомии для декомпрессии спинного мозга.
В последние годы для снятия болей нашел применение новый препарат метастрон (стронций-89 хлорид). Попытка использования различных радиофармпрепаратов для терапии метастазов в кости была предпринята много лет назад. Было показано, что стронций 89 (метастрон) локализуется в местах метастазирования рака предстательной железы, обеспечивая облегчение болевого симптома в результате избирательного излучения. Метастрон представляет собой инъекционный препарат (стерильный водяной раствор для внутривенного введения, содержащий разовую дозу 150 MBq {4 mCi} в 4 мл раствора), период полураспада – 50,5 дней, излучение – частицы с максимальной энергией 1.5 MeV, проникающая способность – 0-8 см.
Стронций имитирует обмен кальция и поэтому накапливается в костной ткани, особенно в местах усиленного обмена. Исследование препарата показало, что поврежденная метастазами костная ткань накапливает Sr гораздо больше, чем неизмененная. Накопление в скелете через 3 месяца варьирует от 11 до 88% в зависимости от степени поражения скелета. Исследования показали, что около 90% активности стронция выводится через почки. Почечный клиренс стронция у многих больных раком предстательной железы значительно ниже нормального уровня, возможно вследствие нарушенного гомеостаза кальция. Это является положительным моментом при лечении, так как большие фракции радионуклида могут откладываться в местах патологии. Наибольшая экскреция с мочой стронция наблюдается в течение первого и второго дня после инъекции, спустя неделю – менее 10%. В результате избирательного излучения удается избавить больного от сильных болей в 80% случаев в течение 6 месяцев, причем у тех больных, которым не помогали все другие методы обезболивания.
Обычно обезболивающий эффект достигается через 10-20 дней после инъекции, однако полностью он реализуется спустя 4-5 недель. Препарат вводится в амбулаторных условиях. Повторно можно применять через 3 месяца. У пациентов с неизмененным костным мозгом отмечалась небольшая токсичность, связанная с введением метастрона (лейкопения, тромбоцитопения), в связи с чем рекомендуется регулярный гематологический контроль. В редких случаях имеет место обострение болевого симптома непосредственно после инъекции, которое купируется через 48 часов. В подобных случаях целесообразно применение анальгетиков. Обострение болевого синдрома во всех случаях считается хорошим прогностическим признаком.
Прогноз. Прогноз РПЖ определяется стадией, на которой выявлено заболевание, а также степенью дифференцировки опухоли и уровнем ПСА. Пятилетняя безрецидивная выживаемость больных с РПЖ на I и II стадиях после проведения радикального лечения (радикальная простатэктомия, и лучевая терапия) составляет 70-90%, общая выживаемость 85-97%. При выявлении РПЖ на стадии метастатического процесса средний период до прогрессирования процесса на фоне лечения составляет 24-36 месяцев.
