
- •Глава 2. Элементы термодинамики
- •2.1. Термодинамический метод
- •2.2. Внутренняя энергия
- •2.3. Работа и количество тепла. Первый закон термодинамики
- •2.4. Работа при равновесном и неравновесном изменении объема системы
- •2.5. Теплоемкость
- •2.6. Теплоемкость молекулярного водорода
- •2.7. Основные термодинамические процессы
- •2.7.1. Изохорный процесс
- •2.7.2. Изобарный процесс
- •2.7.3. Изотермический процесс
- •2.7.4. Адиабатный процесс.
- •2.7.5. Политропные процессы.
- •2.8. Обратимые и необратимые процессы.
- •2.9. Круговые термодинамические процессы или циклы. Тепловые и холодильные машины
- •2.10. Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.11. Цикл Карно
- •2.12. Теоремы Карно
- •2.13. Равенство Клаузиуса. Энтропия
- •2.14. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа
- •2.15. Неравенство Клаузиуса. Общая формулировка второго закона термодинамики
- •2.16. Свободная энергия
- •2.17. Статистическое толкование энтропии
- •2.18. Формула Больцмана
2.16. Свободная энергия
Ранее было установлено, что количество
теплоты, получаемое системой в изохорном
процессе
![]() равно изменению ее внутренней энергии,
т. е.
равно изменению ее внутренней энергии,
т. е.
![]() (2.16.1)
(2.16.1)
а в изобарном процессе это количество теплоты равно изменению энтальпии
![]() (2.16.2)
(2.16.2)
где энтальпия . Изменение этих функций состояний (внутренней энергии и энтальпии) связано с тепловыми эффектами.
Посмотрим теперь с какой функцией состояния связана работа, совершаемая системой. Для этого из основного уравнения термодинамики для обратимых процессов (2.14.3)
![]() (2.16.3)
(2.16.3)
найдем работу, совершаемую системой в
изотермическом процессе
![]()
![]() (2.16.4)
(2.16.4)
Величину
![]() называют свободной энергией системы,
которая является функцией состояния
системы, т. к.
называют свободной энергией системы,
которая является функцией состояния
системы, т. к.
![]() и
– функции состояния. Таким образом,
и
– функции состояния. Таким образом,
![]() (2.16.5)
(2.16.5)
или через энтальпию
![]() (2.16.6)
(2.16.6)
После интегрирования выражения (2.16.4), получаем
![]() (2.16.7)
(2.16.7)
т. е. работа при обратимом изотермическом процессе равна убыли сво-бодной энергии. При этом, чем больше энтропия системы, тем меньше ее свободная энергия, тем меньше работа (2.16.7) и тем больше обесценена внутренняя энергия системы. Из выражения (2.16.5) находим
![]() (2.16.8)
(2.16.8)
т. е. внутренняя энергия состоит из двух
частей: свободной энергии, ко-торая при
изотермических процессах расходуется
на работу, и другой части
![]() ,
которая выделяется в виде теплоты, и в
работе не участвует. Часть
внутренней энергии называют связанной
энергией.
,
которая выделяется в виде теплоты, и в
работе не участвует. Часть
внутренней энергии называют связанной
энергией.
Из формулы (2.15.8), выражающей второй закон термодинамики для необратимых процессов, находим
![]()
Подставив в первое начало термодинамики
вместо
величину
![]() большую, чем
,
получим
большую, чем
,
получим
![]() (2.16.9)
(2.16.9)
т. е. работа, совершаемая при необратимом процессе, всегда меньше, чем при обратимом.
В изотермических условиях неравенство (2.16.9) примет вид:
![]() (2.16.10)
(2.16.10)
Из неравенства (2.16.10) следует, что работа,
производимая системой при необратимом
изотермическом процессе, меньше убыли
свободной энергии этой системы. Таким
образом,
![]() определяет максимальную работу, которую
может произвести система в изотермическом
процессе.
определяет максимальную работу, которую
может произвести система в изотермическом
процессе.
2.17. Статистическое толкование энтропии
Выше было показано, что в результате необратимого процесса, совершающегося в замкнутой системе, энтропия системы увеличивается, достигая своего максимального значения в состоянии равновесия. Обратный же процесс самопроизвольного перехода системы из равновесного состояния в исходное неравновесное состояние практически невозможен, т. к. обратный процесс протекал бы с уменьшением энтро-пии, что запрещено вторым законом термодинамики.
Такая односторонность в протекании необратимых процессов объя-сняется тем, что при достаточно большом числе молекул в системе вероятность равновесного состояния практически близка к единице, при этом сумма вероятностей всех других неравновесных состояний близка к нулю. Поэтому переход системы в наиболее вероятное (равновесное) состояние идет самопроизвольно, тогда как обратный процесс не может идти самопроизвольно от более вероятного (равновесного) состояния в сторону менее вероятных состояний.
Приведем пример. Пусть имеется сосуд,
мысленно разделенный на два одинаковых
объема
![]() .
В сосуде находится четыре молекулы.
Чтобы различать состояния такого газа
с микроскопической и макроскопи-ческой
точек зрения, введем определения. Назовем
микросостоянием газа по пространственным
положениям частиц такое состояние,
когда известно сколько молекул и с
какими номерами находятся в каждой
части сосуда (для этого необходимо
заранее все четыре молекулы перенумеровать).
Макроскопическим же назовем состояние,
характери-зуемое только числом молекул
в различных частях сосуда.
.
В сосуде находится четыре молекулы.
Чтобы различать состояния такого газа
с микроскопической и макроскопи-ческой
точек зрения, введем определения. Назовем
микросостоянием газа по пространственным
положениям частиц такое состояние,
когда известно сколько молекул и с
какими номерами находятся в каждой
части сосуда (для этого необходимо
заранее все четыре молекулы перенумеровать).
Макроскопическим же назовем состояние,
характери-зуемое только числом молекул
в различных частях сосуда.
Так как каждая из молекул может находиться
с равной вероят-ностью как в левой, так
и в правой половине сосуда, то вероятность,
что она находится в левой (или правой)
части сосуда равна
![]() Поскольку вероятность пребывания каждой
молекулы в левой (правой) половине не
зависит от наличия в ней других, поэтому
на основании теоремы умножения
вероятностей, вероятность одновременного
нахож-дения в левой части сосуда двух
молекул равна
Поскольку вероятность пребывания каждой
молекулы в левой (правой) половине не
зависит от наличия в ней других, поэтому
на основании теоремы умножения
вероятностей, вероятность одновременного
нахож-дения в левой части сосуда двух
молекул равна
![]() ,
трех –
,
трех –
![]() ,
четырех –
,
четырех –
![]()
В табл. 2.17.1 приведены всевозможные
микросостояния газа, вероят-ность
каждого из которых, очевидно, равна
1/16. В пятой колонке табл. 2.17.1 также
приведены значения статистического
веса (статистическим весом или
термодинамической вероятностью
макросостояния называют число различных
микросостояний, приводимых к данному
макрососто-янию). Так, например,
статистический вес равновесного
состояния газа (по две молекулы в левой
и правой частях сосуда) равен 6, т. е.
равновесному макроскопическому состоянию
газа соответствует 6 различных
микросостояний. Вероятность этого
макроскопического сос-тояния газа равна
4/16, что больше вероятности любых других
макро-состояний. При увеличении числа
молекул равновесное состояние реализуется
большим числом микросостояний. Из таб.
2.17.1 также вид-но, что вероятность
собраться молекулам в правой части
сосуда равна 1/16 и реализуется одним
микроскопическим состоянием. При
увеличе-нии числа молекул в сосуде
вероятность такого неравновесного
состо-яния становится малой. В 1 см3
воздуха при нормальных условиях
содер-жится
![]() молекул. Вероятность, что эти молекулы
соберутся, нап-ример, в правой части
сосуда, равна
молекул. Вероятность, что эти молекулы
соберутся, нап-ример, в правой части
сосуда, равна
![]() ,
что является пренебрежи-мо малой
величиной. Таким образом, если молекулы
равномерно рас-пределились по сосуду
(равновесие), то вероятность того, что
они вновь соберутся самопроизвольно в
одной из половин сосуда (обратный
процесс), практически является невозможным
событием. Следует отме-тить, когда в
сосуде наступит состояние равновесия,
то это вовсе не означает, что число
молекул в левой и правой частях сосуда
в точности одинаково. В результате
теплового, хаотического движения молекул
число их, например, в левой части сосуда,
будет непрерывно изменяться и только
в среднем будет равно половине общего
числа молекул, находящихся в сосуде. Мы
знаем, что среднеквадратическое
отклонение числа частиц в одной из
частей сосуда от среднего (равновесного)
значения пропорционально корню
квадратному из числа частиц, т. е.
,
что является пренебрежи-мо малой
величиной. Таким образом, если молекулы
равномерно рас-пределились по сосуду
(равновесие), то вероятность того, что
они вновь соберутся самопроизвольно в
одной из половин сосуда (обратный
процесс), практически является невозможным
событием. Следует отме-тить, когда в
сосуде наступит состояние равновесия,
то это вовсе не означает, что число
молекул в левой и правой частях сосуда
в точности одинаково. В результате
теплового, хаотического движения молекул
число их, например, в левой части сосуда,
будет непрерывно изменяться и только
в среднем будет равно половине общего
числа молекул, находящихся в сосуде. Мы
знаем, что среднеквадратическое
отклонение числа частиц в одной из
частей сосуда от среднего (равновесного)
значения пропорционально корню
квадратному из числа частиц, т. е.
![]() . (2.17.1)
. (2.17.1)
Допустим, что в сосуде находится всего лишь 200 молекул. Тогда в одной половине сосуда в среднем должно находиться 100 молекул. Согласно (2.17.1), отклонение от этого среднего количества cоставит:
![]()
Это значит, что отклонение, как правило,
не будет превышать 10 % сред-него значения.
Большое отклонение получилось потому,
что число моле-кул в сосуде взято очень
небольшим. Если в сосуде взять 20000
молекул, то
![]() составит
составит
![]() 100
молекул, или 1 %. Если же число моле-кул
в сосу-де взять равным
100
молекул, или 1 %. Если же число моле-кул
в сосу-де взять равным
![]() ,
то отклонение не превышало бы
,
то отклонение не превышало бы
![]() молекул, что составило бы всего лишь
молекул, что составило бы всего лишь
![]() .
В последнем случае отк-лонения от
равномерного распределения были бы
практически неощутимы.
.
В последнем случае отк-лонения от
равномерного распределения были бы
практически неощутимы.
Таблица 2.17.1
Макросостояние |
Микросостояния |
Статистичес-кий вес |
Вероятность макросостояния |
||
Число молекул слева |
Число молекул справа |
Номера молекул, находящихся в левой части сосуда |
Номера молекул, находящихся в правой части сосуда |
||
4 |
0 |
1,2,3,4 |
- |
1 |
1/16 |
3 |
1 |
1,2,3 1,2,4 1,3,4 2,3,4 |
4 3 2 1 |
4 |
4/16 |
2 |
2 |
1,2 1,3 1,4 2,3 2,4 3,4 |
3,4 2,4 2,3 1,4 1,3 1,2 |
6 |
6/16 |
1 |
3 |
1 2 3 4 |
2,3,4 1,3,4 1,2,4 1,2,3 |
4 |
4/16 |
0 |
4 |
- |
1,2,3,4 |
1 |
1/16 |
Всего микросостояний |
24 = 16 |
|
|||
Теперь перейдем к рассмотрению общего
случая. Пусть объем
занимаемый газом разделен на
разных объемов
![]() .
Причем число ячеек
значительно меньше числа молекул
.
Причем число ячеек
значительно меньше числа молекул
![]() ,
т. е.
,
т. е.
![]() .
Тогда в каждой ячейке будет находиться
некоторое число молекул. Будем считать
газ идеальным и, что внешние силовые
поля отсутствуют. В этом случае вероятность
того, что некоторая молекула будет
обнаружена в i-й ячейке
.
Тогда в каждой ячейке будет находиться
некоторое число молекул. Будем считать
газ идеальным и, что внешние силовые
поля отсутствуют. В этом случае вероятность
того, что некоторая молекула будет
обнаружена в i-й ячейке
![]()
Зафиксируем макросостояние, определяемое
тем, что в первой ячейке находится
![]() молекул, во второй ячейке –
молекул, во второй ячейке –
![]() молекул,..., в l-й
ячейке –
молекул,..., в l-й
ячейке –
![]() молекул (рис. 46).
молекул (рис. 46).

Р и с. 46
Ясно, что
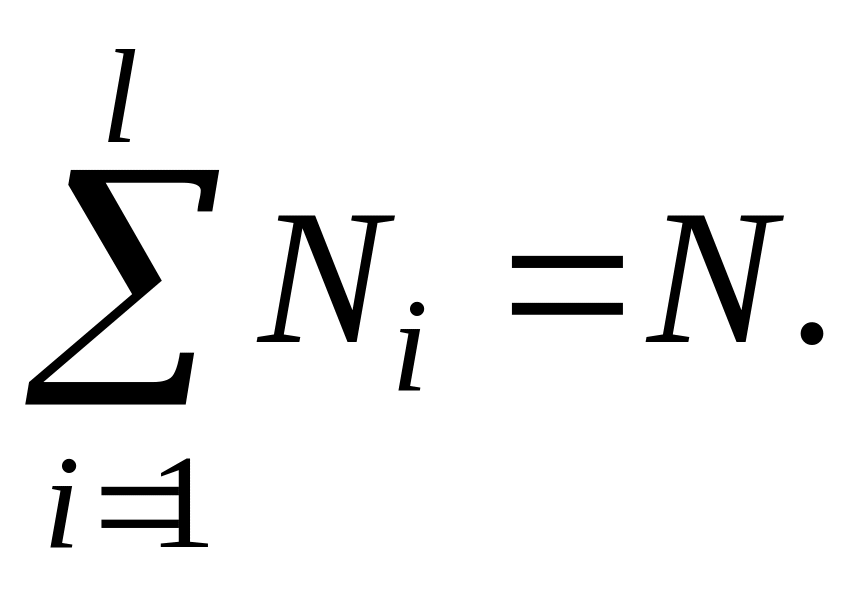 Число всевозможных перестановок среди
моле-кул равно
Число всевозможных перестановок среди
моле-кул равно
![]() .
Перестановки молекул в пределах каждой
из ячеек не приводят к новому микросостоянию.
Их следует исключить из общего числа
перестановок. Если разделить
на
.
Перестановки молекул в пределах каждой
из ячеек не приводят к новому микросостоянию.
Их следует исключить из общего числа
перестановок. Если разделить
на
![]() ,
то будут исключены те микросостояния,
которые отличаются перестановками
внутри первой ячейки. Полученный
результат разделим на
,
то будут исключены те микросостояния,
которые отличаются перестановками
внутри первой ячейки. Полученный
результат разделим на
![]() ,
что приведет к исключению тех
микросостояний, которые отличаются
перестановками во второй ячейке.
Продолжив этот процесс деления, получим
число различных микросостояний, которые
приводят к данному макросо-стоянию, т.
е. получим значение статистического
веса (термодина-мической вероятности)
данного макросостояния:
,
что приведет к исключению тех
микросостояний, которые отличаются
перестановками во второй ячейке.
Продолжив этот процесс деления, получим
число различных микросостояний, которые
приводят к данному макросо-стоянию, т.
е. получим значение статистического
веса (термодина-мической вероятности)
данного макросостояния:
 (2.17.2)
(2.17.2)
Все эти микросостояния равновероятны и вероятность каждого из них находится по теореме умножения вероятностей:
![]() (2.17.3)
(2.17.3)
Согласно теореме сложения несовместных событий, вероятность данного макросостояния равна сумме вероятностей микросостояний (2.17.3), число которых определяется выражением (2.17.2). Поэтому
 (2.17.4)
(2.17.4)
Если сосуд, в котором находится газ, разделен на l одинаковых
объемов
,
то
![]() для всех
для всех
![]() В этом случае формула (2.17.4) приобретает
вид:
В этом случае формула (2.17.4) приобретает
вид:
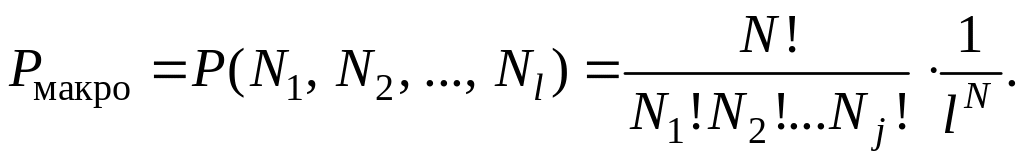 (2.17.5)
(2.17.5)
Если же сосуд разделен только на два
одинаковых объема, как это было в выше
приведенном примере, то
![]() При этом формулы (2.17.2) и (2.17.5) упростятся:
При этом формулы (2.17.2) и (2.17.5) упростятся:
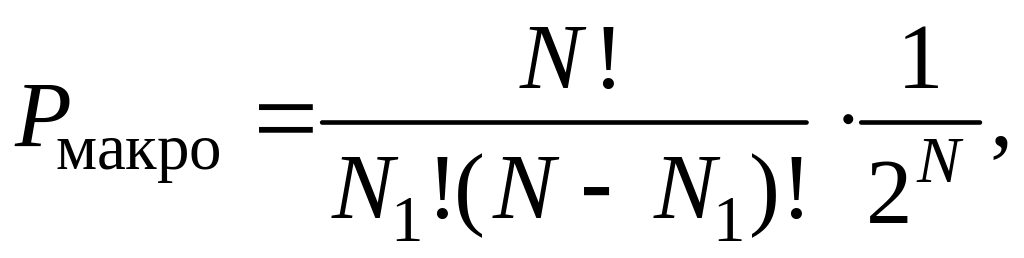 (2.17.6)
(2.17.6)
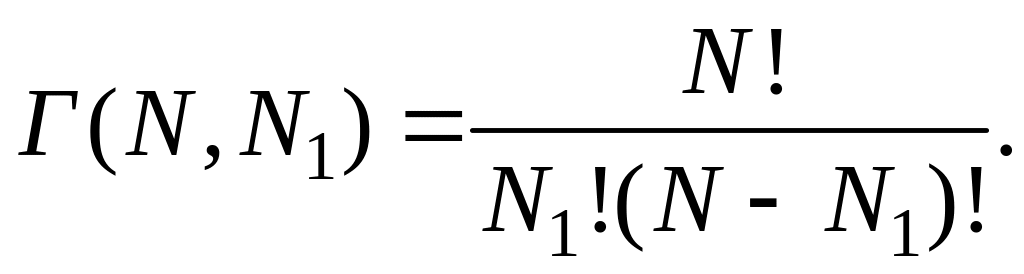 (2.17.7)
(2.17.7)
Используя формулу (2.17.5), найдем вероятность того, что все молекулы соберутся в первой ячейке (N1 = N):
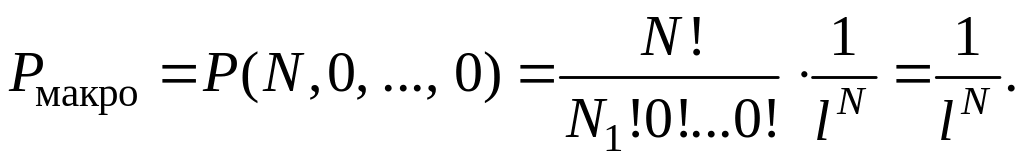 (2.17.8)
(2.17.8)
Вероятность этого макросостояния является минимально возможной, так как ему соответствует только одно микросостояние:
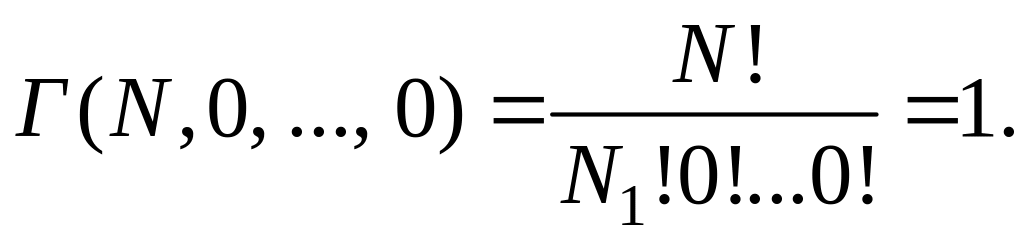 (2.17.9)
(2.17.9)
Наибольшим число микросостояний
характеризуется равновесное состо-яние,
т. е. когда молекулы равномерно распределены
по объему
![]()
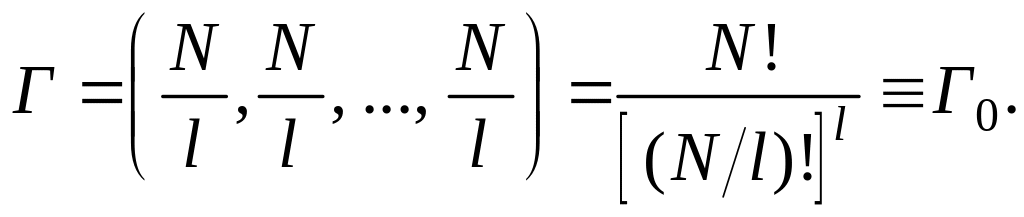 (2.17.10)
(2.17.10)
При этом и вероятность равновесного состояния будет наибольшей:
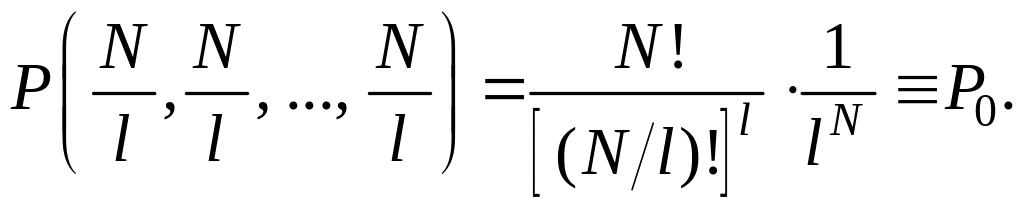 (2.17.11)
(2.17.11)
При больших выражения (2.17.10–2.17.11) можно упростить, воспользовавшись формулой Стирлинга:
![]() и
и
![]() (2.17.12)
(2.17.12)
Подставив (2.17.12) в (2.17.10–2.17.11), будем иметь
![]() , (2.17.13)
, (2.17.13)
![]() . (2.17.14)
. (2.17.14)
Таким образом, равновесное состояние
реализуется с вероятностью близкой к
единице, т. е. достоверно это состояние
осуществляется наибо-льшим числом
способов (микросостояний)
![]() Поэтому в замкнутой системе происходят
всегда такие процессы, которые приближают
сис-тему от менее вероятных состояний
к более вероятным, т. е. равновес-ным
состояниям, обратный же переход к
неравновесному состоянию практически
никогда не наблюдается, так как вероятность
такого состо-яния мала.
Поэтому в замкнутой системе происходят
всегда такие процессы, которые приближают
сис-тему от менее вероятных состояний
к более вероятным, т. е. равновес-ным
состояниям, обратный же переход к
неравновесному состоянию практически
никогда не наблюдается, так как вероятность
такого состо-яния мала.
