
- •1 Основные положения теории электролитической диссоциации
- •Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •3 Степень диссоциации
- •4 Константа диссоциации
- •5 Ионные реакции
- •6 Ионное произведение воды. Водородный показатель
- •7 Буферные растворы
- •9 Гидролиз. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •2. Гидролиз солей, соответствующих слабому основанию и сильной кислоте
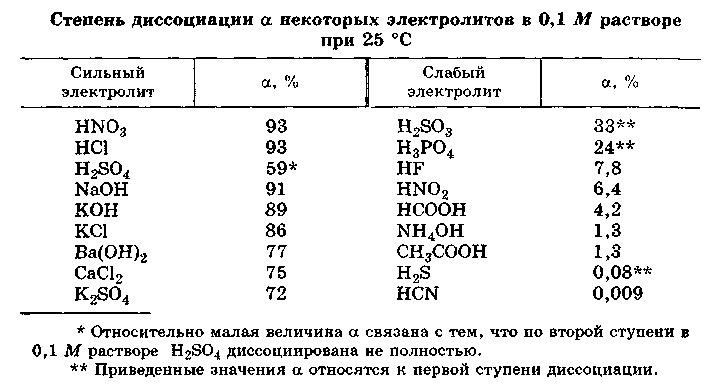
3 Степень диссоциации
Изучая свойства растворов электролитов, С. Аррениус ввёл понятие «степень диссоциации», предположив, что некоторые электролиты не могут полностью диссоциировать на ионы.
Степенью диссоциации называется отношение числа молекул, распавшихся в растворе на ионы, к общему числу молекул электролита в растворе.
|
(1) |
где: N(X) – число продиссоциировавших молекул электролита X;
N0(X) – общее число молекул электролита X в растворе.
Степень диссоциации () зависит от следующих факторов:
– от природы электролита и растворителя;
– концентрации электролита;
– температуры.
Степень диссоциации можно также выразить через количество вещества по формуле:
|
(2) |
где n(X) – количество молей продиссоциировавшего вещества X;
n0б(X) – общее количество молей вещества X в растворе;
Na – число Авогадро.
Количество вещества можно выразить через молярную концентрацию раствора и объём раствора, поэтому степень диссоциации можно также определить как отношение молярной концентрации продиссоциировавшего вещества к молярной концентрации всего вещества, находящегося в растворе.
|
( 3) |
где [Х] – молярная концентрация продиссоциировавшего вещества X;
[Х0] – общая молярная концентрация вещества X в растворе.
Электролиты можно разделить на 2 большие группы: электролиты сильные и слабые.
Сильные электролиты диссоциируют в растворах полностью и процесс диссоциации необратим: HNO3 H+ + NO3– . Из этого следует, что степень диссоциации сильного электролита равна 1.
Сильными электролитами являются:
–все растворимые соли;
– гидроксиды щелочных и щелочно-земельных металлов (NaOH, KOH, Ba(OH)2;
– некоторые кислоты (H2SO4, HNO3, HCl, HBr, HI.
Для слабых электролитов степень диссоциации α < 1, поскольку слабые электролиты диссоциируют лишь частично, и процесс диссоциации обратим, т.е. в растворе устанавливается динамическое равновесие между ионами и непродиссоциировавшими молекулами.
Основные слабые электролиты:
– вода H2O;
– гидроксиды Al(OH)3;
Обратимый характер диссоциации слабых электролитов отражается при записи уравнений.
CH3COOH ⇆ CH3COO– + H+
H3PO4 ⇆ H+ + H2PO4–
H2PO4– ⇆ H+ + HPO42–
HPO42– ⇆ H+ + PO43–
4 Константа диссоциации
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия.
Ниже приводится выражение константы равновесия для процесса диссоциации уксусной кислоты CH3COOH ⇆ CH3COO– + H+.
К онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
Величина константы диссоциации зависит от природы электролита и растворителя, температуры, но не зависит от концентрации электролита в растворе.
Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем легче электролит диссоциирует на ионы, тем больше константа диссоциации.
Константа диссоциации является справочной величиной.
Ступенчатая диссоциация электролитов. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Каждая стадия ступенчатой диссоциации многоосновной кислоты характеризуется своей константой диссоциации.
H3PO4 ⇆ H+ + H2PO4–

H2PO4– ⇆ H+ + HPO42–

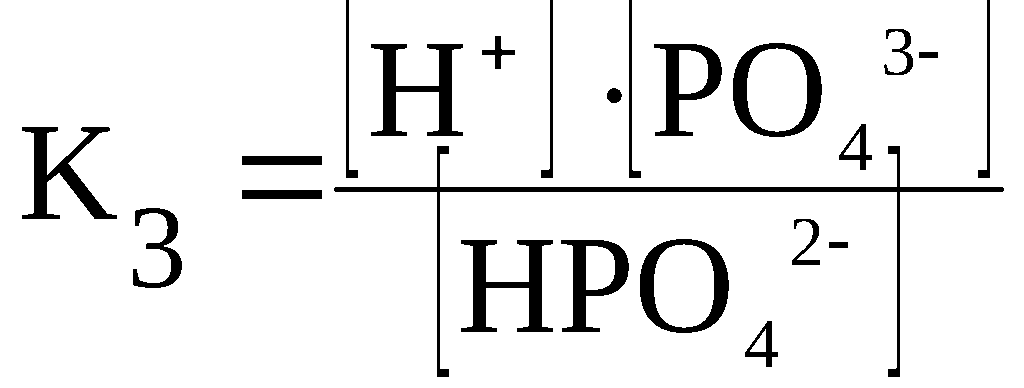
HPO42– ⇆ H+ + PO43–
Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов.
Fe(OH)2 ⇆ FeOH+ + OH–
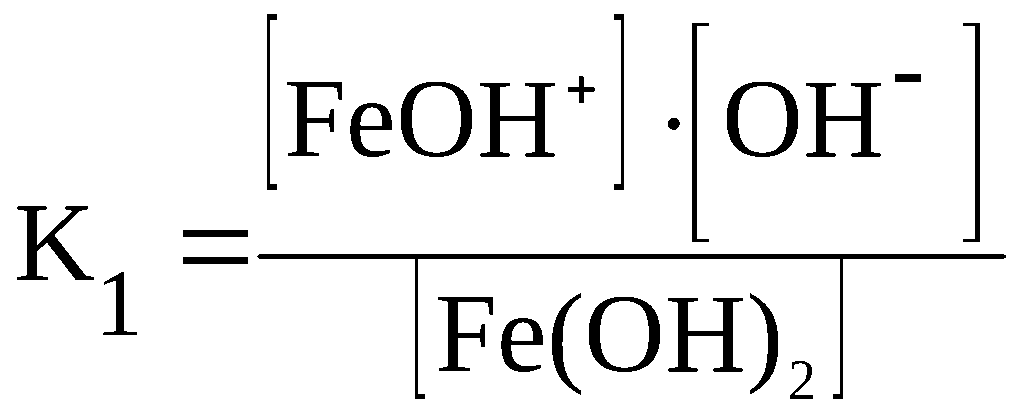
F eOH+
⇆
Fe2+
+ OH–
eOH+
⇆
Fe2+
+ OH–
При ступенчатой диссоциации веществ распад по первой ступени всегда происходит в гораздо большей степени, чем по второй; по второй стадии – больше, чем по третьей и т.д. Иначе говоря, соблюдается неравенство:
K1 >> K2 > K3 > ... .
Это объясняется тем, что энергия, необходимая для отрыва иона от нейтральной молекулы, меньше, чем от заряженной частицы. Например, отрыв иона H+ будет происходить более легко от нейтральной частицы – молекулы H3PO4, чем от отрицательно заряженного иона H2PO4–. В свою очередь, отрыв иона H+ от однозарядного иона H2PO4– требует меньшей энергии, чем от двухзарядного иона HPO4–.
Кислые и основные соли также диссоциируют ступенчато, например:
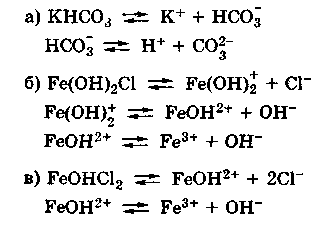
Нетрудно заметить, что диссоциация гидроаниона или гидроксокатиона идентична второй или третьей ступени диссоциации соответствующих кислоты или основания и потому подчиняется тем же закономерностям, которые были сформулированы для ступенчатой диссоциации кислот и оснований. В частности, если основная соль соответствует слабому основанию, а кислая соль - слабой кислоте, то диссоциация гидроаниона или гидроксокатиона (т. е. вторая или третья ступень диссоциации соли) протекает в незначительной степени.
Во всякой кислородсодержащей кислоте и во всяком основании (имеются в виду кислоты и основания в традиционном понимании) имеются гидроксогруппы. Разница между кислотой и основанием заключается в том, что в первом случае диссоциация происходит по связи ЭО—Н, а во втором — по связи Э—ОН.
Амфотерные гидроксиды диссоциируют и как основания, и как кислоты (и те и другие очень слабые). Так, ионизацию гидроксида цинка можно представить следующей схемой (без учета гидратации образующихся ионов):
![]()
Прибавление кислоты смещает эти равновесия влево, а прибавление щелочи - вправо. Поэтому в кислой среде преобладает диссоциация по типу основания, а в щелочной — по типу кислоты. В обоих случаях связывание в молекулы воды ионов, образующихся при диссоциации малорастворимого амфотерного электролита, вызывает переход в раствор новых порций таких ионов, их связывание, переход в раствор новых ионов и т. д. Следовательно, растворение такого электролита происходит как в растворе кислоты, так и в растворе щелочи.


