
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить нормальность 1-моляльного раствора серной кислоты (плотность раствора 1,06г/мл).
- •6.Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить моляльность 1-молярного раствора гидроксида натрия (плотность раствора 1,04г/мл).
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •1.Написать электронную формулу Ca в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •1.Написать электронную формулу Mg в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить нормальность 1-моляльного раствора серной кислоты (плотность раствора 1,06г/мл).
- •6.Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •2.С позиций метода валентных связей показать образование молекулы ph3 и определить:
- •5. Рассчитайте рН раствора, 1л которого содержит 0,001моль hBr .
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •2.С позиций метода валентных связей показать образование молекулы h2s и определить:
- •5. Рассчитайте рН раствора, 1л которого содержит 0,001моль hBr .
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить нормальность 1-моляльного раствора серной кислоты (плотность раствора 1,06г/мл).
- •6.Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить моляльность 1-молярного раствора гидроксида натрия (плотность раствора 1,04г/мл).
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •1.Написать электронную формулу Mg в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
- •4. Вычислить нормальность 1-моляльного раствора серной кислоты (плотность раствора 1,06г/мл).
- •6.Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •4. Вычислить моляльность 1-молярного раствора гидроксида натрия (плотность раствора 1,04г/мл).
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
- •6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
- •7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
K2SO4 + Cr2(SO4)3 + H2SO4 → K2Cr2O7 + H2SO4 + SO2
Зав.каф.ЕНиОПД (С) Карасев Е.М.
ФИЛИАЛ ГОУ ВПО «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ
АВИАЦИОННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
В ГОРОДЕ СТЕРЛИТАМАКЕ
Дисциплина «Химия»
Билет №6.
1.Написать электронную формулу Ni в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
2.С позиций метода валентных связей показать образование молекулы CH4 и определить:
а) тип гибридизации центрального атома в молекуле и валентный угол между связями;
б) пространственную структуру молекулы;
в) полярность связей и полярность молекулы в целом.
3. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость её увеличится в 2 раза?
4. Вычислить молярность, нормальность, моляльность, и массовую долю растворенного вещества в растворе, 1,0л которого содержит 32,0гр. CuSO4 , плотность раствора 1,035 г/мл.
5. Рассчитайте рН раствора, 1л которого содержит 0,001моль NaOH .
6.При соединении 2,1 железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа.
7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
Al + K2Cr2O7 + H2SO4 → Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Зав.каф.ЕНиОПД (С) Карасев Е.М.
ФИЛИАЛ ГОУ ВПО «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ
АВИАЦИОННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
В ГОРОДЕ СТЕРЛИТАМАКЕ
Дисциплина «Химия»
Билет №7.
1.Написать электронную формулу Si в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
2.С позиций метода валентных связей показать образование молекулы PBr3 и определить:
а) тип гибридизации центрального атома в молекуле и валентный угол между связями;
б) пространственную структуру молекулы;
в) полярность связей и полярность молекулы в целом.
3
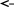 .
При некоторой температуре равновесие
в системе 2 NO2
2 NO
+ O2
установилось
при следующих концентрациях: [NO2]
= 0,006 моль/л; [NO]
= 0,024 моль/л; : [O2]
= 0,012 моль/л. Найти константу равновесия
реакции и исходную концентрацию NO2.
.
При некоторой температуре равновесие
в системе 2 NO2
2 NO
+ O2
установилось
при следующих концентрациях: [NO2]
= 0,006 моль/л; [NO]
= 0,024 моль/л; : [O2]
= 0,012 моль/л. Найти константу равновесия
реакции и исходную концентрацию NO2.
4. Вычислить нормальность 1-моляльного раствора серной кислоты (плотность раствора 1,06г/мл).
5. Рассчитайте рН раствора, 1л которого содержит 0,01моль HJ .
6.Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях.
7. Расставить стехиометрические коэффициенты овр электронно-ионным методом (методом полуреакций)
KClO3 + FeSO4 + H2SO4 → KCl + Fe(SO4
Зав.каф.ЕНиОПД (С) Карасев Е.М.
ФИЛИАЛ ГОУ ВПО «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ
АВИАЦИОННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
В ГОРОДЕ СТЕРЛИТАМАКЕ
Дисциплина «Химия»
Билет №8.
1.Написать электронную формулу Ag в нормальном и возбужденном состояниях. Определить степени окисления. Написать не менее 5 химических реакций, характеризующих свойства этого элемента.
2.С позиций метода валентных связей показать образование молекулы CCl4 и определить:
а) тип гибридизации центрального атома в молекуле и валентный угол между связями;
б) пространственную структуру молекулы;
в) полярность связей и полярность молекулы в целом.
3 . В каком направлении сместится равновесие реакции А2(г.)+В2(г.) 2АВ(г.),
если давление увеличить в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости прямой и обратной реакций равны соответственно 2 и 3. Каков знак ∆Но этой реакции?
