
- •1)Законы внешнего фотоэффекта. Красная граница фотоэффекта.
- •2)Молекулы.Химическиесвязи.Понятие об энергетических уровнях.
- •3)Поляризация света.ЗаконМалюса
- •5) Тепловое излучение и его характеристики
- •6)Металлы, диэлектрики, полупроводники позоной территории
- •7) Эффект Комптона
- •8) Принцип Паули. Распределение электронов в атоме по состояниям
- •10) Виды радиоактивного распада
- •11) Интерференция света. Когерентность и мнонхромность волн
- •14)Временное уравнение Шредингера.
- •15) Интерференция света. Кольца ньютона
- •17)Естественный и поляризованный свет.Двойноелучепреломление.Призма Николя
- •19)Инт-ия света в тонких пленках, полосы равного наклона.
- •20)Виды радиоактивного распада.Свойства радиоактивных превращений
- •22)Контакт электронного и дырочного полупроводников
- •23)Свойства лазерного излучения.
- •24)Классификация элементарных частиц
- •25)Дифракция Фраунгофера на дифракционной решетке
- •26)Решение уравнения Шрёдингера
- •28)Понятие о зонной теории твёрдых тел
- •35)Поляризация света при отражении. Закон Брюстера.
- •40)Закон радиоактивного распада
- •41)Принцип получения рентгеновских лучей
- •47)Дифракцияволн, дифракция на одной щели.
- •48)Закономерности альфа-распада
1)Законы внешнего фотоэффекта. Красная граница фотоэффекта.
При изучении вольт-амперных характеристик разнообразных материалов (важна чистота поверхности, поэтому измерения проводятся в вакууме и на свежих поверхностях) при различных частотах падающего на катод излучения и различных энергетических освещенностях катода и обобщения полученных данных были установлены следующие три закона внешнего фотоэффекта.
I. Закон Столетова: при фиксированной частоте падающего света число фотоэлектронов, вырываемых из катода в единицу времени, пропорционально интенсивности света (сила фототока насыщения пропорциональна энергетической освещенности Ее катода).
II. Максимальная начальная скорость (максимальная начальная кинетическая энергия) фотоэлектронов не зависит от интенсивности падающего света, а определяется только его частотой .
III. Для каждого вещества существует красная граница фотоэффекта, т. е. минимальная частота 0света (зависящая от химической природы вещества и состояния его поверхности), ниже которой фотоэффект невозможен.
«Красная»
грани́цафотоэффе́кта —
минимальная
частота или
максимальная длина
волны
или
максимальная длина
волны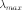 света,
при которой еще возможен внешний
фотоэффект,
то есть начальная кинетическая
энергияфотоэлектронов
больше нуля. Частота
зависит
только от работы
выхода
света,
при которой еще возможен внешний
фотоэффект,
то есть начальная кинетическая
энергияфотоэлектронов
больше нуля. Частота
зависит
только от работы
выхода электрона:
электрона:


где
—
работа
выхода
для конкретного фотокатода,
h —
постоянная
Планка,
а с —
скорость
света
.Работа
выхода
зависит
от материала фотокатода
и состояния его поверхности. Испускание
фотоэлектронов
начинается сразу же, как только на
фотокатод
падает свет
с частотой или
с длиной
волны
или
с длиной
волны .
.
2)Молекулы.Химическиесвязи.Понятие об энергетических уровнях.
Практический интерес представляют не отдельные атомы, а их устойчивые соединения, образующие молекулы или твердые тела. Молекула — это наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных химическими связями, и являющаяся носителем его основных химических и физических свойств. Преимущественно можно говорить о двух типах химической связи: ионной (гетерополярной) и ковалентной (гомеополярной). Ионная связь осуществляется благодаря кулоновскому притяжению между разноименно заряженными ионами (например, молекулы NaCl, KBr), а ковалентная — в результате обменного взаимодействия, носящего чисто квантовый характер я не имеющего аналога в классической физике (например, молекулы Н2, СО).
Число атомов, составляющих молекулы, может быть от двух — двухатомные молекулы (Н2, СО, КО) — до сотен и тысяч — многоатомные молекулы (белки, ...). Простейшая молекула с ковалентной связью — молекула водорода — состоит из двух протонов (ядер атома водорода) и двух электронов. Ковалентная связь объясняется принципом неразличимости тождественных частиц. Между двумя электронами (а они являются тождественными частицами) наблюдается обменное взаимодействие, возникающее как бы за счет обмена валентными электронами между двумя атомами. При сближении двух водородных атомов до расстояний порядка боровского радиуса (при обязательном условии антипараллельности спинов валентных электронов) возникает их взаимное притяжение и образуется устойчивая молекула водорода.
Состояние молекулы как квантовой системы описывается уравнением Шредингера, учитывающим взаимодействие электронов с ядрами, электронов друг с другом, а также кинетическую энергию электронов и ядер. Для приближенного решения этой задачи (довольно сложной) используют адиабатное приближение, согласно которому квантово-механическая система разделяется на тяжелые и легкие частицы — ядра и электроны. Так как массы и скорости этих частиц сильно различаются, то считается, что Движение электронов происходит в поле неподвижных ядер, а медленно движущиеся ядра находятся в усредненном поле электронов. Следовательно, в адиабатном приближении уравнение Шредингера для молекулы распадается на два уравнения — Для электронов и ядер.
Из решения уравнения Шредингера для молекулы водорода при указанных выше предположениях (это сделано в 1927 г. Заитлером и Лондоном) получается зависимость собственных значений энергии от расстояния R между ядрами, т. е. Е=Е (К).
