
- •1.Техническая тд как теоретическая основа теплоэнергетики.
- •2.Первый закон термодинамики как закон сохранения и превращения энергии
- •3.Термодинамические свойства и процессы идеального газа
- •4.Смеси (смесь) идеальных газов
- •5.Обратимые и необратимые процессы.
- •6.Возрастание энтропии изолированной системы
- •7.Эксергия как мера работоспособности системы
- •8.Статистический смысл второго закона тд
- •9.Характеристические функции и дифференциальные уравнения
- •10.Формулировки и аналитическое выражение третьего закона тд гипотеза планка абсолютная энтропия
- •10.Третий закон тд
- •Отметим, что в модели идеального газа т. Н. Места нет!
- •Закон Дальтона нарушается
- •13. Вириальное уравнение состояния для умеренно сжатых газов.
- •14. Принцип соответственных состояний и подобие
Закон Дальтона нарушается
Расчет ТД-свойств резко отличается от расчета для идеального газа.
Например, если Вы считаете давление для смеси (0.25 кмоль азота + 0.75 кмоль водорода) при 00С в сосуде с V=50 литров, то по формулам для идеального газа - р=46 МПа, а по формулам для реального - 69 МПа.
Фазовая диаграмма.

kc и kd - пограничные кривые 2-х фазной области ж - п
k - критическая точка
ab и de - пограничные кривые 2-х фазной области т - п
mb и nc - пограничные кривые 2-х фазной области т - ж
bcd - состояния, соответствующие тройной точке критические параметры
pv - диаграмма на примере диаграммы ван-дер-ваальсовского газа (тоже модель)
ФАКТОР СЖИМАЕМОСТИ И ZP-ДИАГРАММА
ФАЗОВАЯ РТ-ДИАГРАММА
ПРАВИЛО ФАЗ ГИББСА
УРАВНЕНИЕ КЛАПЕЙРОНА-КЛАУЗИСА
ВОДА И ВОДЯНОЙ ПАР
УДЕЛЬНЫЙ ОБЬЕМ, ЭНТАЛЬПИЯ И ЭНТРОПИЯ ВОДЫ, ВЛАЖНОГО, СУХОГО НАСЫЩЕННОГО И ПЕРЕГРЕТОГО ПАРА
СВЕРХКРИТИЧЕСКАЯ ОБЛАСТЬ СОСТОЯНИЯ ПАРА
В ТТ надо знать:
физические свойства веществ, представленные в виде терм. или калор. ур-й состояния
ТУ для реальных веществ получают экспериментально (путем измерения p, v, T): F(p,v,T) - это уравнение поверхности
Состояние вещества - это точка на поверхности
Процесс - это пространственная линия (или линия на двумерной диаграмме)
Совокупность процессов - это семейство линий
КУ находят по ТУ
Таблицы водяного пара.
**hs-диаграмма водяного пара.
Р Т-
диаграмма фазовых переходов
Т-
диаграмма фазовых переходов
p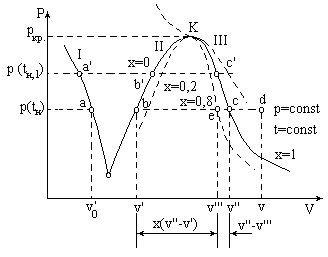 v
– диаграмма
v
– диаграмма
00С, p, v' - точка а - начальное состояние воды.
подвод тепла

t н
(кипения),
p, v'
(удельный объем возрастает незначительно)
- точка b
н
(кипения),
p, v'
(удельный объем возрастает незначительно)
- точка b
подвод тепла

t н(кипения), p, v" (кипящая жидкость полностью переходит в пар, СНП - точка с)
- bc - процесс изобарно-изотермический и во время его - ВП (смесь СНП и жидкости - например точка e, причем жидкость может быть и в форме капель)
подвод тепла
- t > tн , изобара и изотерма разделяются (изотерма ниже)
- перегретый
пар
перегретый
пар
1 - изотерма жидкости 00С
2 - нижняя пограничная кривая (погр.кривая жидк.)
3 - верхняя пограничная кривая (погр.кривая пара)
2 и 3 соединяются в критической точке, при Т большей критической может существовать только пар
Пересечение линий 1 и 2 дает тройную точку (одновременно существуют три фазы): для воды лед-вода-пар: 610,8 Па, 273,16 К
Подогрев воды:
dq' = c'dT = du' + dl = du' + pdv'

c' практически не зависит от процесса нагревания и равна const
второй член много меньше первого, а u'0 для 00С принимается равным 0
Отсюда
![]()
Энтальпия:
h'= u' + pv', но так как второй член много меньше первого:
h' = u' = q'
Энтропия:
ds = dq/T0
 и при c'=const
s'= c'ln(Tн/273)
и при c'=const
s'= c'ln(Tн/273)
Теплота парообразования - q затраченное на перевод кипящей жидкости в сухой насыщенный пар (точка с) при постоянном давлении (процесс bc) - r
r=u"= u'+p(v"-v')
r - затрачивается на: изменение u (на преодоление сил сцепления между молекулами - работа дисгрегации - ф - внутр.тепл.парообр.)
работу расширения (площадь bcc'b') - w - внеш.т.п.
для водяного пара при p=1 бар: ф/w = 10
Состояние сухого пара характеризуется или p или Т (насыщения) - все остальное по табл. или hs-диаграмме
u"= u' + ф
h" = h' + r (h - теплота подведенная при постоянном p)
r=ф+w
w=p(v"-v')210
ф=r - w
u"=h"-pv"210
u'= h'-pv'210
![]()
s"=s'+(r/T")=2,303lg(T"/273,16)+(r/T")
r - теплота парообразования
u' - вн.эн. кипящей жидкости
w - внешняя теплота парообразования
ф - внутренняя теплота парообразования
Знак ' (кипящая жидкость), знак " (сухой пар)
Состояние влажного пара характеризуется парой параметров:
p, x
p, (1-x)
t", x - степень сухости
t", (1-x) - степень вдажности
v""=xv"+(1-x)v'=v'+x(v"-v')
x=be/bc(0...1)
при x > 0.5 и небольших давлениях: v""=xv"
h""=h' + xr
r"" = x r
ф""= xф
w""= xw
r""=w""+ф"=xw+xф
u"" = u' + x ф
u""=h""-pv""210
s""=s'+(xr)/Tн
s""=2,303lg(T"/273,16)+(x r)/T"
s""=xs" +(1-x)s'
Перегретый пар:
Основные параметры: p, v, t или T
Характеризуется: p и t
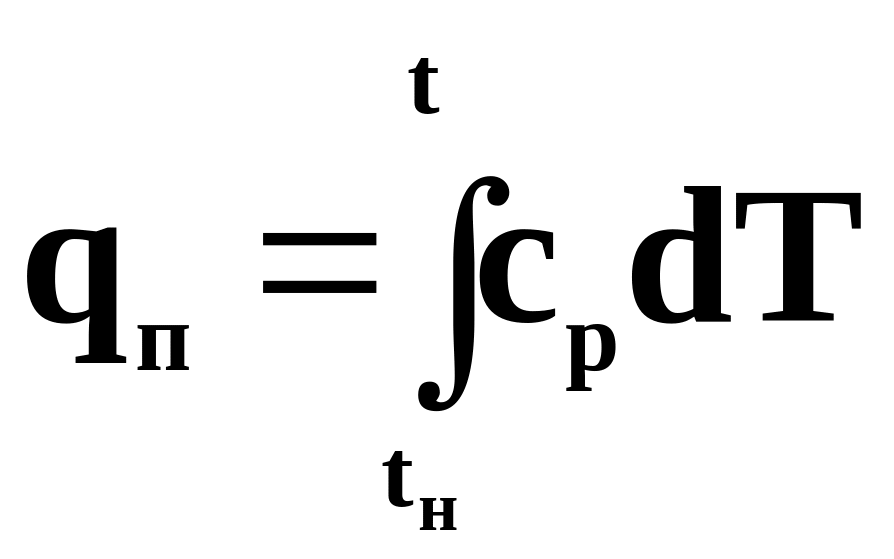
сp - определяется экспериментально
по мере повышения перегрева свойства пара приближаются к свойствам идеального газа
qп=cp(tср.-tн)
qп=h-h"
h=h"+qп
u=h-pv210
![]()
Функции u, h, s для реальных рабочих тел можно найти через ДУ ТД по известному уравнению состояния. Но для водяного пара формулы оказываются очень сложными, поэтому на практике пользуются таблицами перегретого пара, составленными для заданных p, T.
Все величины (для сух., влаж. и перегр. пара) могут быть найдены или подсчитаны (внутренние энергии) также и по hs-диаграмме, для чего нужно найти в ней точку, соответствующую данному состоянию пара.
Для кипящей жидкости берутся по таблице для области насыщения.
Все связи между p, v, T для воды и водяного пара определены экспериментально и представлены в графической форме и в виде таблиц, теплоемкость тоже. Их непосредственно можно использовать для определения q, u, h, s
ТАБЛИЦЫ ТД-СВОЙСТВ ВОДЫ И ВОДЯНОГО ПАРА
Функции u, h, s для РРТ:
через ДУ ТД и уравнение состояния, но получающиеся формулы, особенно для вод. пара - очень сложные.
по таблицам (полученным с помощью формул) при заданных p и v.
электронные формулы, электронные таблицы, электронные диаграммы
ТS- И HS-ДИАГРАММЫ ДЛЯ ВОДЯНОГО ПАРА
элементарный ЦК на линии насыщения:
=l/q1=(T1-T2)/T1
[(v"-v')dp]/r=dT/Tн
r/Tн =[(v"-v')dp/dT
ТS-ДИАГРАММА:
П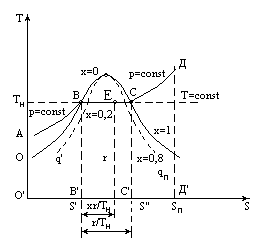 лощадь
под линией процесса - q
(подведенное
или отведенное).
лощадь
под линией процесса - q
(подведенное
или отведенное).
А - жидкость при 00С
В - кипящая жидкость при Тн
Е - ВНП, влажный насыщенный пар (строго говоря - это смесь капель жидкости и сухого пара, но и смесь кипящей жидкости и сухого пара тоже называют влажным паром).
С - СНП, сухой насыщенный пар
Д - ПП
АВ и ОВ - почти сливаются
АВВ'О' - q
ВС - линия парообразования
ВСС'В' - r
СДД'С' - теплота перегрева
Степень сухости:
x-(xr/T)/(r/T)=ВЕ/ВС
На практике для конкретных веществ на диаграмме наносятся сетки изобар, изохор и линий постоянной сухости (для повышения точности графического определения отдельных параметров).
HS-ДИАГРАММА:
Наибольшее распространение
Строится по Тs и pv-диаграммам
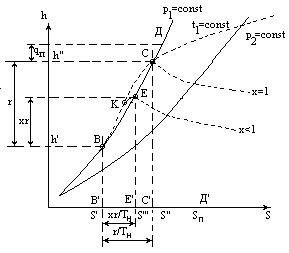
А - жидкость при 00С
В - кипящая жидкость при Тн
Е - ВНП, влажный насыщенный пар (строго говоря - это смесь капель жидкости и сухого пара, но и смесь кипящая жидкость и сухого пара тоже называют влажным паром).
С - СНП, сухой насыщенный пар
Д - ПП
ВС - линия парообразования (тоже прямая линия:
s""=s'+ xr/Tн-(h""- h')/Tн)
Степень сухости:
х=(xr/T)/(r/T)=В'Е'/В'С' - ВЕ/ВС
Изотерма асимптотически приближается к горизонтальной прямой (по мере увеличения объема при t=const ПП по своим свеществам приближается к ИГ (при h=const и t=const)).
q', r, qп - определяются как ординаты в отличие от Тs-диаграммы.
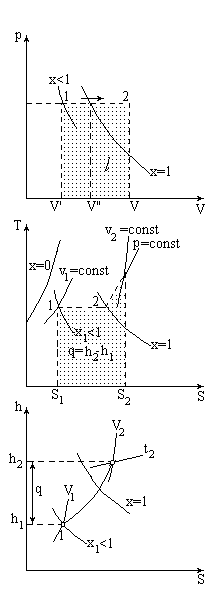
РАСЧЕТ ПРОЦЕССОВ ДЛЯ ВОДЯНОГО ПАРА
Бывают процессы для:
ВНП
ПП
ВНП - ПП (ниболее общий случай)
Исследование процесса:
определение начальных и конечных ТД-параметров
определение изменений u, h, s
Определяются по:
диаграммам (графический способ) - нагляден, малотрудоемок.
формулам (расчетный) - (трудоемеок, но более точен).
таблицам (расчетный) - (трудоемок, но более точен).
И ЗОХОРНЫЙ.
ЗОХОРНЫЙ.
q = u2-u1 = h2 - p2v - (h1-p1v) = h2 -h1-v(p2-p1)
q - заштрихованная площадь в Ts-члены в формуле находят через hs- или по формулам
h""= h'+ xr
h' и r - из таблиц ВНП для p1
x = v""/v"
v" - из таблиц по p1 , v""- задано положением т.1
h2 - из табл. ПП
ИЗОБАРНЫЙ.
dq=dh-vdp
p = const
q = h2 - h1
q - заштрихованная площадь в Ts- диаграмме.
или разность ординат в hs- диаграмме.
l=p(v2-v1) - заштрихованная площадь в pv-диаграмме.
u2- u1 = q - l = h2- h1-p(v2-v1)
члены в формуле находят через hs- или по формулам и таблицам
Например:
h""=h'+xr
x = v""/v"
h', r и v" - из таблиц ВНП
h2, v2 - из таблиц ПП
x = v""/v"
v" - из таблиц по p1, v""- задано положением т.1
h2- из табл. ПП
И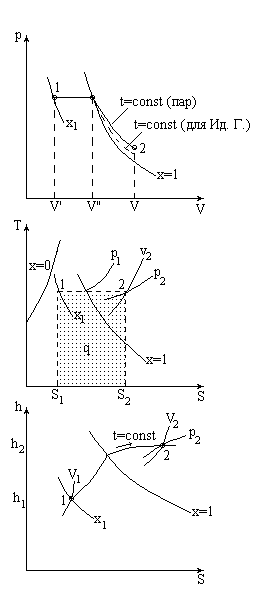 ЗОТЕРМИЧЕСКИЙ.
ЗОТЕРМИЧЕСКИЙ.
q = T(s2- s1)
q - заштрихованная площадь в Ts-диагамме.
Изменение внутренней энергии для пара (в отличие от ИГ) при изотермическом процессе не равно 0 (оно представляет собой работу дисгрегации для перевода жидкости в пар)
u2-u1= h2-p2v-(h1-p1v) = h2-h1-(p2v2-p1v1)
Работа расширения:
l1,2 =q-(u2-u1)=T(s2-s1)-h2-h1+(p2v2-p1v1)
члены в формуле находят через hs-диаграмме.
АДИАБАТИЧЕСКИЙ.
приближенно гиперболическая кривая: pv=const
k - эмпирический коэффициент (для ПП = 1,3; для ВНП - 1,135)
при адиабатном расширении: ПП—СНП—ВНП (часть пара сконденсируется)
ВВ' - процесс расширения сопровождается частичным испарением жидкости.
СС' - частичной конденсацией.
Это обусловлено тем, что c"- отрицательна, а c' - положительна.
Путем сжатия ВВ' можно перевести ВНП с малой x в кипящую жидкость; а ВНП с большой x - путем сжатия, например от 2 к 1 перевести в СНП и далее в ПП
Процессы частичного испарения при ад. расш. ВНП происходят, если x<0,5 (т.е. - слева от кривой x = 0,5)
Процессы частичной конденсации при ад. расш. ВНП происходят, если x>0,5 (т.е. - слева от кривой x = 0,5)
dq=0
l1,2 =(u2 -u1)=h1-p1v1-(h2-p2v2)=h1-h2+(p1v1-p2v2)
l - заштрихованная площадь в pv-диаграмме.
