
9.
Импульс
тела -
это физическая векторная величина,
равная произведению массы тела на его
скорость.

Закон сохранения:
Векторная сумма импульсов взаимодействующих тел, составляющих замкнутую систему, остается неизменной.

или

Замкнутой называется система тел, взаимодействующих только друг с другом и не взаимодействующих с другими телами.
10.
В физике механи́ческая эне́ргия описывает сумму потенциальной и кинетической энергии, имеющихся в компонентах механической системы. Механическая энергия — это энергия, связанная с движением объекта или его положением, способность совершать механическую работу
Сохранение механической энергии
Закон сохранения механической энергии утверждает, что если тело или система подвергается действию только консервативных сил, то полная механическая энергия этого тела или системы остаётся постоянной. В изолированной системе, где действуют только консервативные силы, полная механическая энергия сохраняется
Кинети́ческая эне́ргия — энергия механической системы, зависящая от скоростей движения её точек. Часто выделяют кинетическую энергию поступательного ивращательного движения.
Потенциальная энергия  — скалярная физическая
величина,
характеризующая способность некоего
тела (или материальной точки)
совершать работу за
счет своего нахождения в поле действия
сил. Другое определение: потенциальная
энергия — это функция координат,
являющаяся слагаемым в лагранжиане системы,
и описывающая взаимодействие элементов
системы[1].
Термин «потенциальная энергия» был
введен в XIX веке шотландским инженером
и физиком Уильямом
Ренкином.
— скалярная физическая
величина,
характеризующая способность некоего
тела (или материальной точки)
совершать работу за
счет своего нахождения в поле действия
сил. Другое определение: потенциальная
энергия — это функция координат,
являющаяся слагаемым в лагранжиане системы,
и описывающая взаимодействие элементов
системы[1].
Термин «потенциальная энергия» был
введен в XIX веке шотландским инженером
и физиком Уильямом
Ренкином.
Единицей измерения энергии в СИ является Джоуль.
11.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
Диффузия (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул одного вещества между молекулами другого
Бро́уновское движе́ние — в естествознании, беспорядочное движение микроскопических, видимых, взвешенных в жидкости (или газе) частиц твёрдого вещества (пылинки, частички пыльцы растения и так далее), вызываемоетепловым движением частиц жидкости (или газа)
12.
Опыты и примеры показали нам, какие свойства имеют твердые, жидкие и газообразные тела.
Знания о строении вещества помогут объяснить эти свойства.
Лед, вода и водяной пар - три агрегатных состояния одного и того же вещества - воды. Значит, молекулы льда, воды и водяного пара не отличаются друг от друга. А раз так, тоэти три состояния различаются не молекулами, а тем, как эти молекулы расположены и как движутся.
Газ можно сжать так, что его объем уменьшится в несколько раз. Значит, в газах расстояние между молекулами много больше размеров самих молекул.
Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул.
Твердые тела в обычных условиях сохраняют и объем, и форму. Это объясняется тем, что притяжение между их частицами еще больше, чем у жидкостей.
Частицы (молекулы или атомы) большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке.
Такие твердые тела называют кристаллическими.
Подведем итоги. Изучение строения вещества показывает, что: 1) все вещества состоят из мельчайших частиц - молекул и атомов; 2) частицы вещества непрерывно и беспорядочно движутся; 3) частицы вещества взаимодействуют друг с другом.
Эти три положения называют основными положениями молекулярно-кинематической1 теории строения вещества.
14 билет Тем-ра - мера средней кинетической движения молекул. Абсолютный ноль-это тем-ра при которой превращается двиижение молекул угл. газа...-этосамая низвая тем-ра она = 273,15.. ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРНАЯ шкала (Кельвина шкала) - абсолютная шкала температур, не зависящая от свойств термометрического вещества (начало отсчета - абсолютный нуль температуры). То же тело, рассматриваемое с микроскопической точки зрения, состоит из атомов и молекул, и внутренняя энергия обусловлена движением атомов и молекул и рассматривается как следствие теплового движения этих частиц, а абсолютная температура тела прямо пропорциональна средней кинетической энергии такого движения атомов и молекул
15.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:

где
 — давление,
— давление, — молярный
объём,
— молярный
объём, — универсальная
газовая постоянная
— универсальная
газовая постоянная — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как  ,
где
,
где  — количество
вещества,
а
— количество
вещества,
а  ,
где
,
где  —
масса,
—
масса,  — молярная
масса,
уравнение состояния можно записать:
— молярная
масса,
уравнение состояния можно записать:

Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
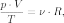

16.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объёмили температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический,энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно. Изопроцессы являются частными случаями политропного процесса.
Изобарный
процесс (др.-греч.
ισος, isos — «одинаковый» + βαρος,
baros — «вес») — процесс изменения
состояния термодинамической системы
при постоянном давлении
( )
)

Изохорный
процесс (от
греч. хора — занимаемое место) —
процесс изменения состояния
термодинамической системы при постоянном
объёме ( ).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:

Изотермический
процесс (от
греч. «термос» — тёплый, горячий) —
процесс изменения состояния
термодинамической системы при постоянной
температуре ( )(
)( ).
Изотермический процесс описывается законом
Бойля — Мариотта:
).
Изотермический процесс описывается законом
Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Изоэнтропийный
процесс —
процесс изменения состояния
термодинамической системы при постоянной
энтропии ( ).
Изоэнтропийным является, например,
обратимый адиабатический процесс: в
таком процессе не происходит теплообмена
с окружающей средой. Идеальный газ в
таком процессе описывается следующим
уравнением:
).
Изоэнтропийным является, например,
обратимый адиабатический процесс: в
таком процессе не происходит теплообмена
с окружающей средой. Идеальный газ в
таком процессе описывается следующим
уравнением:

где  — показатель
адиабаты,
определяемый типом газа.
— показатель
адиабаты,
определяемый типом газа.
17.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости
Конденса́ция паров (лат. condense — уплотняю, сгущаю) — переход вещества в жидкое или твёрдое состояние из газообразного. Максимальная температура, ниже которой происходит конденсация, называется критической. Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным.
Виды конденсации:
1)Конденсация насыщенных паров
При наличии жидкой фазы вещества конденсация происходит при сколь угодно малых пересыщениях и очень быстро. В этом случае возникает подвижное равновесие между испаряющейся жидкостью и конденсирующимися парами.
2) Конденсация перенасыщенного пара
Наличие перенасыщенного пара возможно в следующих случаях:
отсутствие жидкой или твёрдой фазы того же вещества.
отсутствие ядер конденсации — взвешенных в атмосфере твёрдых частиц или капелек жидкости, а также ионов (наиболее активные ядра конденсации).
конденсация в атмосфере другого газа — в этом случае скорость конденсации ограничена скоростью диффузии паров из газа к поверхности жидкости.
3) Конденсация ненасыщенного пара
Конденсация ненасыщенного пара возможна в присухность изменяет равновесное давление и инициирует капиллярную конденсацию.
4) Конденсация в твёрдую фазу
Конденсация, минуя жидкую фазу, происходит через образование мелких кристалликов (десублимация). Это возможно в случае давления паров ниже давления в тройной точке при пониженной температуре.
Насыщенный пар — пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава.
Давление насыщенного пара обычно сильно зависит от температуры. При равенстве внешнего давления давлению насыщенного пара происходит кипение (жидкости).
Ненасыщенный пар — пар, не достигший термодинамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
20.
Первый закон термодинамики: изменение внутренней энергии системы равно сумме количества теплоты, переданной системе, и работы внешних сил, совершенной над системой.
ΔU = Q + A
где ΔU- изменение внутренней энергии, Q- количество теплоты, преданное системе, A- работа внешних сил.
Применение первого закона термодинамики к различным изопроцессам.
1. Изотермический процесс.
При изотермическом процессе температура не изменяется, следовательно ΔТ = 0, поэтому ΔU=0.
Тогда первый закон термодинамики принимает вид: Q = А`. Всё получаемое количество теплоты идёт на совершение работы.
2. Изохорный процесс.
При изохорном процессе объём газа не меняется, а следовательно работа газом не совершается, т.е.А`=0.
Поэтому первый закон термодинамики принимает вид: Q =ΔU . Всё получаемое количество теплоты идет на изменение внутренней энергии.
3. Изобарный процесс.
При изобарном процессе переданное газу количество теплоты идёт на изменение внутренней энергии и на совершение работы:
 .
.
21.
Тепловой двигатель - это устройство, которое преобразует энергию топлива в механическую.
Во всех двигателях энергия топлива переходит сначала в энергию газа или пара, а газ (пар) расширяясь, совершает работу и охлаждается, а часть его внутренней энергии при этом превращается в механическую энергию.
Виды:
паровая машина
двигатель внутреннего сгорания,
паровая и газовая турбины,
реактивный двигатель.
Их топливом является твёрдое и жидкое топливо, солнечная и атомная энергии.
двигатель внутреннего сгорания:
Рабочий цикл в двигателе происходит за четыре хода поршня, за четыре такта. Поэтому такой двигатель и называется четырёхтактным. Цикл двигателя состоит из следующих четырёх тактов: 1.впуск, 2.сжатие, 3.рабочий ход, 4.выпуск.
Паровая турбина:
В современной технике так же широко применяют и другой тип теплового двигателя. В нём пар или нагретый до высокой температуры газ вращает вал двигателя без помощи поршня, шатуна и коленчатого вала. Такие двигатели называют турбинами.
