
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
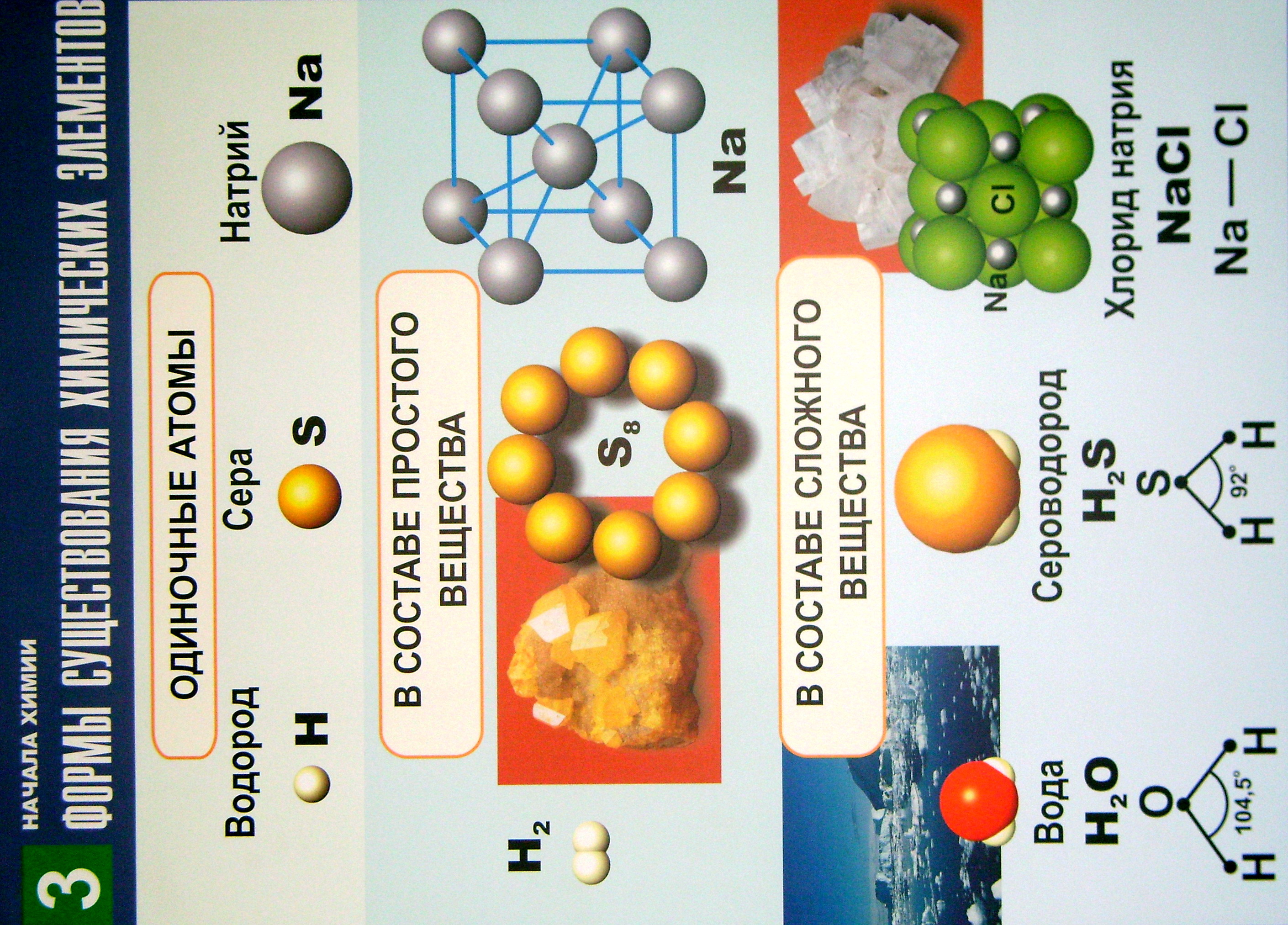
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
- •8. Составление химических формул по валентности атомов элементов
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
Формы существования химических элементов
4. Вещества молекулярного и немолекулярного строения
Таблица 4 помогает составлять химические формулы веществ и грамотно пользоваться химическим языком. В начале XX века считали, что все вещества состоят из молекул. Сейчас различают химические вещества молекулярного и немолекулярного строения.
К немолекулярным веществам относятся все металлы (медь, железо, ртуть и др.), вещества с атомной (ковалентной) кристаллической решёткой (алмаз, кремний, оксид кремния, карбид кремния и железа, нитрид бора) и ионные соединения – соли, оксиды и гидроксиды металлов (хлорид натрия, оксид алюминия и др.). Поэтому нельзя допускать таких выражений как "молекула хлорида", если речь идёт о твёрдой поваренной соли. В таких случаях следует использовать термин "формульная единица" (см. раздел 7).
В немолекулярных веществах отдельный кристалл является единой химической частицей. В газообразном состоянии эти вещества могут быть в виде как молекул, так и отдельных атомов, ионов и других частиц.
Многие неметаллы обладают молекулярным строением, но среди них встречаются немолекулярные вещества: алмаз, кремний. Молекулы могут состоять из разного количества атомов, связанных между собой химическими связями. К молекулярным веществам относятся кислород, озон, азот, хлор, вода, оксид углерода(IV), азотная и уксусная кислоты, глюкоза, сахароза.
К веществам молекулярного строения относят также благородные (инертные) газы (аргон, неон). Химические связи в этих веществах между атомами имеют ту же природу, что и межмолекулярные. По свойствам они соответствуют веществам с молекулярной структурой.
Вещества с особенно большими молекулами – высокомолекулярные – содержат до нескольких тысяч атомов. Их физические свойства определяются не межмолекулярными, а внутримолекулярными химическими (ковалентными) связями, то есть свойствами молекул.
5. Структурные изменения веществ
Таблица 5 помогает понять, что свойства веществ в разном фазовом состоянии зависят от их структуры.
Простые и сложные вещества в зависимости от внешних условий могут находиться в разном фазовом состоянии.
Таблица 4
Вещества молекулярного и немолекулярного строения
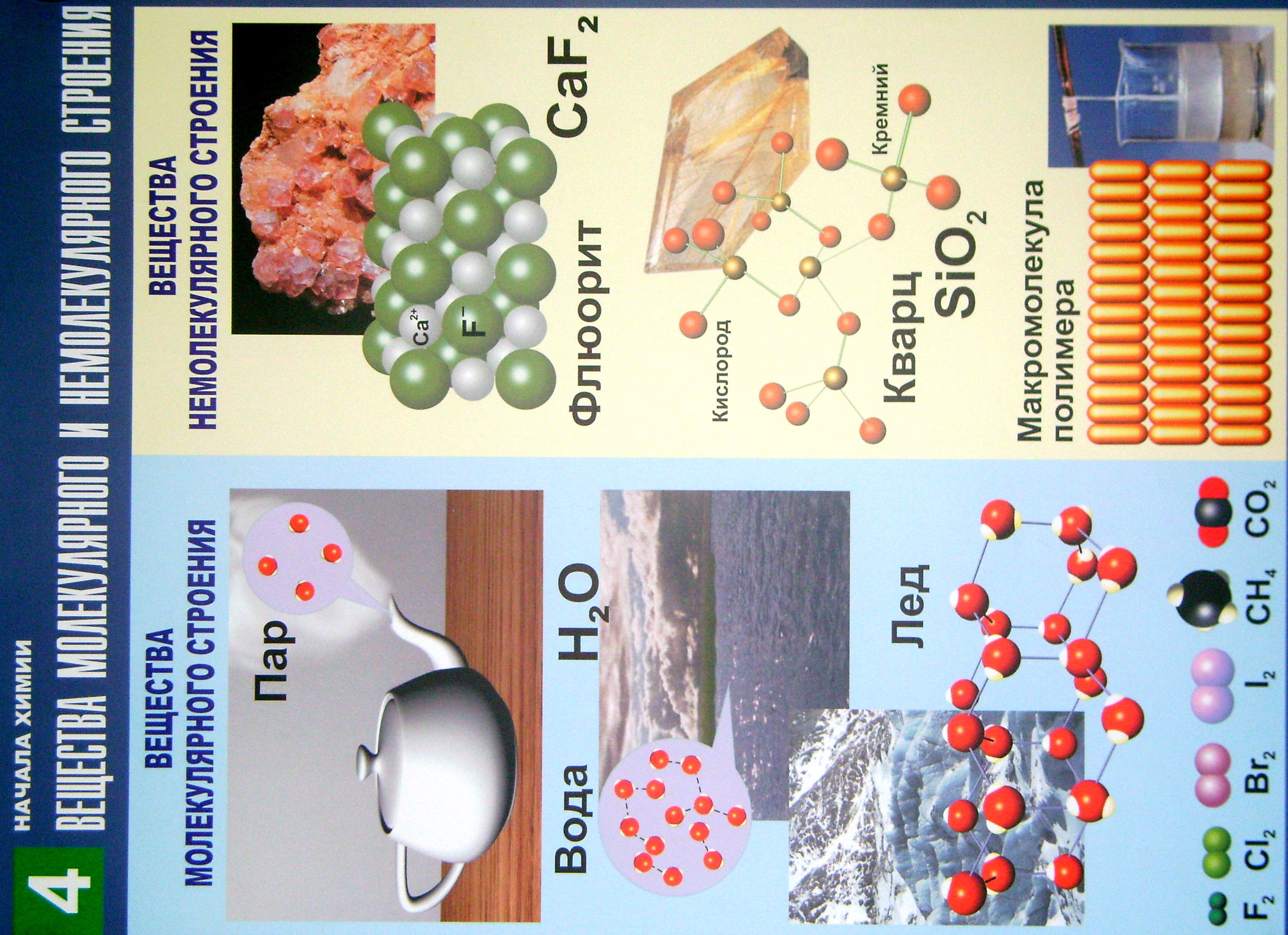
Таблица 5
Структурные изменения веществ

В газообразном состоянии частицы, составляющие вещество, находятся на большом расстоянии друг от друга и свободно передвигаются.
В отличие от газообразного состояния, в жидком и твёрдом состояниях вещества атомы (молекулы, ионы) соприкасаются друг с другом, так как сильнее взаимодействуют между собой.
В жидкости атомы (молекулы, ионы) беспорядочно двигаются, скользят относительно друг друга.
Основное отличие между жидким и твёрдым кристаллическим состояниями в том, что в кристаллическом веществе его частицы постоянно находятся в узлах кристаллической решётки, лишь испытывая тепловые колебания. Поэтому можно отличить твёрдые и жидкие вещества по внешнему виду: твёрдое имеет собственную форму, а жидкое – форму сосуда, в котором оно находится.
Таблица знакомит со структурными изменениями в различных фазовых состояниях веществ, в которых они оказываются при изменении внешних условий. При этом учитывают, что к твёрдым веществам относятся не только кристаллические, но и аморфные вещества, такие как, например, пластмасса, воск, стекло.
В таблице показаны три вещества: I2 (иод) – вещество состоит из одинаковых молекул в газообразном, жидком и твёрдом состояниях; NaCl (хлорид натрия) – двухатомные молекулы в газовой фазе, ионы Nа+ и Сl– в жидкости и кристалле; Ag (серебро) – во всех фазах состоит из атомов, причём в жидком и твёрдом состояниях их электроны делокализованы.
Химические реакции с участием жидких веществ идут со значительно большей скоростью, чем газообразные, которые обладают малой плотностью, или твёрдые, частицы которых малоподвижны.
В нижней части таблицы показана схема, иллюстрирующая фазовые переходы вещества.
При нагревании твёрдого кристаллического вещества усиливаются тепловые колебания частиц, что приводит к разрушению кристаллической решётки (для некристаллических – аморфных – веществ усиливается скорость движения частиц). Вещество начинает плавиться. При этом только для кристаллов температура плавления постоянна. Обратный процесс перехода жидкости в твёрдое вещество называется затвердеванием. Для кристаллических веществ этот процесс обычно называют кристаллизацией.
При нагревании или уменьшении давления жидкость испаряется и переходит в газообразное состояние. Переход из газообразного состояния в жидкое называется конденсацией.
Частицы некоторых твёрдых веществ (иод, мышьяк, камфора) могут непосредственно переходить в парообразное состояние (возгонка, сублимация). Обратный процесс перехода газа в твёрдое состояние называется осаждением.
