
- •Лекція 4
- •4.1. Теплоємність. Означення
- •4.1.1. Методи обчислення кількости тепла
- •1) Внутрішньої енергії
- •2) Ентальпії
- •3) Ентропії
- •4.1.2. Загальне означення теплоємности. Істинна і питома теплоємности
- •4.1.3. Обчислення кількости тепла за істинною і середньою теплоємностями
- •1 − Лінійна залежність; 2− нелінійна залежність
- •4.1.4. Геометричні образи істинної і середньої теплоємностей
- •4.2. Ізобарна та ізохорна теплоємности. Рівняння Майєра
- •4.2.1. Геометричні образи ізохорної та ізобарної теплоємностей
- •4.2.2. Зв’язок ізобарної та ізохорної теплоємностей
- •4.2.2.1. Рівняння Майєра для ідеального ґазу
- •1. Ізохорна та ізобарна теплоємности
- •2. Зв’язок між ізобарною та ізохорною теплоємностями
- •6. Рівняння Лежандра. Термодинамічна та ефективна робота
- •4.2.2.2. Рівняння Майєра для неідеального ґазу
- •4. Для неідеального ґазу, що підпорядковується рівнянню Ван-дер-Ваальса : (4.123)
- •5.3. Зв’язок теплоємности з коефіцієнтом стискуваности ґазу
- •4 .4. Теплоємність під час оборотнього політропного процесу ідеального ґазу
- •4.5. Диференціяльні рівняння теплоємности Виходячи з другого начала термодинаміки та визначення теплоємности
- •4.6. Залежність ізобарної та ізохорної теплоємностей від тиску та об’єму
- •4.7. Зв’язок теплоємности з ентропією. Диференціяльні рівняння ентропії
- •4.8. Залежність теплоємности ґазів від температури
- •4.8.1. Залежність ізобарної та ізохорної теплоємностей ґазів від температури
- •4.8.2. Залежність теплоємности від атомности ґазів і температури
- •4.9. Теплоємність рідин
- •4.10. Теплоємність твердих тіл
- •4.10.1. Молекулярно-кінетична теорія. Закон Дюлонґа і Пті
- •5.10.2. Квантова теорія Дебая
- •4 .10.3. Теплоємність шарових структур
- •4.10.3.1. Структура невзаємодіючих шарів
- •4.10.3.2. Структура із взаємодіючими шарами
4.5. Диференціяльні рівняння теплоємности Виходячи з другого начала термодинаміки та визначення теплоємности
δQх
= TdS;
Cx
=
![]() ,
(4.163)
,
(4.163)
запишемо, що
Сх
= Т
![]() .
(4.164)
.
(4.164)
Різниця між ізобарною та ізохорною теплоємностями суттєва
для ідеального ґазу ср-сV = R
для реального ґазу ср-сV > R
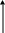
 Cn
Cn
Cp
Cv
0 1 k n
Рис.4.9. Залежність теплоємности політропного процесу від величини показника політропи
1. Для ізобарної теплоємности (р = const)
Cp
= T
![]() .
(4.165)
.
(4.165)
Разом з тим з першого і другого начал термодинаміки та визначення ентальпії
δQ = dU + pdV; TdS = dU + pdV; (4.166)
H = U + pV; dH = (dU + pdV) + Vdp, (4.167)
отримаємо
dH=TdS + Vdp; (4.168)
для р=const
dH=TdS=δQ p; (4.169)
Звідки
Ср
=
![]() =
T
.
(4.170)
=
T
.
(4.170)
2. Для ізохорної теплоємности (V=const)
CV
= T![]() (4.171)
(4.171)
δQ=dU+pdV ; TdS=dU+pdV ; (4.172)
для V=const
TdS=dU=δQ p ; (4.173)
CV
=
![]() =T
=T![]() ;
(4.174)
;
(4.174)
3. Диференціюючи рівняння H=U+pV по температурі при р=const, отримаємо:
![]() =
=![]() +p
+p![]() (4.175)
(4.175)
4. З математичного аналізу відомо, що повний диференціял функції кількох незалежних змінних z = f (x , y , w , …):
dz =
![]() +
+
![]() +
+
![]() + ... . (5.176)
+ ... . (5.176)
Частіше в хемічній термодинаміці розглядають функції двох незалежних змінних z=(x, y), то їх повний диференціял становить:
dz =
![]() dx +
dx +
![]() dy
(4.177)
dy
(4.177)
Для випадку, коли z = const , dz = 0:
dx + dy = 0. (4.178)
Звідки
+
![]() =
0 (4.179)
=
0 (4.179)
або
![]() =
–1. (4.180)
=
–1. (4.180)
Тут, вираз (4.180) отримано для z = f (x, y), аналогічно можна отримати вирази і для х = φ (y, z), і для y = ψ (x, z).
Так,
а) для величин z=р, x=v, y=T (p = f (v, T)) рівняння (4.180) має вигляд:
![]()
![]()
![]() =
–1 ; (4.181)
=
–1 ; (4.181)
б) для величин z=р, x=S, y=T (p=φ (S,T)) рівняння (4.180) має вигляд:
![]()
![]()
![]() =
–1 ;
(4.182)
=
–1 ;
(4.182)
в) для величин z=H, x=T, y=U (H=ψ (T,U)) рівняння (4.180) має вигляд:
![]()
![]()
![]() =
–1 і таке решта.
(4.183)
=
–1 і таке решта.
(4.183)
Диференціюючи (4.177) за х при умові сталого певного параметру стану ξ, отримаємо:
![]() =
+
=
+
![]() ;
(4.184)
;
(4.184)
5. Повернемося
до рівняння (4.175), щоб, використовуючи
(4.184), перейти від
![]() до
до
![]() ,
враховуючи, що z=U,
x=T,
y=V,
ξ=p:
,
враховуючи, що z=U,
x=T,
y=V,
ξ=p:
=
![]() +
+![]()
![]() .
(4.185)
.
(4.185)
З рівняння
dU=δQ–pdV і далі (4.186)
dU = TdS – pdV, (4.187)
диференціюючи рівняння (4.187) за V, отримаємо
=
T
![]() –
p
(4.188)
–
p
(4.188)
і, підставляючи з рівняння Максвелла
вираз (4.62)
=![]() (4.189)
(4.189)
в рівняння (4.188), отримаємо
=T – p (4.190)
і, підставляючи (4.190) в (4.185) і враховуючи вираз (4.174), знаходимо:
= CV + T – p . (5.191)
Підставляючи (4.191) в (4.175) і враховуючи вираз (4.170), отримуємо
с =f (p, V):
Cp – CV = T . (4.192)
За допомогою рівняння (4.181) у вигляді:
= – , (4.193)
рівняння (4.193) підставимо в (4.192), тоді отримаємо:
Cp – CV
= – T
![]() .
(4.194)
.
(4.194)
За допомогою (4.181) у вигляді:
=
–
![]() (4.195)
(4.195)
рівняння (4.195) підставимо в (4.192), тоді отримаємо:
CP
– CV
= – T
![]() .
(4.196)
.
(4.196)
6. Рівняння
СР
=
![]() =T
=T
![]() (4.197)
(4.197)
перетворимо таким чином
СР
= Т
![]() .
(4.198)
.
(4.198)
У (4.198) внесемо
рівняння Максвелла
(4.51)
![]() =
=
![]() у вигляді
у вигляді
=
![]() ,
(4.199)
,
(4.199)
отримаємо
CP = T . (4.200)
7. Рівняння
CV =
![]() = T
= T![]() (4.201)
(4.201)
перетворимо таким чином
СV
= T
![]()
![]() .
(4.202)
.
(4.202)
У (4.202) внесемо
рівняння Максвелла (4.55)
![]() =
= ![]() у вигляді
у вигляді
= – , тоді (4.203)
отримаємо:
CV = – T
![]() (4.204)
(4.204)
8.
Отримаємо співвідношення
![]() , використовуючи рівняння (4.200) і (4.204):
, використовуючи рівняння (4.200) і (4.204):
= =
–
=
–
 (4.205)
(4.205)
Так як
![]() =
1, використовуючи рівняння (4.181)
=
1, використовуючи рівняння (4.181)
![]()
![]() =
– 1
(4.206)
=
– 1
(4.206)
у вигляді
 = –
,
(4.207)
= –
,
(4.207)
отримаємо (4.205) в такому вигляді
=![]() (4.208)
(4.208)
З рівняння (4.208) випливає, що коефіцієнт адіабати k та співвідношення ізобарної та ізохорної теплоємностей дорівнює співвідношенню ізотермного (4.127) та адіабатного (4.126) коефіцієнтів стискання:
к =
= ,
(4.209)
,
(4.209)
що співпадає з (4.141).
