
- •Предисловие Модуль курса общей химии «Основы электрохимии. Редокс-процессы и равновесия» для студентов медицинского вуза включает следующие подразделы (модульные единицы):
- •Тема: Редокс-процессы (овр) и равновесия. Редокс-потенциалы, биологическая роль
- •Краткая теоретическая часть
- •Классификация овр
- •Составление уравнений овр
- •Направление овр
- •Редокс-процессы (овр) в живых организмах
- •Тема: Электрическая проводимость растворов электролитов. Кондуктометрия, ее применение в медико-биологических исследованиях
- •Краткая теоретическая часть. Основные понятия, определения, формулы
- •Электрическая проводимость. Удельная электрическая проводимость раствора.
- •Закон независимого движения ионов Кольрауша
- •Кондуктометрические методы анализа
- •Использование кондуктометрии в медицине
- •Электролиты в организме. Слюна как раствор электролитов
- •Учебно-исследовательская лабораторная работа № 1 «Определение степени и константы диссоциации уксусной кислоты кондуктометрическим методом»
- •Электродные потенциалы
- •Стандартный электродный потенциал
- •Классификация электродов
- •Поэтому водородный электрод можно использовать в качестве индикаторного для определения рН среды.
- •Активная концентрация восстановленной формы больше активной концентрации окисленной формы (рис. 12 а).
- •Активная концентрация восстановленной формы меньше активной концентрации окисленной формы (рис. 12 б).
- •Активные концентрации окисленной и восстановленной форм равны, но электронодонорная способность восстановленной формы не совпадает с электроноакцепторной способностью окисленной формы.
- •Гальванические элементы
- •Определение электродных потенциалов
- •Тема: Биопотенциалы (диффузионные, мембранные)
- •Краткая теоретическая часть Основные понятия, определения, формулы Диффузионный потенциал
- •Мембранный потенциал
- •Биоэлектрические потенциалы. Потенциалы покоя и действия
- •Тема: Потенциометрия, применение в физико-химических методах исследования
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Стеклянный водородный электрод
- •Электроды сравнения
- •Определение рН биологических жидкостей
- •Понятие о потенциометрическом титровании
- •Учебно-исследовательская лабораторная работа № 2 «Потенциометрическое определение рН биологических жидкостей»
- •Тема: Электрохимическая коррозия. Возникновение гальванопар при металлопротезировании. Коррозионная стойкость конструкционных стоматологических материалов
- •Краткая теоретическая часть
- •Учебно-исследовательская лабораторная работа № 3 «Образование микрогальванических элементов при контакте металлов»
- •Обучающие задачи с решением
- •Ответ: потенциал водородного электрода в исследуемом растворе равен –0,068 в.
- •Задачи для самостоятельного решения
- •Теоретические вопросы для студентов стоматологического факультета
- •Теоретические вопросы для студентов медико-профилактического факультета
- •Приложение
- •1.Основные величины, используемые в электрохимии
- •Значения предельных подвижностей ионов (uо, м2/(вс)) в водных растворах при 298 к.
- •3. Предельная молярная электрическая проводимость ионов (, Смм2моль–1)
- •Значения удельных электрических проводимостей
- •5. Стандартные восстановительные (редокс) потенциалы (25оС)
- •7. Потенциалы электродов сравнения
- •Литература
- •Оглавление
- •Окисление глюкозы
Учебно-исследовательская лабораторная работа № 1 «Определение степени и константы диссоциации уксусной кислоты кондуктометрическим методом»
Цель работы: Научиться экспериментально определять степень и константу диссоциации слабого электролита по результатам измерения электрической проводимости растворов разной концентрации и установить зависимость степени диссоциации и константы ионизации от концентрации кислоты.
Оборудование: Кондуктометр.
Реактивы: Растворы с концентрациями уксусной кислоты 0,02; 0,05; 0,1 и 0,2 моль/л.
Порядок выполнения работы.
Измерьте кондуктометром удельную электрическую проводимость растворов СН3СООН при возрастающей концентрации. Результаты измерения занести в таблицу:
-
с(СН3СООН), моль/л
0,02
0,05
0,1
0,2
, Смм–1
с , Смм2моль–1
Kа
Вычислите молярную электрическую проводимость растворов по уравнению:
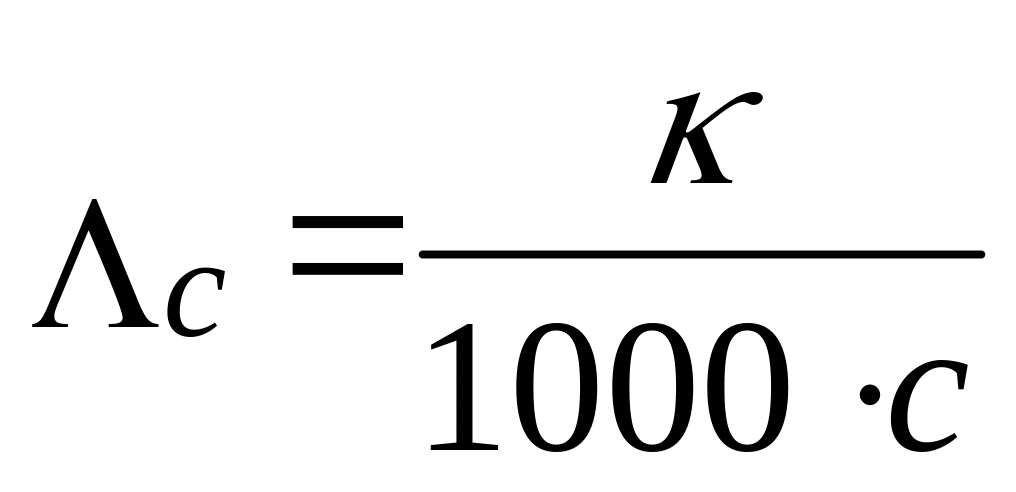 ,
,
где с – молярная концентрация уксусной кислоты, моль/л.
Определите степень диссоциации уксусной кислоты для различных концентраций по уравнению:
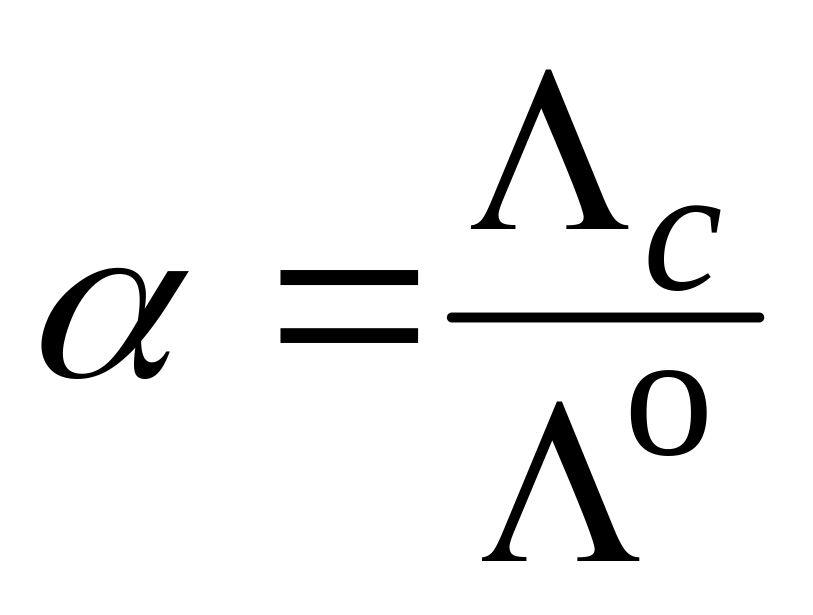 ,
,
где о
– предельная молярная электрическая
проводимость, которая согласно закону
Кольрауша равна сумме предельных
молярных проводимостей ионов: о
= ![]() +
+ ![]()
Предельные молярные электрические проводимости ионов приведены в приложении (таблица 3).
Рассчитайте константу диссоциации уксусной кислоты на основе закона разведения Оствальда:
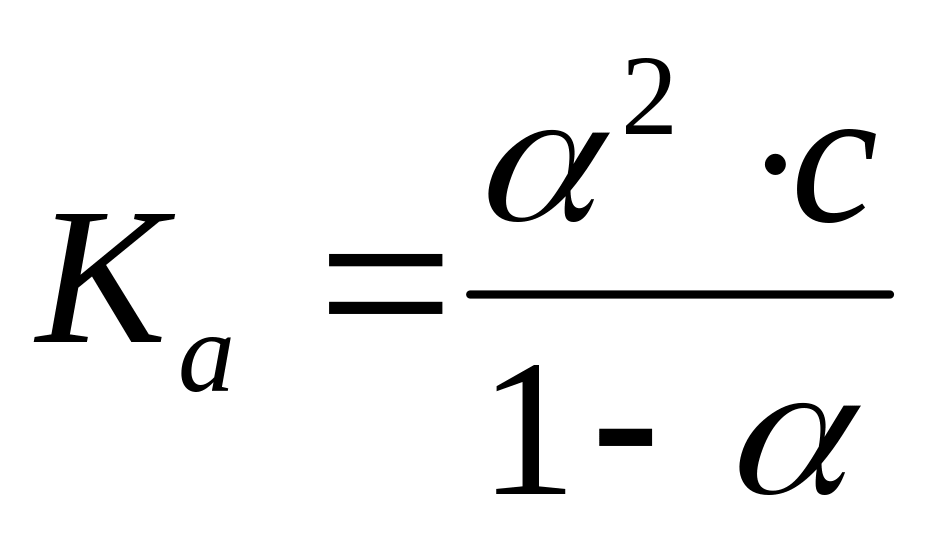 .
.
План оформления отчета:
Дата и название работы.
Цель работы
Краткое описание проведения опыта.
Результаты полученных опытных данных.
Расчеты по полученным данным.
Выводы по работе.
Контрольные вопросы для защиты работы
В чем сущность кондуктометрических методов анализа?
В чем заключаются преимущества кондуктометрического титрования в сравнении с прямой кондуктометрией?
Почему абсолютные скорости движения ионов гидроксония (водорода) и гидроксид-ионов значительно больше скоростей других ионов?
Почему молярная электрическая проводимость растворов сильных электролитов больше слабых?
Как изменяется удельная электрическая проводимость растворов слабых электролитов с увеличением концентрации слабых электролитов?
Объясните изменение молярной электрической проводимости с уменьшением концентрации для сильных и слабых электролитов.
В чем заключается сущность закона Кольрауша и каково его практическое значение?
Тема: Межфазные электрические потенциалы.
Двойной электрической слой (ДЭС).
Электродные процессы, электродные потенциалы.
Гальванические элементы
Цели изучения: сформировать представление о возникновении двойного электрического слоя на межфазной границе, видах потенциалов, возможности их определения.
Повторить: строение металлов, проводники I, II рода, активная концентрация ионов.
Учебно-целевые вопросы
Межфазные электрические потенциалы. Возникновение ДЭС.
Электродные потенциалы. Стандартные электродные потенциалы.
Классификация электродов:
электроды первого рода;
второго рода;
газовые электроды;
окислительно-восстановительные электроды
Гальванические элементы.
Краткая теоретическая часть
Основные понятия, формулы, определения
Межфазные электрические потенциалы.
Возникновение двойного электрического слоя
Если две фазы содержат заряженные частицы (ионы и электроны), то при их контакте возможен переход частиц в неэквивалентном количестве из одной фазы в другую фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется двойной электрический слой (ДЭС) (рис. 8).
F ДЭС
– это упорядоченное распределение
противоположно заряженных частиц на
границе двух фаз.
ДЭС
– это упорядоченное распределение
противоположно заряженных частиц на
границе двух фаз.
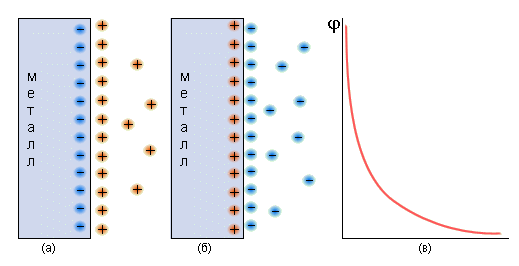
Рис. 8. Схема двойного электрического слоя (а) и (б); распределение заряда
в объеме электролита (в).
ДЭС характеризуется возникновением скачка потенциала – .
В зависимости от природы соприкасающихся фаз различают четыре вида электрических потенциалов:
Электродный потенциал, возникающий на границе металл-раствор, содержащий катионы этого металла.
Окислительно-восстановительный (редокс) потенциал, возникающий на границе инертный металл-раствор, содержащий сопряженную окислительно-восстановительную пару.
Диффузионный потенциал, возникающий на границе двух растворов, содержащих разные ионы или разные концентрации одних и тех же ионов.
Мембранный потенциал, возникающий по обе стороны мембраны, обладающей избирательной проницаемостью, разделяющей растворы различной концентрации.
В живом организме содержится множество различных соприкасающихся фаз, содержащих ионы, поэтому возникновение межфазных потенциалов имеет важное значение для жизнедеятельности организма.
