- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Гальвани-потенциал на границе двух металлов
Электродный потенциал представляет собой сложную величину, определяемую тремя отдельными скачками потенциала: скачком потенциала на границе металл электрода – платина и скачками потенциала на границах металл – раствор и платина – раствор. Теория возникновения электродного потенциала должна основываться поэтому на определённых представлениях о природе как скачка потенциала между двумя металлами, так и скачка потенциала на границе металл – раствор.
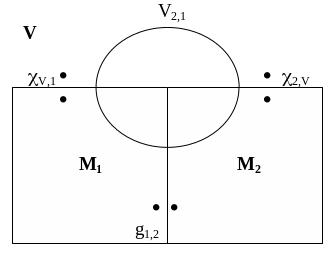
Рассмотрим вначале гальвани-потенциал g1,2 между двумя металлами. Соотношение, существующее между вольта- и гальвани-потенциалами, можно найти, используя правило, по которому сумма всех работ переноса элементарного заряда по замкнутому контуру равна нулю (см. рис. 18):
V,1 + g1,2 + 2,V + V2,1 = 0 ,
g1,2 = V1,2 + 1,V – 2,V . (3)
|
Рис. 18. Связь между вольта- и гальвани-потенциалами на границе двух металлов |
Работа переноса частицы i с зарядом zF из одной фазы в другую определяется, как известно, разностью электрохимических потенциалов этой заряженной частицы в двух фазах:
![]() –
–
![]() =
=
![]() –
–
![]() + zi
F (
+ zi
F (![]() –
–
![]() )
=
–
+ zi
Fg1,2 . (4)
)
=
–
+ zi
Fg1,2 . (4)
В условиях равновесия – = 0 и
g1,2 = ( – )/ zi F . (5)
Если обе фазы – металлы, то в обмене между ними участвуют электроны, заряд которых zi F = – F. Для этого случая можно написать
g1,2 =
![]() . (6)
. (6)
Уравнение (6) могло бы служить основой для расчёта гальвани-потенциала, если бы были известны химические потенциалы электронов в двух фазах. Однако, как уже отмечалось, определить для заряженных частиц изменение только химических потенциалов невозможно, поскольку при их переносе из одной фазы в другую одновременно с химической работой совершается также и электрическая.
Получим выражение для вольта-потенциала между фазами 1 и 2: подставим значение g1,2 из уравнения (3) в уравнение (4):
– = – + zi F1,V – zi F2,V + zi F V1,2 =
(
+ zi
F1,V
) – (
+ zi
F2,V)
+ zi
F V1,2
= –
![]() +
+
![]() + zi
F V1,2
.
+ zi
F V1,2
.
V1,2 =
![]() . (7)
. (7)
Для частного случая контакта двух металлов
V1,2 =
![]() (8)
(8)
(е – работа выхода электрона из металла).
Работа выхода электрона доступна непосредственному экспериментальному определению, и поэтому при помощи уравнения (8) можно рассчитать величину вольта-потенциала. Чем меньше работа выхода электрона из данного металла, тем при данной температуре большее число электронов может покинуть металл и перейти в вакуум и тем положительнее будет заряд обкладки дипольного слоя в металле. Если сблизить два металла с различными работами выхода, то электроны будут переходить от металла с меньшей работой выхода к металлу с большей. В результате этого первый металл зарядится положительно, а второй – отрицательно. Например, для пары CuZn VCu, Zn = 0,3 В, тогда как ЭДС системы ZnZnSO4CuSO4Cu равна 1,11 В. Таким образом, потенциал V1, 2 составляет заметную долю обратимой ЭДС электрохимической системы.